高考二轮复习知识点:共价键的形成及共价键的主要类型2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )A、原子半径: B、W与X只能形成一种化合物 C、Y的氧化物为碱性氧化物,不与强碱反应 D、W、X和Z可形成既含有离子键又含有共价键的化合物2. 已知 呈粉红色, 呈蓝色, 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:

以下结论和解释正确的是( )
A、等物质的量的 和 中σ键数之比为3:2 B、由实验①可推知△H<0 C、实验②是由于c(H2O)增大,导致平衡逆向移动 D、由实验③可知配离子的稳定性:3. B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )A、其熔点主要取决于所含化学键的键能 B、形成大π键的电子全部由N提供 C、分子中B和N的杂化方式相同 D、分子中所有原子共平面4. 工业上利用和生产尿素的原理可表示为:氨基甲基铵
下列对涉及的有关物质的说法错误的是( )
A、和尿素中的N的杂化方式相同 B、氨基甲酸铵的稳定性比尿素强 C、尿素中碳原子和氧原子的1个2p轨道重叠形成π键 D、1个尿素分子中最多有6个原子位于同一平面5. 能说明HI是共价化合物的事实是( )A、液态条件不导电 B、仅由非金属元素组成 C、水溶液具有腐蚀性 D、受热易分解6. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关含氯微粒的说法正确的是( )A、ClO2是非极性分子 B、ClO的空间构型为平面三角形 C、ClO中心原子采取sp2杂化 D、1molHClO含有2molσ键7. 立方烷的衍生物具有高致密性、高张力能及高稳定性等特点。一种立方烷衍生物的部分合成路线如下,下列说法错误的是( ) A、甲→乙为加成反应 B、乙分子中有4个手性碳原子 C、丙分子中σ键与π键数目之比为9∶1 D、甲的同分异构体中,能被氧化生成醛基的链状溴代醇只有1种8. 银氨溶液是检验醛基的重要试剂之一。配制银氨溶液的操作是向稀硝酸银溶液中滴加稀氨水至浊液刚好变澄清,发生的反应有AgNO3+NH3·H2O=AgOH↓+NH4NO3 , AgOH+2NH3=[Ag(NH3)2]++OH-。下列说法错误的是( )A、NH4NO3中N原子分别采取sp3、sp2杂化 B、[Ag(NH3)2]OH中存在共价键、配位键和离子键 C、NH3与H2O均是极性分子 D、1mol甲醛与银氨溶液反应时最多消耗2mol[Ag(NH3)2]OH9. 属于共价化合物的是( )A、SiO2 B、NaCl C、NH4Cl D、Cl210. 下列含有共价键的盐是( )A、Na2O2 B、CaCl2 C、Na[Al(OH)4] D、CH3COOCH311. 下图是CO和O在钌催化剂的表面形成化学键的过程。 下列说法正确的是( )
A、甲→乙为加成反应 B、乙分子中有4个手性碳原子 C、丙分子中σ键与π键数目之比为9∶1 D、甲的同分异构体中,能被氧化生成醛基的链状溴代醇只有1种8. 银氨溶液是检验醛基的重要试剂之一。配制银氨溶液的操作是向稀硝酸银溶液中滴加稀氨水至浊液刚好变澄清,发生的反应有AgNO3+NH3·H2O=AgOH↓+NH4NO3 , AgOH+2NH3=[Ag(NH3)2]++OH-。下列说法错误的是( )A、NH4NO3中N原子分别采取sp3、sp2杂化 B、[Ag(NH3)2]OH中存在共价键、配位键和离子键 C、NH3与H2O均是极性分子 D、1mol甲醛与银氨溶液反应时最多消耗2mol[Ag(NH3)2]OH9. 属于共价化合物的是( )A、SiO2 B、NaCl C、NH4Cl D、Cl210. 下列含有共价键的盐是( )A、Na2O2 B、CaCl2 C、Na[Al(OH)4] D、CH3COOCH311. 下图是CO和O在钌催化剂的表面形成化学键的过程。 下列说法正确的是( ) A、CO2和CO都能与碱反应生成盐和水 B、该过程中,CO先断键成C和O C、CO与O形成化学键的过程中放出能量 D、钌催化剂降低了该反应的焓变12. 二氧化氯()是一种黄绿色气体,易溶于水,在水中的溶解度约为的5倍,其水溶液在较高温度与光照下会生成与。是一种极易爆炸的强氧化性气体,实验室制备的反应为。下列关于、和的说法正确的是( )A、属于共价化合物 B、中含有非极性键 C、的空间构型为平面三角形 D、与的键角相等13. Negishi偶联反应是构筑碳碳键的重要方法之一,反应过程如图所示(R、R'表示烃基)。下列说法正确的是( )
A、CO2和CO都能与碱反应生成盐和水 B、该过程中,CO先断键成C和O C、CO与O形成化学键的过程中放出能量 D、钌催化剂降低了该反应的焓变12. 二氧化氯()是一种黄绿色气体,易溶于水,在水中的溶解度约为的5倍,其水溶液在较高温度与光照下会生成与。是一种极易爆炸的强氧化性气体,实验室制备的反应为。下列关于、和的说法正确的是( )A、属于共价化合物 B、中含有非极性键 C、的空间构型为平面三角形 D、与的键角相等13. Negishi偶联反应是构筑碳碳键的重要方法之一,反应过程如图所示(R、R'表示烃基)。下列说法正确的是( ) A、RZnCl是该反应的催化剂 B、反应过程中只生成一种偶联有机产物 C、反应过程中涉及极性键的断裂和非极性键的形成 D、存在反应
A、RZnCl是该反应的催化剂 B、反应过程中只生成一种偶联有机产物 C、反应过程中涉及极性键的断裂和非极性键的形成 D、存在反应 +RZnCl=
+RZnCl=  +ZnCl2
14. 我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是( )
+ZnCl2
14. 我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是( ) A、CO2、H2O、CH3OH均是共价化合物 B、第④步的反应式为:*HO+*H→H2O C、CO2加氢制甲醇过程中原子利用率小于100% D、增大催化剂的比表面积可提高反应速率及CO2的转化率15. 二茂铁在工业、医药、航天等领域具有广泛应用,其结构如图所示,其中Fe(Ⅱ)处在两个环戊二烯负离子(C5H )平面之间。下列有关说法错误的是( )
A、CO2、H2O、CH3OH均是共价化合物 B、第④步的反应式为:*HO+*H→H2O C、CO2加氢制甲醇过程中原子利用率小于100% D、增大催化剂的比表面积可提高反应速率及CO2的转化率15. 二茂铁在工业、医药、航天等领域具有广泛应用,其结构如图所示,其中Fe(Ⅱ)处在两个环戊二烯负离子(C5H )平面之间。下列有关说法错误的是( ) A、环戊二烯负离子中的π键可以表示为π B、二茂铁核磁共振氢谱中有三组峰 C、二茂铁中碳原子的杂化方式只有sp2 D、二茂铁中所有碳碳键键长均相等16. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、合成氨反应每生成标况下1.12 L氨气,转移的电子数为0.15NA B、1L0.1mol/L的Na2CO3溶液中,阴、阳离子的总数大于0.3NA C、NH5的结构类似于NH4Cl,则,1 mol NH5中所含σ键的数目为5NA D、钢铁电化学腐蚀生成0.05 mol Fe2O3·nH2O,则负极反应失电子数为0.2NA17. NA为阿伏加德罗常数的值。下列说法错误的是( )A、1mol白磷分子中含有P—P共价键数为6NA B、1molNH4Cl溶于水形成的溶液中阳离子总数大于NA C、1molH2O分子中氧原子的价层电子对数为4NA D、常温下,pH=10的NaHCO3溶液中,由水电离产生的H+数为10-4NA18. 有机化合物K的结构简式如图所示。下列说法正确的是( )
A、环戊二烯负离子中的π键可以表示为π B、二茂铁核磁共振氢谱中有三组峰 C、二茂铁中碳原子的杂化方式只有sp2 D、二茂铁中所有碳碳键键长均相等16. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、合成氨反应每生成标况下1.12 L氨气,转移的电子数为0.15NA B、1L0.1mol/L的Na2CO3溶液中,阴、阳离子的总数大于0.3NA C、NH5的结构类似于NH4Cl,则,1 mol NH5中所含σ键的数目为5NA D、钢铁电化学腐蚀生成0.05 mol Fe2O3·nH2O,则负极反应失电子数为0.2NA17. NA为阿伏加德罗常数的值。下列说法错误的是( )A、1mol白磷分子中含有P—P共价键数为6NA B、1molNH4Cl溶于水形成的溶液中阳离子总数大于NA C、1molH2O分子中氧原子的价层电子对数为4NA D、常温下,pH=10的NaHCO3溶液中,由水电离产生的H+数为10-4NA18. 有机化合物K的结构简式如图所示。下列说法正确的是( ) A、K的分子式为C8H12NO3Cl,属于芳香族化合物 B、K可以发生酯化、氧化、加成、消去等反应 C、K分子中的碳原子与氮原子的杂化方式相同 D、K分子中含有σ键、π键和大π键,分子间可以形成氢键19. 硼氢化钠(NaBH4)是有机反应中常用强还原剂,其在催化剂作用下与水反应获得氢气的微观过程如图所示。下列说法错误的是( )
A、K的分子式为C8H12NO3Cl,属于芳香族化合物 B、K可以发生酯化、氧化、加成、消去等反应 C、K分子中的碳原子与氮原子的杂化方式相同 D、K分子中含有σ键、π键和大π键,分子间可以形成氢键19. 硼氢化钠(NaBH4)是有机反应中常用强还原剂,其在催化剂作用下与水反应获得氢气的微观过程如图所示。下列说法错误的是( ) A、BH 、BH3、B(OH) 中B的杂化方式有两种 B、整个过程中出现了6种含硼微粒 C、NaBH4中含有离子键、共价键、配位键 D、每产生1molH2转移2mol电子20. 下列叙述正确的是( )A、价层电子排布式为2s2和3s23p5的两原子形成离子化合物 B、元素Se位于第4周期第ⅣA族,属于p区 C、非极性分子往往具有高度对称性,如BF3、CO2、PCl3、H2O2分子 D、不同元素组成的多原子分子中一定含有极性共价键21. 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中错误的是( )
A、BH 、BH3、B(OH) 中B的杂化方式有两种 B、整个过程中出现了6种含硼微粒 C、NaBH4中含有离子键、共价键、配位键 D、每产生1molH2转移2mol电子20. 下列叙述正确的是( )A、价层电子排布式为2s2和3s23p5的两原子形成离子化合物 B、元素Se位于第4周期第ⅣA族,属于p区 C、非极性分子往往具有高度对称性,如BF3、CO2、PCl3、H2O2分子 D、不同元素组成的多原子分子中一定含有极性共价键21. 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中错误的是( ) A、CH3SH中碳元素化合价为﹣2价 B、过程⑤中,形成了O-H键和C-H键 C、该催化剂可有效提高反应物的平衡转化率 D、硫化氢与甲醇合成甲硫醇的反应类型为取代反应22. 下列说法正确的是( )A、在所有元素中,氟的第一电离能最大 B、金属离子的电荷越多、半径越大,金属晶体的硬度越高 C、石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏 D、基态铜原子的价电子排布图:
A、CH3SH中碳元素化合价为﹣2价 B、过程⑤中,形成了O-H键和C-H键 C、该催化剂可有效提高反应物的平衡转化率 D、硫化氢与甲醇合成甲硫醇的反应类型为取代反应22. 下列说法正确的是( )A、在所有元素中,氟的第一电离能最大 B、金属离子的电荷越多、半径越大,金属晶体的硬度越高 C、石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏 D、基态铜原子的价电子排布图: 23. 下列过程中,共价键被破坏的是( )A、干冰升华 B、氯气被活性炭吸附 C、酒精溶于水 D、碘化氢气体溶于水
23. 下列过程中,共价键被破坏的是( )A、干冰升华 B、氯气被活性炭吸附 C、酒精溶于水 D、碘化氢气体溶于水二、非选择题
-
24. 【物质结构与性质】以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。(1)、Fe基态核外电子排布式为; 中与Fe2+配位的原子是(填元素符号)。(2)、NH3分子中氮原子的轨道杂化类型是;C、N、O元素的第一电离能由大到小的顺序为。(3)、与NH 互为等电子体的一种分子为(填化学式)。(4)、柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为mol。
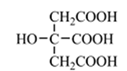 25.(1)、下列元素或化合物的性质变化顺序正确的是( )A、第一电离能:Cl>S>P>Si B、共价键的极性:HF>HCl>HBr>HI C、晶格能:NaF>NaCl>NaBr>NaI D、热稳定性:MgCO3>CaCO3>SrCO3>BaCO3(2)、黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:①CuFeS2中存在的化学键类型是。下列基态原子或离子的价层电子排布图正确的是(填标号)。
25.(1)、下列元素或化合物的性质变化顺序正确的是( )A、第一电离能:Cl>S>P>Si B、共价键的极性:HF>HCl>HBr>HI C、晶格能:NaF>NaCl>NaBr>NaI D、热稳定性:MgCO3>CaCO3>SrCO3>BaCO3(2)、黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:①CuFeS2中存在的化学键类型是。下列基态原子或离子的价层电子排布图正确的是(填标号)。
在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
a.x分子的立体构型是 , 中心原子杂化类型为 , 属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为 , 共价键的类型有。
③四方晶系CuFeS2的晶胞结构如图所示。

a.Cu+的配位数为 , S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。
26. Ni/Yb催化的不对称炔丙基化反应在药物分子合成中的应用广泛。我国科学家利用该原理合成了有机物M如图
请回答下列问题:
(1)、基态Ni原子的价电子排布式为。(2)、M是用于治疗糖尿病有效的GPR40受体激动剂。①M中同周期元素第一电离能由大到小的顺序为 , 原因为。
②M中结构片段“
 ”中4个碳原子共线的原因为。
”中4个碳原子共线的原因为。③M中的“

图I和图Ⅱ的堆积方式分别为和;二者的空间利用率之比为。
27. HgCl2稀溶液可用作外科手术刀消毒剂,HgCl2晶体熔点较低,熔融状态下不导电。(1)、HgCl2属于化合物(填“离子”或“共价”)。(2)、HgCl2和不同浓度NH3-NH4Cl反应得到某种含汞化合物的晶胞结构M如图所示:(部分微粒不在晶胞内)
①写出该含汞化合物的化学式。
②M中 (填“大于”、“小于”、或“等于”)NH3中的 ,分析原因。
③该含汞化合物晶体在水中的溶解性(填“可溶”或“难溶”),分析原因。
④在晶胞中Cl原子a的分数坐标为( , ,1),则Hg原子b的分数坐标为;晶胞的体积为V cm3 , 则该晶体的密度为 。
28. 钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)、钛和锆的价层电子结构相同,基态锆原子的价电子排布式为;与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有种。(2)、Ti(BH4)2是一种储氢材料。BH 的空间构型是 , H、B、Ti的电负性由小到大的顺序为。(3)、ZrCl4可以与乙二胺形成配合物[ ZrCl4( H2NCH2CH2NH2)]。①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为mol。
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将(填“变大”、“变小”或“不变”),原因是。
(4)、已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。
①TiO2晶胞中O2-的配位数是。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为、。
③已知二氧化锆晶胞的密度为ρ g·cm-3 , 则晶体中Zr原子和O原子之间的最短距离pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
29. 硼(B)、钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。(1)、Co基态原子价电子排布式为 , 在第二周期中,第一电离能比N高的元素是;(2)、Na[B(OH)4]可用于织物漂白。Na[B(OH)4]的化学键除了σ键外,还存在;(3)、硝酸锰是工业制备中常用的催化剂,Mn(NO3)2的NO 空间构型为;写出两种与NO 互为等电子体的微粒的化学式:;(4)、下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为(以n表示硼原子的个数);
下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为;
 (5)、立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为;(6)、一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA , 该晶体的密度为g•cm-3(用含a、NA的代数式表示)。
(5)、立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为;(6)、一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA , 该晶体的密度为g•cm-3(用含a、NA的代数式表示)。 30. 硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题:(1)、基态Se原子核外电子排布式为[Ar]。(2)、K与Cu位于同周期,金属钾的熔点比铜的低,这是因为。(3)、O、S、Se均位于元素周期表第VIA族,它们的氢化物H2O、H2S、H2Se分子的键角从大到小顺序为。(4)、配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为 , 配合离子中与Cu(Ⅱ)形成配位键的原子是 , 配体中碳原子的杂化方式是。(5)、TMTSF(
30. 硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题:(1)、基态Se原子核外电子排布式为[Ar]。(2)、K与Cu位于同周期,金属钾的熔点比铜的低,这是因为。(3)、O、S、Se均位于元素周期表第VIA族,它们的氢化物H2O、H2S、H2Se分子的键角从大到小顺序为。(4)、配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为 , 配合离子中与Cu(Ⅱ)形成配位键的原子是 , 配体中碳原子的杂化方式是。(5)、TMTSF( )中共价键的类型是 , 每个分子中含个σ键。 (6)、Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566pm,c=1128pm,该晶体的密度为(列出计算表达式)g·cm-3。
)中共价键的类型是 , 每个分子中含个σ键。 (6)、Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566pm,c=1128pm,该晶体的密度为(列出计算表达式)g·cm-3。 31. 氯气是自来水、泳池消毒剂,也是制备“84”消毒液和漂白粉的重要原料。回答下列与氯气有关的问题。(1)、氯分子内含有(填“离子”或者“共价”)键;(2)、新制氯水含有Cl2、H2O、H+、Cl-、HClO等微粒。
31. 氯气是自来水、泳池消毒剂,也是制备“84”消毒液和漂白粉的重要原料。回答下列与氯气有关的问题。(1)、氯分子内含有(填“离子”或者“共价”)键;(2)、新制氯水含有Cl2、H2O、H+、Cl-、HClO等微粒。a.将新制氯水滴到一块红纸上,红纸很快褪色,起作用的主要微粒是;
b.将新制氯水滴加到FeCl2溶液中,溶液变黄,该现象说明氯水有(填“氧化”或者“还原”)性;
(3)、写出将氯气通入氢氧化钠溶液的离子反应方程式 。32. 乙醇俗称酒精,在生活中使用广泛。资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
(1)、乙醇的结构及性质①1mol乙醇分子中的极性共价键有mol。
②从结构角度解释乙醇的沸点比乙烷高的原因 。
(2)、乙醇的用途①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 。
(3)、乙醇的工业制取乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。

该流程中能循环使用的物质是。
33. 硼(B)钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。(1)、Co基态原子核外电子排布式为 , 第二周期元素第一电离能比B高的有种;(2)、硝酸锰是工业制备中常用的催化剂,Mn(NO3)2中的化学键除了σ键外,还存在;(3)、NaBO2可用于织物漂白。BO2-的空间构型为写出两种与其互为等电子体的分子的化学式:;(4)、下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为(以n表示硼原子的个数);
下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为;
 (5)、立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为;(6)、一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA , 该晶体的密度为__g•cm-3(用含a、NA的代数式表示)。
(5)、立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为;(6)、一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA , 该晶体的密度为__g•cm-3(用含a、NA的代数式表示)。 34. 砷(As)是VA 族元素,砷及其化合物被应用于农药和合金中。回答下列问题:(1)、基态砷原子的电子排布式为 , 第四周期元素中,第一电离能低于砷原子的p区元素有 (填元素符号)。(2)、氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是。(3)、AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是。(4)、亚砷酸( H3AsO3)分子中,中心原子砷的VSEPR 模型是 , 砷原子杂化方式为。(5)、砷化镍的晶胞如图。晶胞参数a=360.2 pm, c=500.9 pm, γ=120°。
34. 砷(As)是VA 族元素,砷及其化合物被应用于农药和合金中。回答下列问题:(1)、基态砷原子的电子排布式为 , 第四周期元素中,第一电离能低于砷原子的p区元素有 (填元素符号)。(2)、氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是。(3)、AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是。(4)、亚砷酸( H3AsO3)分子中,中心原子砷的VSEPR 模型是 , 砷原子杂化方式为。(5)、砷化镍的晶胞如图。晶胞参数a=360.2 pm, c=500.9 pm, γ=120°。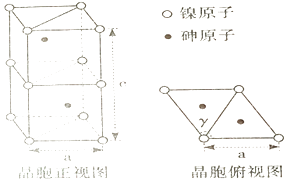
①镍原子配位数为 , 配原子构成的几何体是。
②该晶体密度的计算式为g·cm-3。
35. 在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下: (1)、Co2+基态核外电子排布式为。(2)、NH2OH 分子中氮原子轨道的杂化类型是 , 1mol NH2OH 分子中含有σ键的数目为。(3)、N、H、O 三种元素的电负性由小到大的顺序为。(4)、ClO4- 的空间构型为。(5)、一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为。
(1)、Co2+基态核外电子排布式为。(2)、NH2OH 分子中氮原子轨道的杂化类型是 , 1mol NH2OH 分子中含有σ键的数目为。(3)、N、H、O 三种元素的电负性由小到大的顺序为。(4)、ClO4- 的空间构型为。(5)、一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为。