高考二轮复习知识点:晶格能的应用
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列用物质结构知识解释原因不合理的是( )A、
 的沸点高于
的沸点高于 , 是因为其范德华力更大
B、的热稳定性大于 , 是因为键能O-H比S-H大
C、NaCl熔点大于KCl,是因为晶格能NaCl比KCl大
D、溶于氨水,是因为Zn2+能和形成稳定的
2. MgO的晶胞结构如图所示,下列有关说法正确的是( )
, 是因为其范德华力更大
B、的热稳定性大于 , 是因为键能O-H比S-H大
C、NaCl熔点大于KCl,是因为晶格能NaCl比KCl大
D、溶于氨水,是因为Zn2+能和形成稳定的
2. MgO的晶胞结构如图所示,下列有关说法正确的是( ) A、该晶体的晶胞结构与CsCl相似 B、与每个距离相等且最近的共有8个 C、一个晶胞中含有4个MgO D、晶体的熔点:CaO>MgO3. 下列物质的性质比较,结论错误的是( )A、稳定性:H2O>H2Te>H2Se>H2S B、微粒半径:r(S2-)>r(Cl-)>r(Al3+) C、晶格能:MgO>CaO>NaF>NaCl D、熔点:金刚石>碳化硅>晶体硅4. 下列关于物质结构的说法错误的是( )A、晶格能:NaF>NaCl>NaBr B、基态碳原子有三种能量不同的电子 C、CH4和NH 都是正四面体结构,键角均为109°28ˊ D、甲醛(HCHO)和光气(COCl2)分子中的键角∠H—C—H<∠Cl—C—Cl5. 下列说法正确的是( )A、金刚石与碳化硅晶体结构相似.金刚石的硬度小于碳化硅 B、PH3和NH3分子中均含有孤电子对,且NH3提供孤电子对的能力强于PH3 C、BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3 D、向1mol[Cr(H2O)4Cl2]Cl中加入足量AgNO3溶液,可以得到3mol AgCl沉淀6. 氧化锂(Li2O)是离子晶体,其晶格能可以通过图所示循环进行计算。下列说法错误的是( )
A、该晶体的晶胞结构与CsCl相似 B、与每个距离相等且最近的共有8个 C、一个晶胞中含有4个MgO D、晶体的熔点:CaO>MgO3. 下列物质的性质比较,结论错误的是( )A、稳定性:H2O>H2Te>H2Se>H2S B、微粒半径:r(S2-)>r(Cl-)>r(Al3+) C、晶格能:MgO>CaO>NaF>NaCl D、熔点:金刚石>碳化硅>晶体硅4. 下列关于物质结构的说法错误的是( )A、晶格能:NaF>NaCl>NaBr B、基态碳原子有三种能量不同的电子 C、CH4和NH 都是正四面体结构,键角均为109°28ˊ D、甲醛(HCHO)和光气(COCl2)分子中的键角∠H—C—H<∠Cl—C—Cl5. 下列说法正确的是( )A、金刚石与碳化硅晶体结构相似.金刚石的硬度小于碳化硅 B、PH3和NH3分子中均含有孤电子对,且NH3提供孤电子对的能力强于PH3 C、BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3 D、向1mol[Cr(H2O)4Cl2]Cl中加入足量AgNO3溶液,可以得到3mol AgCl沉淀6. 氧化锂(Li2O)是离子晶体,其晶格能可以通过图所示循环进行计算。下列说法错误的是( ) A、O=O键键能为ΔH3 B、Li原子的第一电离能为0.5ΔH2 C、Li2O的晶格能为ΔH6取正值 D、ΔH1+ΔH2+ΔH3+ΔH4+ΔH6=ΔH57. NaCl的玻恩-哈伯循环如图所示。已知:将1mol金属转变成气态原子所需的最小能量称为原子化热。下列说法错误的是( )
A、O=O键键能为ΔH3 B、Li原子的第一电离能为0.5ΔH2 C、Li2O的晶格能为ΔH6取正值 D、ΔH1+ΔH2+ΔH3+ΔH4+ΔH6=ΔH57. NaCl的玻恩-哈伯循环如图所示。已知:将1mol金属转变成气态原子所需的最小能量称为原子化热。下列说法错误的是( ) A、Na(s)的原子化热为△H1 B、Na的第一电离能为△H3 C、Cl-Cl键的键能为△H2 D、NaCl的晶格能为△H58. 下面的排序错误的是( )A、晶体熔点由低到高:CF4﹤CCl4﹤CBr4﹤CI4 B、硬度由大到小:金刚石>碳化硅>晶体硅 C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 D、晶格能由大到小: NaI>NaBr> NaCl>NaF9. 下列表述错误的是( )A、熔点:CF4<CCl4<CBr4<Cl4 B、硬度:金刚石>碳化硅>晶体硅 C、晶格能:NaF>NaCl>NaBr>Nal D、熔点:Na>Mg>Al10. 已知MgCO3 、CaCO3、SrCO3、BaCO3受热均要分解。下列说法错误的是( )A、上述四种盐的晶体均属于离子晶体 B、分解所得金属氧化物晶格能最大的是MgO C、分解所需温度最低的是BaCO3 D、所得的气态产物的VSEPR模型是直线形11. 下列有关元素或者化合物性质的比较中,正确的是A、结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以 B、Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大 C、在分子中,两个原子间的键长越长,键能越大 D、一般而言,晶格能越高,离子晶体的熔点越高、硬度越大12. 下面的排序错误的是A、含氧酸酸性强弱: B、硬度由大到小:金刚石 碳化硅 晶体硅 C、熔点由高到低: D、晶格能由大到小:13. 下列说法错误的是( )A、晶格能由大到小:MgO>CaO>NaF> NaCl B、某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时生成的阳离子是X2+ C、熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、离子晶体 D、含极性键的非极性分子往往是高度对称的分子,比如CO2、BF3、CH4这样的分子14. 下列说法正确的是( )
A、Na(s)的原子化热为△H1 B、Na的第一电离能为△H3 C、Cl-Cl键的键能为△H2 D、NaCl的晶格能为△H58. 下面的排序错误的是( )A、晶体熔点由低到高:CF4﹤CCl4﹤CBr4﹤CI4 B、硬度由大到小:金刚石>碳化硅>晶体硅 C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 D、晶格能由大到小: NaI>NaBr> NaCl>NaF9. 下列表述错误的是( )A、熔点:CF4<CCl4<CBr4<Cl4 B、硬度:金刚石>碳化硅>晶体硅 C、晶格能:NaF>NaCl>NaBr>Nal D、熔点:Na>Mg>Al10. 已知MgCO3 、CaCO3、SrCO3、BaCO3受热均要分解。下列说法错误的是( )A、上述四种盐的晶体均属于离子晶体 B、分解所得金属氧化物晶格能最大的是MgO C、分解所需温度最低的是BaCO3 D、所得的气态产物的VSEPR模型是直线形11. 下列有关元素或者化合物性质的比较中,正确的是A、结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以 B、Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大 C、在分子中,两个原子间的键长越长,键能越大 D、一般而言,晶格能越高,离子晶体的熔点越高、硬度越大12. 下面的排序错误的是A、含氧酸酸性强弱: B、硬度由大到小:金刚石 碳化硅 晶体硅 C、熔点由高到低: D、晶格能由大到小:13. 下列说法错误的是( )A、晶格能由大到小:MgO>CaO>NaF> NaCl B、某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时生成的阳离子是X2+ C、熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、离子晶体 D、含极性键的非极性分子往往是高度对称的分子,比如CO2、BF3、CH4这样的分子14. 下列说法正确的是( )①具有规则几何外形的固体一定是晶体
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
A、①②⑤⑥ B、③④⑥⑦ C、②④⑦⑧ D、③④⑤⑧15. 1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )A、Na+(g)+Cl-(g) =NaCl(s); △H1 B、Na(s)+ Cl2(g)=NaCl(s); △H2 C、Na+(l)+Cl-(l)=NaCl(s); △H3 D、Na(g)+ Cl2(g)=NaCl(s); △H4二、多选题
-
16. 是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

下列说法错误的是( )
A、 原子的第一电离能为 B、 键的键能为 C、 的晶格能为 D、 转变成 需要吸收的能量为17. 锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( ) A、该晶体属于分子晶体 B、该晶胞中Zn2+和S2﹣数目相等 C、阳离子的配位数为6 D、氧化锌的熔点高于硫化锌
A、该晶体属于分子晶体 B、该晶胞中Zn2+和S2﹣数目相等 C、阳离子的配位数为6 D、氧化锌的熔点高于硫化锌三、非选择题
-
18.(1)、下列元素或化合物的性质变化顺序正确的是( )A、第一电离能:Cl>S>P>Si B、共价键的极性:HF>HCl>HBr>HI C、晶格能:NaF>NaCl>NaBr>NaI D、热稳定性:MgCO3>CaCO3>SrCO3>BaCO3(2)、黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:①CuFeS2中存在的化学键类型是。下列基态原子或离子的价层电子排布图正确的是(填标号)。

在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
a.x分子的立体构型是 , 中心原子杂化类型为 , 属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为 , 共价键的类型有。
③四方晶系CuFeS2的晶胞结构如图所示。

a.Cu+的配位数为 , S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。
19. 很多过渡金属及其化合物在工业上有重要用途。(1)、钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。①Fe的基态原子价电子排布式为。
②Ti的基态原子共有种不同能级的电子。
(2)、制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。①上述化学方程式中非金属元素电负性由小到大的顺序是(用元素符号表示)。
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为 , COCl2分子的中心原子的杂化方式为。
(3)、NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为。(4)、Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
①该晶体的化学式为。
②已知该晶胞的摩尔质量为Mg·mol-1 , 密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为。(NA可近似取6×1023 , =1.7)
20. 过渡金属元素在日常生活中有广泛的应用。(1)、金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为 ;基态 Mn原子核外有种运动状态不同的电子,M层的电子云有种不同的伸展方向。(2)、第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是(3)、NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验 K+的存在。与NO2-互为等电子体的微粒(写出一种),K3[Co(NO2)6]中存在的作用力有a.σ键 b.π键 c.配位键 d.离子键 e.范德华力(4)、锰的一种配合物的化学式为 Mn(BH4)2(THF)3 , BH4-的空间构型为(5)、FeO 是离子晶体,其晶格能可通过下图中的 Born—Haber 循环计算得到。
可知,O原子的第一电子亲和能为 kJ•mol-1 , FeO晶格能为kJ•mol-1。
(6)、铜与氧可形成如图所示的晶胞结构,其中 Cu 均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为 , 已知该晶体的密度为ρg•cm-3 , NA是阿伏加德罗常数的值,则晶胞参数为pm
(列出计算式即可)
21. 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:(1)、现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是(填字母)。A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)、砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为。砷酸的酸性弱于硒酸,从分子结构的角度解释原因。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为 , 画出配离子的结构式(不考虑立体构型)。
(3)、铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为。
②铬的晶胞结构如图A所示,它的堆积模型为 , 在该晶胞中铬原子的配位数为。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为 , 六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA , 则碳化钨晶体的密度是g·cm-3(列出计算表达式)。
 22. 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:(1)、元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。A、404.4 B、553.5 C、589.2 D、670.8 E、766.5(2)、基态K原子中,核外电子占据的最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是。(3)、X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为 , 中心原子的杂化形式为。(4)、KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为nm,与K紧邻的O个数为。(5)、在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于位置,O处于位置。
22. 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:(1)、元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。A、404.4 B、553.5 C、589.2 D、670.8 E、766.5(2)、基态K原子中,核外电子占据的最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是。(3)、X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为 , 中心原子的杂化形式为。(4)、KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为nm,与K紧邻的O个数为。(5)、在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于位置,O处于位置。 .23. N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。(1)、基态N 原子最高能级的电子云轮廓图形状为;N原子的第一电离能比O原子的大,其原因是 , 基态铁原子的价电子排布图为(2)、在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是。
.23. N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。(1)、基态N 原子最高能级的电子云轮廓图形状为;N原子的第一电离能比O原子的大,其原因是 , 基态铁原子的价电子排布图为(2)、在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是。 (3)、叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
(3)、叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。①写出与N3-属于等电子体的一种分子(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)、某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为(填最简整数比);已知该晶体的密度dg/cm3 , 阿伏加德罗常数的值为NA , 则晶胞参数为nm(用含d和NA的代数式表示)。 (5)、一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为。
(5)、一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为。 24. 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。(1)、A元素的基态原子价电子排布式:。(2)、X的化学名称为。(3)、试解释工业冶炼D不以DE3而是以D2A3为原料的原因:。(4)、CE、FA的晶格能分别为786 kJ·mol-1、3401 kJ·mol-1 , 试分析导致两者晶格能差异的主要原因是。(5)、F与B可形成离子化合物,其晶胞结构如下图所示。F与B形成的离子化合物的化学式为;该离子化合物晶体的密度为a g·cm-3 , 则晶胞的体积是(只要求列出算式)。
24. 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。(1)、A元素的基态原子价电子排布式:。(2)、X的化学名称为。(3)、试解释工业冶炼D不以DE3而是以D2A3为原料的原因:。(4)、CE、FA的晶格能分别为786 kJ·mol-1、3401 kJ·mol-1 , 试分析导致两者晶格能差异的主要原因是。(5)、F与B可形成离子化合物,其晶胞结构如下图所示。F与B形成的离子化合物的化学式为;该离子化合物晶体的密度为a g·cm-3 , 则晶胞的体积是(只要求列出算式)。 25. 在研究金属矿物质组分的过程中,通过分析发现了多金属互化物。(1)、某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”),可通过方法鉴别。(2)、配合物常温下为液态,易溶于、苯等有机溶剂。固态属于晶体;和的半径分别为和 , 则晶体熔点(填“<”或“>”)(3)、铜能与类卤素反应生成 , 分子含有σ键的数目为;写出一种与互为等电子体的分子(化学式表示)。(4)、往溶液中通入足量能生成配合物。其中中心原子的杂化轨道类型为 , 中存在的化学键类型除了极性共价键外,还有。(5)、立方(氧化镍)晶体的结构如图一所示,人工制备的晶体中常存在的缺陷(如图二):一个空缺,另有两个被两个所取代,其结果晶体仍呈电中性,但化合物中和O的比值却发生了变化。已知某氧化镍样品组成 , 该晶体中与的离子个数之比为。
25. 在研究金属矿物质组分的过程中,通过分析发现了多金属互化物。(1)、某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”),可通过方法鉴别。(2)、配合物常温下为液态,易溶于、苯等有机溶剂。固态属于晶体;和的半径分别为和 , 则晶体熔点(填“<”或“>”)(3)、铜能与类卤素反应生成 , 分子含有σ键的数目为;写出一种与互为等电子体的分子(化学式表示)。(4)、往溶液中通入足量能生成配合物。其中中心原子的杂化轨道类型为 , 中存在的化学键类型除了极性共价键外,还有。(5)、立方(氧化镍)晶体的结构如图一所示,人工制备的晶体中常存在的缺陷(如图二):一个空缺,另有两个被两个所取代,其结果晶体仍呈电中性,但化合物中和O的比值却发生了变化。已知某氧化镍样品组成 , 该晶体中与的离子个数之比为。 26. 2019年诺贝尔化学奖表彰了在锂离子电池研究方面做出的贡献。目前锂离子电池常用的电极材料是LiCoO2和石墨。(1)、基态Co2+的价电子轨道表示式为。(2)、Co2+与CN-结合形成配合物[Co(CN)6]4- , 其中与Co2+结合的C原子的杂化方式是。(3)、NH3分子与Co2+结合成配合物[Co(NH3)6]2+ , 与游离的氨分子相比,其键角∠HNH(填“较大”,“较小”或“相同”),解释原因。(4)、Li2O熔点为1570℃,CoO的熔点为1935℃,解释后者熔点更高的主要原因是。(5)、图(a)所示石墨晶体按ABAB方式堆积而成,图(b)为石墨的六方晶胞。
26. 2019年诺贝尔化学奖表彰了在锂离子电池研究方面做出的贡献。目前锂离子电池常用的电极材料是LiCoO2和石墨。(1)、基态Co2+的价电子轨道表示式为。(2)、Co2+与CN-结合形成配合物[Co(CN)6]4- , 其中与Co2+结合的C原子的杂化方式是。(3)、NH3分子与Co2+结合成配合物[Co(NH3)6]2+ , 与游离的氨分子相比,其键角∠HNH(填“较大”,“较小”或“相同”),解释原因。(4)、Li2O熔点为1570℃,CoO的熔点为1935℃,解释后者熔点更高的主要原因是。(5)、图(a)所示石墨晶体按ABAB方式堆积而成,图(b)为石墨的六方晶胞。
每个晶胞中的碳原子个数为 , 在下图中画出晶胞沿c轴的投影(用“●”标出碳原子位置即可)。
 27. 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。回答下列问题:(1)、 、 常用作锂离子电池的正极材料。基态钻原子的价电子排布式为;基态磷原子中,电子占据的最高能层符号为。(2)、锂离子电池的电解液有 等,碳酸亚乙酯(
27. 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。回答下列问题:(1)、 、 常用作锂离子电池的正极材料。基态钻原子的价电子排布式为;基态磷原子中,电子占据的最高能层符号为。(2)、锂离子电池的电解液有 等,碳酸亚乙酯( )用作该电解液的添加剂。 中阴离子的空间构型为;碳酸亚乙酯分子中碳原子的杂化方式为。 (3)、已知 的半径为 , 的半径为 ,由此推断在隔绝空气条件下分别加热 、 ,其中的分解温度低,原因是。(4)、 是目前研发的锂离子电池的新型固体电解质,为立方晶系晶体,晶胞参数为 ,晶胞截面图如图所示。
)用作该电解液的添加剂。 中阴离子的空间构型为;碳酸亚乙酯分子中碳原子的杂化方式为。 (3)、已知 的半径为 , 的半径为 ,由此推断在隔绝空气条件下分别加热 、 ,其中的分解温度低,原因是。(4)、 是目前研发的锂离子电池的新型固体电解质,为立方晶系晶体,晶胞参数为 ,晶胞截面图如图所示。




每个晶胞中含有的 数目为; 填充在 构成的空隙中,每一个空隙由个 构成,空隙的空间形状为。
28. 锰元素在多个领域中均有重要应用,回答下列问题。(1)、Mn在元素周期表中位于区;MnSO4中阳离子的价电子排布式为;(2)、Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______A、Mn3+的价电子构型为3d4 , 不属于较稳定的电子构型 B、根据Mn2+的电子构型可知,Mn4+中不含成对电子 C、Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子 D、Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似(3)、在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为(4)、二价锰的化合物的性质如下表所示:物质
MCl2
MnS
MnSO4
熔点
650℃
1610℃
700℃
上表三种物质中晶格能最大的是;上表涉及的三种阴离子中,半径最大的是。
(5)、某锰氧化物的晶胞结构如下图所示:
该锰的氧化物的化学式为 , 该晶体中Mn的配位数为 , 该晶体中Mn之间的最近距离为pm(用a、b来表示)。
29. 物质结构包括原子结构、分子结构及晶体结构,物质结构决定了物质的性质。(1)、下列说法中正确的是_________。A、半径:O2->Na+> Mg2+ B、含氧酸的酸性:Cl>S>P C、简单氢化物的稳定性:N>O>F D、熔点:金刚石>碳化硅>硅单质(2)、C、N、O的电负性由大到小的顺序为。Na、Mg、Al的第一电离能由大到小的顺序为。(3)、乙酸分子中σ键与π键的数目比为。HCOOCH3是乙酸的一种同分异构体,但沸点却比乙酸低得多,原因是。(4)、已知AlCl3在178℃升华,熔融时生成二聚体Al2Cl6(结构式如下)。
电解法制铝的原料是熔融的Al2O3而不是AlCl3 , 原因是;电解法制镁的原料是熔融的MgCl2而不用MgO,原因是。
30. 钻(Co)是生产耐热介金、硬质介金、防介金、磁性合金和各种钻盐的重要原料。请回答下列问题:(1)、基态Co原子的价电子排布式为。(2)、Co同周期同族的三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为(用化学式表示)。(3)、含钴配合物的中心离子的配位数为 , 其中N采取的杂化类型为。(4)、钴蓝晶体结构如图所示,该立方晶胞有4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为 , 设阿伏加德罗常数的值为 , 该晶体密度为(列计算式)。 31. 含硼物质在生产生活中有着广泛应用。回答下列问题:(1)、用法测得硼晶体具有金刚石型结构,其微粒之间存在的作用力是。(2)、一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于晶体,熔点比晶体硼(填“高”或“低”)。(3)、N-甲基咪唑的结构为
31. 含硼物质在生产生活中有着广泛应用。回答下列问题:(1)、用法测得硼晶体具有金刚石型结构,其微粒之间存在的作用力是。(2)、一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于晶体,熔点比晶体硼(填“高”或“低”)。(3)、N-甲基咪唑的结构为 , 它的某种衍生物与形成的离子化合物
, 它的某种衍生物与形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物
 熔点低的原因是。
熔点低的原因是。②分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为)。
 中存在大π键,其分子中的大π键可表示为。
中存在大π键,其分子中的大π键可表示为。③1mol离子化合物
 中,阿伏加德罗常数的值为 , 则根据价电子对互斥()理论,空间结构为四面体的原子共有个。32. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。(1)、Ni元素位于周期表中区,基态Ni2+外围电子排布图是。(2)、Ni(CO)4常用作制备高纯镍粉,常温下为液态,易溶于CCl4、苯等有机溶剂。则:
中,阿伏加德罗常数的值为 , 则根据价电子对互斥()理论,空间结构为四面体的原子共有个。32. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。(1)、Ni元素位于周期表中区,基态Ni2+外围电子排布图是。(2)、Ni(CO)4常用作制备高纯镍粉,常温下为液态,易溶于CCl4、苯等有机溶剂。则:①Ni(CO)4固态时属于晶体(填晶体类型)
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为 , 请事写出一种与CO互为等电子体的阴离子的化学式。
(3)、NiSO4常用于电镀工业,丁二酮肟(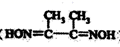 )是检验Ni2+的灵敏试剂,其中碳原子不存在杂化(填“sp”、“sp2”或“sp3”)。 (4)、NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知晶胞边长为a pm,阿伏加德罗常数为NA , NiO晶体的密度为g/cm3(只列出计算式)。
)是检验Ni2+的灵敏试剂,其中碳原子不存在杂化(填“sp”、“sp2”或“sp3”)。 (4)、NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知晶胞边长为a pm,阿伏加德罗常数为NA , NiO晶体的密度为g/cm3(只列出计算式)。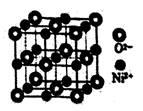 (5)、NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)r(Fe2+)(填“<”或“”>),请简述判断理由。33. 金属材料在国民经济建设等领域具有重要应用,镁、镍、铬、铜是几种重要的金属元素,请回答下列问题:
(5)、NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)r(Fe2+)(填“<”或“”>),请简述判断理由。33. 金属材料在国民经济建设等领域具有重要应用,镁、镍、铬、铜是几种重要的金属元素,请回答下列问题: (1)、查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是。(2)、Ni与CO能形成配合物Ni(CO)4 , 该分子中σ键的个数为 , π键个数为 , 与CO互为等电子体的分子是。(3)、无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3。已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构简式。(4)、铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,该晶体的化学式为 , a、b的坐标参数依次为(0,0,0)、( , , ),则d的坐标参数为 , 已知该品体的密度为ρg·cm-3 , NA是阿伏加德罗常数值,则晶胞参数为cm(用含ρ的代数式表示)。
(1)、查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是。(2)、Ni与CO能形成配合物Ni(CO)4 , 该分子中σ键的个数为 , π键个数为 , 与CO互为等电子体的分子是。(3)、无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3。已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构简式。(4)、铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,该晶体的化学式为 , a、b的坐标参数依次为(0,0,0)、( , , ),则d的坐标参数为 , 已知该品体的密度为ρg·cm-3 , NA是阿伏加德罗常数值,则晶胞参数为cm(用含ρ的代数式表示)。