高考二轮复习知识点:离子键的形成
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 广东是岭南文化的集萃地。下列有关岭南文化的说法错误的是( )A、“海丝文化”:海上丝绸贸易用于交易的银锭中仅存在离子键 B、“茶艺文化”:沏泡功夫茶利用了萃取原理,水作萃取剂 C、“建筑文化”:制作博古梁架时,在木材上雕刻花纹的过程主要发生物理变化 D、“戏剧文化”:现代粤剧舞台上灯光光柱的形成是因为丁达尔效应2. 下列说法正确的是A、H2O、H2S、H2Se的分子间作用力依次增大 B、SiO2和晶体硅都是共价化合物,都是共价晶体 C、NaOH和K2SO4的化学键类型和晶体类型相同 D、NaHSO4加热熔化时破坏了该物质中的离子键和共价键3. NaI晶体中两核间距约0.28 nm,呈共价键;激光脉冲照射NaI时,Na+和I—两核间距为1.0~1.5 nm,呈离子键。下列说法正确的是( )A、离子化合物中不可能含共价键 B、共价键和离子键之间没有明显界线 C、NaI晶体中既有离子键又有共价键 D、NaI晶体是离子化合物和共价化合物的混合物4. 下列化学用语对事实的表述正确的是( )A、用碳酸钠溶液处理锅炉水垢:Ca2++CaCO3↓ B、由Na和Cl形成离子键的过程:
 C、三价铁腐蚀铜的电路板:2Fe3++3Cu=2Fe+3Cu2+
D、电解饱和食盐水阳极的电极反应:2H2O+2e−=2OH−+H2↑
5. 在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图的转化过程。下列说法正确的是( )
C、三价铁腐蚀铜的电路板:2Fe3++3Cu=2Fe+3Cu2+
D、电解饱和食盐水阳极的电极反应:2H2O+2e−=2OH−+H2↑
5. 在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图的转化过程。下列说法正确的是( ) A、铜元素位于周期表中的d区 B、步骤④中仅有共价键的断裂 C、甲酸乙酯是该过程的中间产物 D、该反应过程中,催化剂不参与反应,只是降低了反应的活化能6. 已知:O2+PtF6→O2(PtF6)。PtF6易挥发,O2(PtF6)是离子化合物,其中Pt元素为+5价。对此反应的叙述正确的是( )A、PtF6是还原剂 B、O2(PtF6)中O元素的化合价为+1 C、每生成1molO2(PtF6)转移1mol电子 D、O2(PtF6)只含离子键,具有氧化性7. X、Y、Z、W是原子序数依次增大的四种短周期元素,其中X、W同主族,X原子的最外层电子数是次外层的3倍,Y的最高价氧化物对应水化物的碱性在短周期中最强,Z单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )A、原子半径:X<Y<Z<W B、X 与Y形成的化合物中只含离子键 C、简单氢化物的热稳定性:W>Z D、ZX2能与碱反应,但不能与任何酸反应8. 图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是( )
A、铜元素位于周期表中的d区 B、步骤④中仅有共价键的断裂 C、甲酸乙酯是该过程的中间产物 D、该反应过程中,催化剂不参与反应,只是降低了反应的活化能6. 已知:O2+PtF6→O2(PtF6)。PtF6易挥发,O2(PtF6)是离子化合物,其中Pt元素为+5价。对此反应的叙述正确的是( )A、PtF6是还原剂 B、O2(PtF6)中O元素的化合价为+1 C、每生成1molO2(PtF6)转移1mol电子 D、O2(PtF6)只含离子键,具有氧化性7. X、Y、Z、W是原子序数依次增大的四种短周期元素,其中X、W同主族,X原子的最外层电子数是次外层的3倍,Y的最高价氧化物对应水化物的碱性在短周期中最强,Z单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )A、原子半径:X<Y<Z<W B、X 与Y形成的化合物中只含离子键 C、简单氢化物的热稳定性:W>Z D、ZX2能与碱反应,但不能与任何酸反应8. 图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是( ) A、A中只含有离子键 B、B物质可以和Y反应直接转化为E C、D,E均可以用向上排空气法收集 D、通过氢氧化钠溶液可以除去D中含有的少量E9. 下列化合物中既有离子键又有共价键的化合物是( )A、H2O2 B、Na2O C、NH4Cl D、Mg3N210. 有关物质结构概念的判断正确的是( )A、离子键:阴阳离子间的静电吸引作用 B、离子化合物:只含离子键的物质 C、共价键:通过共用电子对产生的作用 D、共价化合物:含有共价键的物质11. X、Y、Z、W为短周期主族元素且原子序数依次增大,X原子在元素周期表中半径最小,有机物中都含有Y元素,Y、Z、W同周期,由四种元素形成的一种化合物甲的结构如图所示。下列说法错误的是( )
A、A中只含有离子键 B、B物质可以和Y反应直接转化为E C、D,E均可以用向上排空气法收集 D、通过氢氧化钠溶液可以除去D中含有的少量E9. 下列化合物中既有离子键又有共价键的化合物是( )A、H2O2 B、Na2O C、NH4Cl D、Mg3N210. 有关物质结构概念的判断正确的是( )A、离子键:阴阳离子间的静电吸引作用 B、离子化合物:只含离子键的物质 C、共价键:通过共用电子对产生的作用 D、共价化合物:含有共价键的物质11. X、Y、Z、W为短周期主族元素且原子序数依次增大,X原子在元素周期表中半径最小,有机物中都含有Y元素,Y、Z、W同周期,由四种元素形成的一种化合物甲的结构如图所示。下列说法错误的是( ) A、最高化合价:W> Z>Y> X B、(YZ)2和YW2均为直线型分子 C、化合物甲的一种同分异构体可能既有离子键又有共价键 D、X分别与Y、Z、W形成电子总数为10的分子,沸点最高的是X2W12. 含有两种不同类型化学键的物质是( )A、NaOH B、N2 C、CaCl2 D、CO213. 下列说法不正确的是( )A、HF 比 HCl 稳定性更强,原因是 HF 分子间存在氢键 B、Na 投入到水中,有共价键的断裂与形成 C、CCl4、N2 和 SiO2 晶体中,各原子最外层都达到 8 电子稳定结构 D、NaHSO4 晶体熔融时,离子键被破坏,共价键不受影响14. 下列物质中,只含有离子键的是()A、H2O B、CO2 C、MgCl2 D、NaOH15. 氯化氢气体溶于水的过程中,破坏了()A、离子键 B、范德华力 C、共价键 D、金属键16. 下列说法正确的是( )A、BCl3 和 PCl3 中,每个原子的最外层都具有 8 电子稳定结构 B、所有共价化合物熔化时需克服微粒间的作用力类型都相同 C、NaHSO4 晶体熔融时,离子键被破坏,共价键不受影响 D、NH3 和 CO2 两种分子中,每个原子的最外层都具有 8 电子稳定结构17. 有关NaOH溶于水的过程,叙述正确的是( )A、只发生水合过程 B、只发生扩散过程 C、破坏了离子键 D、破坏了共价键18. 四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法错误的是( )A、气态氢化物的稳定性Y<Z B、W与X形成的化合物中只存在离子键 C、W的氢化物分子之间都能形成氢键 D、W、X、Y三种元素组成的化合物的水溶液不一定呈中性19. 以下过程与化学键断裂无关的是( )
A、最高化合价:W> Z>Y> X B、(YZ)2和YW2均为直线型分子 C、化合物甲的一种同分异构体可能既有离子键又有共价键 D、X分别与Y、Z、W形成电子总数为10的分子,沸点最高的是X2W12. 含有两种不同类型化学键的物质是( )A、NaOH B、N2 C、CaCl2 D、CO213. 下列说法不正确的是( )A、HF 比 HCl 稳定性更强,原因是 HF 分子间存在氢键 B、Na 投入到水中,有共价键的断裂与形成 C、CCl4、N2 和 SiO2 晶体中,各原子最外层都达到 8 电子稳定结构 D、NaHSO4 晶体熔融时,离子键被破坏,共价键不受影响14. 下列物质中,只含有离子键的是()A、H2O B、CO2 C、MgCl2 D、NaOH15. 氯化氢气体溶于水的过程中,破坏了()A、离子键 B、范德华力 C、共价键 D、金属键16. 下列说法正确的是( )A、BCl3 和 PCl3 中,每个原子的最外层都具有 8 电子稳定结构 B、所有共价化合物熔化时需克服微粒间的作用力类型都相同 C、NaHSO4 晶体熔融时,离子键被破坏,共价键不受影响 D、NH3 和 CO2 两种分子中,每个原子的最外层都具有 8 电子稳定结构17. 有关NaOH溶于水的过程,叙述正确的是( )A、只发生水合过程 B、只发生扩散过程 C、破坏了离子键 D、破坏了共价键18. 四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法错误的是( )A、气态氢化物的稳定性Y<Z B、W与X形成的化合物中只存在离子键 C、W的氢化物分子之间都能形成氢键 D、W、X、Y三种元素组成的化合物的水溶液不一定呈中性19. 以下过程与化学键断裂无关的是( )
A、氯化钠熔化 B、金刚石熔化 C、金属汞汽化 D、干冰升华20. 下列变化中离子键被破坏的是( )A、氯化氢溶于水 B、石墨转化为金刚石 C、钠在氯气中燃烧 D、加热氯化钠至熔化21. 在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3 , 下列表述正确的是( )A、中子数为32,质子数为27的钴原子: B、H2O2的电子式: C、NH3和NH4Cl化学键类型相同
D、[Co(NH3)6]Cl3中Co的化合价是+3
C、NH3和NH4Cl化学键类型相同
D、[Co(NH3)6]Cl3中Co的化合价是+3
二、非选择题
-
22. UO2与铀氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
回答下列问题:
(1)、基态氮原子价电子排布图为。(2)、反应所得气态化合物中属于非极性分子的是(填化学式)。(3)、某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是(填标号)。
a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(4)、依据VSEPR理论推测CO32-的空间构型为。分子中的大丌键可用符号丌 表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大丌键可表示为丌 ),则CO32-中的大丌键应表示为(5)、UO2可用于制备UF4:2UO2+5NH4HF2 2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]- , 反应中断裂的化学键有 (填标号)。a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)、铀氮化物的某两种晶胞如图所示:
①晶胞a中铀元素的化合价为 , 与U距离相等且最近的U有个。
②已知晶胞b的密度为dg/cm3 , U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加德罗常数的值,则该晶胞的空间利用率为(列出计算式)。
23. 实验室加热液体时,常加入沸石、其主要成分为 , 根据其组成元素完成下列填空:(1)、指出元素在周期表中的位置。(2)、沸石中的元素可形成多种化合物;元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是(填化学式),化合物乙中存在的化学键类型为。(3)、O元素和其同周期相邻的两种元素分别形成的简单氢化物中最稳定的是(填化学式)。(4)、已知硅酸(H2SiO3)为白色胶状沉淀。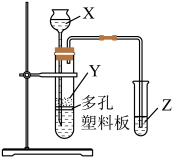
实验室中现有药品:①稀盐酸、②稀硫酸、③NaHCO3固体、④CaCO3固体、⑤Na2SiO3溶液,请选择合适药品利用上述装置设计实验验证C、Si的非金属性的变化规律;装置X、Y、Z处所盛装或放置的药品分别为、、(填序号)。但有同学认为该实验所得现象无法充分证明C、Si的非金属性强弱,如何改进?。
(5)、Uue是暂时未合成的化学元素,与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中A=、Z=。24. 短周期中的A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质在不同条件下反应生成一种淡黄色的固体E或白色固体F;D元素的单质为黄绿色气体。(1)、元素D的原子结构示意图为;它在周期表中的位置是周期族。(2)、D元素的最高价氧化物对应的水化物与C的最高价氧化物对应水化物在水溶液中反应的离子方程式为。(3)、F属于(离子、共价)化合物,F的电子式表示为。(4)、在E与水的反应中,反应物的总能量生成物的总能量(填“高于”、“低于”、“等于”),生成的化合物中的化学键含有(填“离子键”、“极性键”、“非极性键”),该反应的化学方程式为。(5)、写出AB2分子的结构式 , AB2与C的最高价氧化物对应水化物以物质的量之比按1︰1在溶液中进行反应的离子方程式为。25. 根据所学物质结构与性质的知识回答下列问题。(1)、超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是 , 该超分子中存在的化学键类型有(填选项字母)。
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是(填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有。
(2)、氟及其化合物用途非常广泛。①聚四氟乙烯是一种准晶体,可通过方法区分晶体、准晶体和非晶体。
②AsF3、IF、OF2 , BeF2中价层电子对数不同于其它微粒的是(填化学式,下同),其立体构型为。
③室温氟穿梭电池的电解质为氟氢离子液体,含HF、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式。
④基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为kJ·mol-1;F-F键的键能为kJ·mol-1。