高考二轮复习知识点:化学键3
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
 A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O2. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物3. 下列含有共价键的盐是( )A、CaCl2 B、H2SO4 C、Ba(OH)2 D、Na2CO34. 硝酸盐污染已成为一个日益严重的环境问题,甲酸()在纳米级磁性(钯)表面分解为活性和 , 再经下列历程实现的催化还原,进而减少污染。已知、表示中二价铁和三价铁。下列说法错误的是( )
A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O2. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物3. 下列含有共价键的盐是( )A、CaCl2 B、H2SO4 C、Ba(OH)2 D、Na2CO34. 硝酸盐污染已成为一个日益严重的环境问题,甲酸()在纳米级磁性(钯)表面分解为活性和 , 再经下列历程实现的催化还原,进而减少污染。已知、表示中二价铁和三价铁。下列说法错误的是( ) A、生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 B、分解时,只有极性共价键发生了断裂 C、在整个历程中,可完全还原 D、反应历程中生成的可调节体系 , 有增强氧化性的作用5. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
A、生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 B、分解时,只有极性共价键发生了断裂 C、在整个历程中,可完全还原 D、反应历程中生成的可调节体系 , 有增强氧化性的作用5. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下: 下列说法错误的是( )A、使用催化剂不能降低水煤气变换反应的 B、过程Ⅰ、过程Ⅱ均为吸热过程 C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个 在反应过程中并未都参与了反应6. 分属周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( )
下列说法错误的是( )A、使用催化剂不能降低水煤气变换反应的 B、过程Ⅰ、过程Ⅱ均为吸热过程 C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个 在反应过程中并未都参与了反应6. 分属周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( ) A、X、Z可形成具有强氧化性的高效消毒剂 B、X、Y、Z的原子半径从大到小为: Y > Z >X C、由Z和W形成的化合物中可以存在共价键 D、Y的最高价氧化物对应的水化物中,除了氢原子外所有原子满足8电子稳定结构7. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图(Y和Y之间重复单元的W、X未全部标出)。W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是( )
A、X、Z可形成具有强氧化性的高效消毒剂 B、X、Y、Z的原子半径从大到小为: Y > Z >X C、由Z和W形成的化合物中可以存在共价键 D、Y的最高价氧化物对应的水化物中,除了氢原子外所有原子满足8电子稳定结构7. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图(Y和Y之间重复单元的W、X未全部标出)。W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是( ) A、简单气态氢化物的热稳定性:X>Y B、第一电离能:I1(X)>I1(Y)>I1(Z) C、该化合物中W、X、Y都满足8电子稳定结构 D、W、Y、Z三种元素组成的化合物中含有离子键和共价键8. 某有机物可催化多氟芳烃的取代反应,机理图所示。下列说法正确的是( )
A、简单气态氢化物的热稳定性:X>Y B、第一电离能:I1(X)>I1(Y)>I1(Z) C、该化合物中W、X、Y都满足8电子稳定结构 D、W、Y、Z三种元素组成的化合物中含有离子键和共价键8. 某有机物可催化多氟芳烃的取代反应,机理图所示。下列说法正确的是( ) A、图中1、3、6是催化剂 B、过程中①原子利用率为100% C、过程②中有非极性键与极性健的断裂与形成 D、4为CH3COCH2NH2时,7是
A、图中1、3、6是催化剂 B、过程中①原子利用率为100% C、过程②中有非极性键与极性健的断裂与形成 D、4为CH3COCH2NH2时,7是 9. CrOx催化丙烷脱氢的反应路径如图所示,图中括号内的数值表示相对能量、箭头上的数值表示能垒,单位为eV。下列相关说法错误的是( )
9. CrOx催化丙烷脱氢的反应路径如图所示,图中括号内的数值表示相对能量、箭头上的数值表示能垒,单位为eV。下列相关说法错误的是( ) A、催化剂活化丙烷分子中甲基上的C-H键 B、“M2→M3”过程仅形成极性共价键 C、该催化循环中Cr的成键数目发生变化 D、该催化循环中丙烷上氢原子转移是决速步10. 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( )
A、催化剂活化丙烷分子中甲基上的C-H键 B、“M2→M3”过程仅形成极性共价键 C、该催化循环中Cr的成键数目发生变化 D、该催化循环中丙烷上氢原子转移是决速步10. 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( ) A、CH3SH为共价化合物 B、该过程中断裂了O—H键、S—H键和C—S键 C、该催化剂可降低该反应的活化能 D、该过程的总反应为H2S+CH3OH CH3SH+H2O11. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( )
A、CH3SH为共价化合物 B、该过程中断裂了O—H键、S—H键和C—S键 C、该催化剂可降低该反应的活化能 D、该过程的总反应为H2S+CH3OH CH3SH+H2O11. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( ) A、甲硫醇的沸点比甲醇低 B、该催化剂可有效提高反应物的平衡转化率 C、反应过程中涉及极性键的断裂和生成 D、该反应的化学方程式为12. 下列只含离子键的盐是( )A、 B、 C、KClO D、13. 下列氧化物中既含离子键又含共价键的是( )A、MgO B、 C、 D、14. 下列属于含有离子键的氧化物是( )A、 B、 C、 D、15. X、Y、Z、W为原子序数依次增大的短周期主族元素;Z的原子序数为X的2倍;X、Y、Z形成化合物Y2Z2X3 , 它与稀硫酸反应为Y2Z2X3+H2SO4=Y2SO4+ZX2↑+Z↓+H2O。下列叙述正确的是( )A、X、Y、Z的简单离子半径:Z>Y>X B、X、Y的氢化物沸点:Y>X C、Z、W氧化物的水化物酸性:W>Z D、Y2Z2X3为只含离子键的化合物16. MDI广泛应用于聚氨酯弹性体,其结构简式如图,其中W、X、Y、Z原子序数依次增大,且均小于10。
A、甲硫醇的沸点比甲醇低 B、该催化剂可有效提高反应物的平衡转化率 C、反应过程中涉及极性键的断裂和生成 D、该反应的化学方程式为12. 下列只含离子键的盐是( )A、 B、 C、KClO D、13. 下列氧化物中既含离子键又含共价键的是( )A、MgO B、 C、 D、14. 下列属于含有离子键的氧化物是( )A、 B、 C、 D、15. X、Y、Z、W为原子序数依次增大的短周期主族元素;Z的原子序数为X的2倍;X、Y、Z形成化合物Y2Z2X3 , 它与稀硫酸反应为Y2Z2X3+H2SO4=Y2SO4+ZX2↑+Z↓+H2O。下列叙述正确的是( )A、X、Y、Z的简单离子半径:Z>Y>X B、X、Y的氢化物沸点:Y>X C、Z、W氧化物的水化物酸性:W>Z D、Y2Z2X3为只含离子键的化合物16. MDI广泛应用于聚氨酯弹性体,其结构简式如图,其中W、X、Y、Z原子序数依次增大,且均小于10。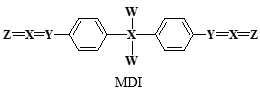
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、元素非金属性:X>Y>Z B、W、X、Z形成的化合物一定是二元弱酸 C、W与X、Y、Z均可形成至少2种10电子微粒 D、1molMDI中所含X—W键为2NA17. 短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物结构如图所示。在元素周期表中元素W是原子半径最小的元素,Z原子的最外层电子数是周期数的3倍,且W与X、Y、Z均可形成电子数相等的分子。下列说法正确的是( ) A、简单气态氢化物稳定性:Z<X B、由W、Y、Z三种元素组成的化合物均是共价化合物 C、YF3分子中的原子均是稳定的8电子结构 D、X元素的最高价氧化物对应的水化物为强酸
A、简单气态氢化物稳定性:Z<X B、由W、Y、Z三种元素组成的化合物均是共价化合物 C、YF3分子中的原子均是稳定的8电子结构 D、X元素的最高价氧化物对应的水化物为强酸二、多选题
-
18. 短周期主族元素 、 、 、 的原子序数依次增大, 离子与 分子均含有14个电子;习惯上把电解饱和 水溶液的工业生产称为氯碱工业。下列判断正确的是( )A、原子半径: B、最高价氧化物对应的水化物的酸性: C、化合物 的水溶液呈中性 D、 分子中既有 键又有 键19. 下列有关化学用语表示正确的是( )A、稀有气体不含任何化学键 B、固态氯化铝中含有离子键 C、NaCl 的形成过程可表示为: Na·+


 D、H2O2的电子式:
D、H2O2的电子式: 20. 下列关于配合物的说法正确的是( )A、基态原子核外电子的空间运动状态有17种 B、中含有离子键、共价健和配位键 C、该配合物中提供空轨道形成配位键 D、1该配合物和足量溶液反应,能产生3沉淀21. 三氯生,学名“二氯苯氧氯酚”,是一种高效广谱抗菌剂,可以有效防止新冠肺炎病毒的扩散和感染,对人体毒性很小,在洗手液成分中很常见,其结构简式如图。以下说法错误的是( )
20. 下列关于配合物的说法正确的是( )A、基态原子核外电子的空间运动状态有17种 B、中含有离子键、共价健和配位键 C、该配合物中提供空轨道形成配位键 D、1该配合物和足量溶液反应,能产生3沉淀21. 三氯生,学名“二氯苯氧氯酚”,是一种高效广谱抗菌剂,可以有效防止新冠肺炎病毒的扩散和感染,对人体毒性很小,在洗手液成分中很常见,其结构简式如图。以下说法错误的是( ) A、该有机物的分子式为C12H6Cl3O2 B、碳原子的杂化方式为sp2杂化 C、分子中所有原子可能共平面 D、1 mol该物质中含有25 mol σ键和6 mol π键22. BF3与一定量的水形成 ,一定条件下 可发生如图转化,下列说法中正确的是( )
A、该有机物的分子式为C12H6Cl3O2 B、碳原子的杂化方式为sp2杂化 C、分子中所有原子可能共平面 D、1 mol该物质中含有25 mol σ键和6 mol π键22. BF3与一定量的水形成 ,一定条件下 可发生如图转化,下列说法中正确的是( ) A、 熔化后得到的物质属于离子晶体 B、 分子之间存在着配位键和氢键 C、H3O+中氧原子为sp3杂化 D、BF3是仅含极性共价键的非极性分子23. 下列各组物质,晶体类型相同且熔化时破坏化学键类型相同的是( )A、NaOH、NaCl B、I2、Br2 C、NH4Cl、KCl D、CO2、SiO224. 下列关于化学键的叙述正确的是( )A、全部由非金属元素组成的化合物中可含离子键 B、H2O中所有原子都满足八电子稳定状态 C、两种元素构成的化合物可以含有非极性共价键 D、CH4中所有的电子都参与形成共价键
A、 熔化后得到的物质属于离子晶体 B、 分子之间存在着配位键和氢键 C、H3O+中氧原子为sp3杂化 D、BF3是仅含极性共价键的非极性分子23. 下列各组物质,晶体类型相同且熔化时破坏化学键类型相同的是( )A、NaOH、NaCl B、I2、Br2 C、NH4Cl、KCl D、CO2、SiO224. 下列关于化学键的叙述正确的是( )A、全部由非金属元素组成的化合物中可含离子键 B、H2O中所有原子都满足八电子稳定状态 C、两种元素构成的化合物可以含有非极性共价键 D、CH4中所有的电子都参与形成共价键三、非选择题
-
25. 自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:(1)、2016年 确认了四种新元素,其中一种为 ,中文名为“镁”。元素 可由反应端
 得到。该元素的质子数为 , 与 互为 (2)、 位于元素周期表中第 族,同族元素N的一种氢化物为 ,写出该化合物分子的电子式.该分子内存在的共价键类型有.(3)、该族中的另一元素P能显现多种化合价,其中 价氧化物的分子式为 价简单含氧酸的分子式为
得到。该元素的质子数为 , 与 互为 (2)、 位于元素周期表中第 族,同族元素N的一种氢化物为 ,写出该化合物分子的电子式.该分子内存在的共价键类型有.(3)、该族中的另一元素P能显现多种化合价,其中 价氧化物的分子式为 价简单含氧酸的分子式为
26. 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:(1)、基态原子最高能层的电子排布式为。(2)、稀溶液中存在。已知d轨道也可以参与杂化,则中的杂化方式为____(填选项字母)。A、 B、 C、 D、(3)、与形成长链结构的阴离子如图所示,该阴离子中键与键数目之比为。 (4)、铜能与拟卤素反应。拟卤素对应的酸有两种,理论上异硫氰酸的沸点高于硫氰酸 , 其原因为;写出一种与互为等电子体的分子式。(5)、可形成 , 其中代表。
(4)、铜能与拟卤素反应。拟卤素对应的酸有两种,理论上异硫氰酸的沸点高于硫氰酸 , 其原因为;写出一种与互为等电子体的分子式。(5)、可形成 , 其中代表。①该化合物分子中,模型为四面体或正四面体的非金属原子共有个。
②的电负性由大到小的顺序为。
(6)、一种由组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
①的配位数为;晶体中原子填充在、围成的四面体空隙中,则四面体空隙的占有率为。
②若晶胞底边的边长均为 , 高为 , 阿伏加德罗常数的值为 , 设晶体的最简式的式量为 , 则该晶体的密度为(列出计算式)。
27. La2CuO4在传感器、汽车尾气催化净化、氮氧化物催化消除、中温固体氧化物燃料电池等领域具有良好的应用前景,回答下列问题:(1)、基态Cu原子的核外电子排布式为。(2)、缩二脲[HN(CONH2)2]是一种有机化合物,分子中氮、碳的杂化类型分别是、。1 mol缩二脲中含有σ键的数目为 , 缩二脲能与Cu2+形成稳定离子,其原因是。(3)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系La2CuO4的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
分数坐标
原子
x
y
z
W
0
0
0
X
0
0
Y
①B原子代表 , C原子代表 , 与A原子距离最近的氧原子个数为。
②Z用分数坐标表示为。
③设阿伏加德罗常数的值为NA , 则La2CuO4的密度是g·cm-3(列出计算表达式)。
28. 第四周期过渡元素铁、锰在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:(1)、在现代化学中,常利用上的特征谱线来鉴定元素,称为光谱分析。(2)、写出Mn的外围电子排布式;比较铁与锰的第三电离能(I3):铁锰(填“>”“=”或“<”),原因是。(3)、乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。此物质中碳原子的杂化方式是。 (4)、配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的分子式为;已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为。(5)、如图是晶体Fe3O2的晶胞,该晶体是一种磁性材料,能导电。
(4)、配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的分子式为;已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为。(5)、如图是晶体Fe3O2的晶胞,该晶体是一种磁性材料,能导电。
①晶胞中三价铁离子处于氧离子围成的(填空间结构)空隙。
②解释Fe3O4晶体能导电的原因。
③若晶胞的体对角线长为anm,则Fe3O4晶体的密度为g·cm-3(阿伏加德罗常数用NA表示)。
29. 乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰: 4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。(1)、Mn3+基态价层电子排布图为。(2)、Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序。从电子云重叠的方式看N中存在的化学键类型有。(3)、与NO2-互为等电子体的一种分子的化学式为。(4)、1molCH3COOH中含有的σ键数目为。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式。(5)、镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为。镁铝合金密度为ρg/cm3 , 则该晶胞的边长为nm(阿伏加德罗常数的值为N)。 30. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:(1)、 的价电子排布图为:;基态磷原子有种空间运动状态不同的电子。(2)、Li、O、P三种元素的电负性由大到小的顺序是:。(3)、写出一种与 互为等电子体的分子的化学式: , 该分子的中心原子的价层电子对数等于。(4)、已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:。
30. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:(1)、 的价电子排布图为:;基态磷原子有种空间运动状态不同的电子。(2)、Li、O、P三种元素的电负性由大到小的顺序是:。(3)、写出一种与 互为等电子体的分子的化学式: , 该分子的中心原子的价层电子对数等于。(4)、已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:。A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)、N和P是同主族元素,但是 分子中的键角大于 分子中的键角,原因是:。(6)、 为离子晶体,具有反萤石结构,晶胞如下图所示。则 配位数为: , 若晶胞参数为bnm,阿伏加德罗常数的值为 ,则 的密度为 (列出计算式即可)。 31. 贵金属磷化物通常指贵金属 Ag、Rh、Ir 等元素与磷形成的二元化合物。(1)、第六周期元素 Ir 与钴元素同一列,其价电子排布式为。(2)、固态五氯化磷由[PCl4]+和[PCl6]-构成,晶体结构类似 CsCl,易升华得到PCl5 (g)。PCl5 (g)分子的空间结构如图所示。
31. 贵金属磷化物通常指贵金属 Ag、Rh、Ir 等元素与磷形成的二元化合物。(1)、第六周期元素 Ir 与钴元素同一列,其价电子排布式为。(2)、固态五氯化磷由[PCl4]+和[PCl6]-构成,晶体结构类似 CsCl,易升华得到PCl5 (g)。PCl5 (g)分子的空间结构如图所示。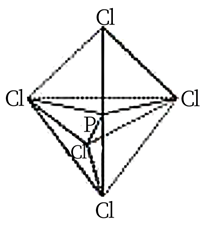
①[PCl4]+的空间构型为;
②五氯化磷既可溶于非极性溶剂CCl4 , 又可溶于极性溶剂硝基苯的原因是。
(3)、Cu 与 Ag 属于同族,一水合醋酸铜(Ⅱ)是二聚体,结构如图(a),该粒子中存在的作用力有_______(填标号)。 A、 键 B、离子键 C、配位键 D、范德华力(4)、元素铑(Rh)与 P 可形成多种磷化物,其中一种晶体结构如图(b)。晶体中 P 原子的配位数为 , 该晶体的化学式为。
A、 键 B、离子键 C、配位键 D、范德华力(4)、元素铑(Rh)与 P 可形成多种磷化物,其中一种晶体结构如图(b)。晶体中 P 原子的配位数为 , 该晶体的化学式为。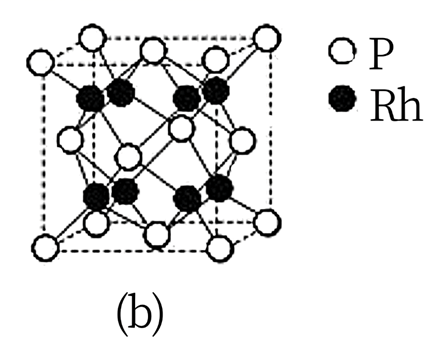 32. 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:(1)、基态S原子的价电子排布图为。(2)、硫氰酸根离子(SCN-)的结构式为。(3)、甲脒(FA)的结构简式为
32. 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:(1)、基态S原子的价电子排布图为。(2)、硫氰酸根离子(SCN-)的结构式为。(3)、甲脒(FA)的结构简式为
①其组成元素的电负性由小到大的排序为 , 其中碳原子的杂化方式为。
②甲脒比丙烷的熔点更高的原因是。
(4)、水中铅测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(图1)
①该络合物可溶于四氯化碳,其晶体类型为。
②该络合物分子内不存在的微粒间作用力有。(选填序号)
a.σ键 b.π键 c.非极性键 d.配位健 e.离子键
(5)、FAPbI3的晶体结构单元如图2所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为。33. “中国紫”一硅酸铜钡(BaCuSi2O6),其合成原料为BaCO3、孔雀石[Cu2 (OH)2CO3]和砂子(SiO2)。回答下列问题:(1)、基态Ba原子的价电子排布式为。(2)、SiO2常用作光导纤维,在生产和生活中有广泛的用途。在SiO2晶体中,硅原子的杂化类型为。(3)、Cu2(OH)2CO3不溶于水,但可溶于浓氨水,反应的化学方程式为Cu2(OH)2CO3+8NH3·H2O=[Cu(NH3)4]CO3 +[Cu(NH3)4](OH)2 +8H2O①氨水中存在的化学键有 (填标号)。
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②[Cu(NH3)4]CO3中配体是 ,所含元素中电负性最小的非金属元素是(填元素符号)。
(4)、Cu2O的熔点比Cu2S的 (填“高”或“低”),原因是。(5)、Cu和Ba形成的某种合金的晶胞结构如图所示,该晶体中Cu与Ba的原子个数比为。 34. 氮、锂、锌等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。卟啉锌超分子结构如图所示。
34. 氮、锂、锌等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。卟啉锌超分子结构如图所示。 (1)、卟啉锌中H、C、O、N四种元素中,第一电离能最大的是(填元素符号)。(2)、卟啉锌超分子中的碳原子采取的杂化方式为 , 图中①②③④处的化学键属于配位键的是(填序号)。(3)、已知离子核外没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子无颜色的是(填离子符号)。(4)、 的键角小于 ,原因是。(5)、氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为;设氮化锂晶体中,同层N-N间距为a pm,层与层间距为b pm,该物质的密度为g/cm3.(用含a、b的式子表示)
(1)、卟啉锌中H、C、O、N四种元素中,第一电离能最大的是(填元素符号)。(2)、卟啉锌超分子中的碳原子采取的杂化方式为 , 图中①②③④处的化学键属于配位键的是(填序号)。(3)、已知离子核外没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子无颜色的是(填离子符号)。(4)、 的键角小于 ,原因是。(5)、氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为;设氮化锂晶体中,同层N-N间距为a pm,层与层间距为b pm,该物质的密度为g/cm3.(用含a、b的式子表示)
 35. 盐酸阿比朵尔(Arbidl Hydmchloride)是广谱抗病毒药。李兰娟院士团队发现它能有效抑制新型冠状病毒(COVID-19),其合成路线如下:
35. 盐酸阿比朵尔(Arbidl Hydmchloride)是广谱抗病毒药。李兰娟院士团队发现它能有效抑制新型冠状病毒(COVID-19),其合成路线如下: 回答下列问题:(1)、A中含氧官能团的名称是(2)、反应①分为两步进行,完成反应ii
回答下列问题:(1)、A中含氧官能团的名称是(2)、反应①分为两步进行,完成反应ii反应i.
 +NH3
+NH3 
反应ii , 其反应类型是。
(3)、反应②生成1mol的D消耗mol Br2;反应③加入KHCO3的作用是。(填序号)。(4)、G为盐酸盐,其中H+与-N(CH3)2间形成的作用力是___________。A、共价键 B、离子键 C、范德华力 D、氢键(5)、H是A的同分异构体,核磁共振氢谱显示有2种峰,且峰值面积是2:3,写出H的一种可能的结构简式。(6)、根据相关信息并结合已有知识,写出以 、
、  制备扑炎痛
制备扑炎痛  的合成路线(其它试剂任选)。。
的合成路线(其它试剂任选)。。
已知: +
+ 
 +NaCl
+NaCl