高考二轮复习知识点:化学键1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
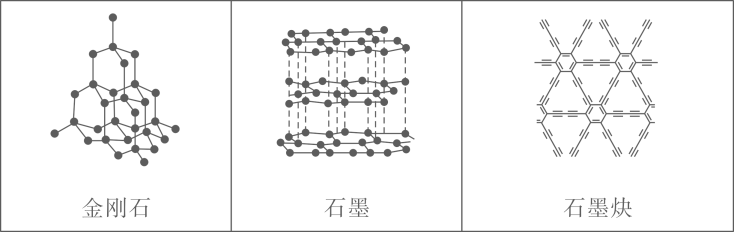
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A、三种物质中均有碳碳原子间的键 B、三种物质中的碳原子都是杂化 C、三种物质的晶体类型相同 D、三种物质均能导电2. 蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是( )
A、过程白色固体变黑,主要体现了浓硫酸的脱水性 B、过程固体体积膨胀,与产生的大量气体有关 C、过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性 D、过程中蔗糖分子发生了化学键的断裂3. 少量与反应生成和。下列说法正确的是( )A、的电子式为 B、的空间构型为直线形
C、中O元素的化合价为-1
D、仅含离子键
4. 利用反应可制备N2H4。下列叙述正确的是( )A、NH3分子有孤电子对,可做配体 B、NaCl晶体可以导电 C、一个N2H4分子中有4个σ键 D、NaClO和NaCl均为离子化合物,他们所含的化学键类型相同5. 照相底片定影并回收定影液硫代硫酸钠和银,经历如下过程,下列说法不正确的是:A、晶体中所含的作用力只有离子键、配位键 B、与是等电子体,结构相似,相当于中O被一个S原子替换 C、该过程中与结合能力:- D、副产物的键角小于的原因:分子中S的孤电子对对成键电子对的排斥作用使键角变小6. NH3分子和CO2分子比较,相同的是A、键角 B、空间构型 C、分子的极性 D、化学键的类型7. 苯与Br2的催化反应历程如图所示。下列说法正确的是
B、的空间构型为直线形
C、中O元素的化合价为-1
D、仅含离子键
4. 利用反应可制备N2H4。下列叙述正确的是( )A、NH3分子有孤电子对,可做配体 B、NaCl晶体可以导电 C、一个N2H4分子中有4个σ键 D、NaClO和NaCl均为离子化合物,他们所含的化学键类型相同5. 照相底片定影并回收定影液硫代硫酸钠和银,经历如下过程,下列说法不正确的是:A、晶体中所含的作用力只有离子键、配位键 B、与是等电子体,结构相似,相当于中O被一个S原子替换 C、该过程中与结合能力:- D、副产物的键角小于的原因:分子中S的孤电子对对成键电子对的排斥作用使键角变小6. NH3分子和CO2分子比较,相同的是A、键角 B、空间构型 C、分子的极性 D、化学键的类型7. 苯与Br2的催化反应历程如图所示。下列说法正确的是 A、苯与Br2生成
A、苯与Br2生成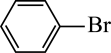 的反应为吸热反应
B、图中,苯与Br2的催化反应生成了溴苯、邻二溴苯
C、从图中所给信息看,生成
的反应为吸热反应
B、图中,苯与Br2的催化反应生成了溴苯、邻二溴苯
C、从图中所给信息看,生成 比
比 更稳定
D、由
更稳定
D、由 转化为
转化为 的过程中有极性键的断裂与形成
8. 含有非极性键的共价化合物是A、 B、 C、 D、9. 以下过程与化学键断裂无关的是A、氯化钠熔化 B、碘升华 C、金刚石熔化 D、钠熔化10. 硼氢化钠()被称为“万能还原剂”,能与水反应产生 , 在催化剂钉()表面与水反应的历程如图所示:
的过程中有极性键的断裂与形成
8. 含有非极性键的共价化合物是A、 B、 C、 D、9. 以下过程与化学键断裂无关的是A、氯化钠熔化 B、碘升华 C、金刚石熔化 D、钠熔化10. 硼氢化钠()被称为“万能还原剂”,能与水反应产生 , 在催化剂钉()表面与水反应的历程如图所示:
下列说法错误的是
A、元素钉位于第五周期Ⅷ族 B、中含有离子键、共价键、配位键 C、中B的杂化方式为 D、过程④中产生1 mol , 转移电子的物质的量为2 mol11. 维生素C的结构简式如图所示。下列说法错误的是( ) A、维生素C分子中含有键和键 B、维生素C可保存在强碱性环境中 C、维生素C能使溴水、酸性溶液褪色 D、维生素C中所含的官能团是羟基、酯基和碳碳双键12. 乙炔水化法、乙烯氧化法是工业上制备乙醛的两个重要方法,反应原理分别为:
A、维生素C分子中含有键和键 B、维生素C可保存在强碱性环境中 C、维生素C能使溴水、酸性溶液褪色 D、维生素C中所含的官能团是羟基、酯基和碳碳双键12. 乙炔水化法、乙烯氧化法是工业上制备乙醛的两个重要方法,反应原理分别为:以下叙述错误的是
A、乙烯氧化法中,生成乙醛时,转移的电子数约为 B、的电子式为 C、根据价层电子互斥模型,水的中心原子含有孤电子对 D、标准状况下,中含有键的数目约为13. 黑火药是中国古代四大发明之一。爆炸反应为。下列说法错误的是A、含离子键和共价键 B、与具有相同的电子层结构 C、的结构式为 D、干冰的晶体类型为共价晶体14. 用NaCN溶液浸取矿粉中金的反应为4Au+2H2O+8NaCN+O2=4Na[Au(CN)2]+4NaOH。下列说法正确的是A、H2O的空间结构为直线形 B、NaCN中含有离子键和共价键 C、1mol[Au(CN)2]-中含有2molσ键 D、NaOH的电子式为 15. 人们在金星大气中探测到PH3 , 据此推断金星大气层或存在生命。反应可制备PH3。下列说法正确的是A、P4为极性分子 B、K+的结构示意图为
15. 人们在金星大气中探测到PH3 , 据此推断金星大气层或存在生命。反应可制备PH3。下列说法正确的是A、P4为极性分子 B、K+的结构示意图为 C、PH3的电子式为
C、PH3的电子式为 D、中含有离子键和共价键
16. 下列各组物质中,化学键类型和晶体类型都相同的是( )A、Ar和K B、NaCl和NaOH C、和 D、和17. 下列说法错误的是( )A、氢氟酸可用于刻蚀石英制作艺术品 B、利用浓的高沸点与NaI反应制备HI C、同位素可应用于药物作用机理研究和生物医学研究等 D、与淀粉通过共价键作用生成蓝色的淀粉碘包合物18. 对NaOH晶体叙述错误的是A、存在两种化学键 B、含共价键的离子化合物 C、存在两种离子 D、含共价键的共价化合物19. 我国科学家利用Co的化合物在Fe(OH)2氧化过程中的催化作用,促进了电催化过程中流失的Fe催化活性中心的原位自修复(Fe再沉积的主要反应过程) ,反应机理如图所示。下列说法错误的是( )
D、中含有离子键和共价键
16. 下列各组物质中,化学键类型和晶体类型都相同的是( )A、Ar和K B、NaCl和NaOH C、和 D、和17. 下列说法错误的是( )A、氢氟酸可用于刻蚀石英制作艺术品 B、利用浓的高沸点与NaI反应制备HI C、同位素可应用于药物作用机理研究和生物医学研究等 D、与淀粉通过共价键作用生成蓝色的淀粉碘包合物18. 对NaOH晶体叙述错误的是A、存在两种化学键 B、含共价键的离子化合物 C、存在两种离子 D、含共价键的共价化合物19. 我国科学家利用Co的化合物在Fe(OH)2氧化过程中的催化作用,促进了电催化过程中流失的Fe催化活性中心的原位自修复(Fe再沉积的主要反应过程) ,反应机理如图所示。下列说法错误的是( ) A、反应过程中CoOOH为催化剂 B、图中各反应不能在酸性条件下进行 C、存在反应Co(OH)2+OH- -e- =CoOOH+H2O D、图中所示物质之间的转化有非极性键的形成和断裂20. 氮化硼(BN)晶体存在如图所示的两种结构。六方氮化硼的结构与石墨类似;立方氮化硼的结构与金刚石类似,可作研磨剂。
A、反应过程中CoOOH为催化剂 B、图中各反应不能在酸性条件下进行 C、存在反应Co(OH)2+OH- -e- =CoOOH+H2O D、图中所示物质之间的转化有非极性键的形成和断裂20. 氮化硼(BN)晶体存在如图所示的两种结构。六方氮化硼的结构与石墨类似;立方氮化硼的结构与金刚石类似,可作研磨剂。
下列说法错误的是( )
A、六方氮化硼层间的相互作用不属于化学键 B、六方氮化硼可做润滑剂 C、立方氮化硼晶胞中含有4个氮原子和4个硼原子 D、立方氮化硼晶胞中,N和B之间不存在配位键21. 可作为下列有机合成反应的催化剂。下列说法正确的是 ( ) A、中σ键与π键的个数相等 B、甲分子中采取杂化的碳原子有6个 C、有机物乙的沸点低于对羟基苯甲醛(
A、中σ键与π键的个数相等 B、甲分子中采取杂化的碳原子有6个 C、有机物乙的沸点低于对羟基苯甲醛(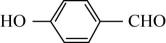 )的沸点
D、常温下,中键比中键易断裂
22. 下列物质中含有共价键的化合物的是( )A、CaO B、NaCl C、H2 D、HCl23. 氮氧化物(NOx)是一类特殊的污染物,它本身会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图所示。下列叙述错误的是( )
)的沸点
D、常温下,中键比中键易断裂
22. 下列物质中含有共价键的化合物的是( )A、CaO B、NaCl C、H2 D、HCl23. 氮氧化物(NOx)是一类特殊的污染物,它本身会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图所示。下列叙述错误的是( )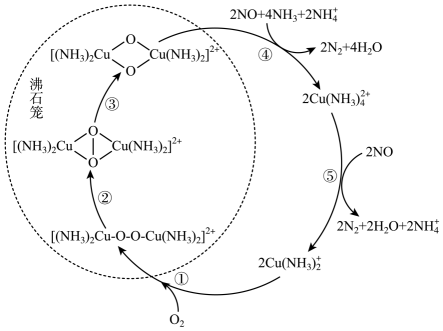 A、反应①变化过程可表示为2Cu(NH3)+O2=[(NH3)2Cu-O-O-Cu(NH3)2]2+ B、反应③属于非氧化还原反应 C、反应④涉及极性共价键的断裂与生成 D、图中总过程中每吸收1molNO需要标准状态下的NH344.8L
A、反应①变化过程可表示为2Cu(NH3)+O2=[(NH3)2Cu-O-O-Cu(NH3)2]2+ B、反应③属于非氧化还原反应 C、反应④涉及极性共价键的断裂与生成 D、图中总过程中每吸收1molNO需要标准状态下的NH344.8L二、多选题
-
24. 下列说法中正确的是( )A、丙烯分子中有8个σ键,1个π键 B、60g的SiO2晶体中,含有4mol共价键 C、NCl3和BCl3分子,都是三角锥形 D、SiH4的沸点高于CH4 , 可推测PH3的沸点高于NH3
三、非选择题
-
25. 1962年首个稀有气体化合物问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪 (36Kr)次之,氩(18Ar)化合物极少。是与分子形成的加合物,其晶胞如下图所示。

回答下列问题:
(1)、基态原子的价电子排布式为。(2)、原子的活泼性依序增强,原因是。(3)、晶体熔点:(填“>”“<”或“=”),判断依据是。(4)、的中心原子的杂化轨道类型为。(5)、加合物中 , 晶体中的微粒间作用力有(填标号)。a.氢键 b.离子键 c.极性共价键 d.非极性共价键
26. 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含NiFe2O4、NiO、 FeO、 Al2O3)中回收镍并转化为NiSO4的流程如图所示: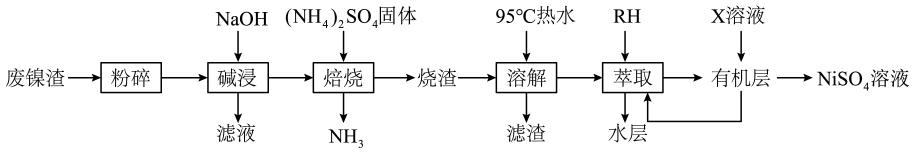
回答下列问题:
(1)、“碱浸”时发生反应的离子方程式为。(2)、“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式。(3)、使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是。(4)、①“萃取”时发生反应Mn+ + nRH MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与的关系如下表所示,当 =0.25时,水层中主要的阳离子为。萃取率/%
0.1
0.15
0.2
0.25
0.3
0.35
0.4
Ni2+
55%
68%
80%
99%
99.5%
99.8%
99.9%
Fe2+
2%
2%
4%
5%
8%
30%
58%
②物质X的化学式为。
(5)、镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=。 (6)、Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。
(6)、Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。
144.5g二丁二酮肟合镍分子内含有σ键mol,碳碳键是由轨道重叠形成的。
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p
27. 铁、镍、铜、钇(Y)在医药、催化及材料等领域中都有广泛的应用。回答下列问题:(1)、在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为(填轨道表示式)。(2)、硝普钠()可用于治疗急性心率衰竭。其中不存在的化学键有(填序号)。a.离子键 b.金属键 c.配位键 d.极性共价键
(3)、甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
①甘氨酸铜中铜原子的杂化类型为(填“”或“”)。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇()的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为。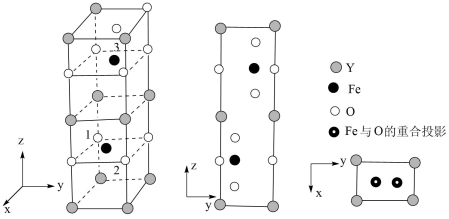
一个晶胞中有个O。已知1号O原子分数坐标为 , 2号O原子分数坐标为 , 则3号Fe原子的分数坐标为。
28. 铁、镍、铜、钇(Y)在医药、催化及材料等领域中都有广泛的应用。回答下列问题:(1)、在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为(填轨道表示式)。(2)、硝普钠(Na2[Fe( CN)5(NO) ·2H2O])可用于治疗急性心率衰竭。其中不存在的化学键有(填序号)。a.离子键
b.c金属键
c.配位键
d.极性共价键
(3)、甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
①甘氨酸铜中铜原子的杂化类型为(填“sp”或“dsp?” )。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇(YFeO3)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
一个晶胞中有个O。已知1号O原子分数坐标为(0, 0,),2号O原子分数坐标为( , -m,-n),则3号Fe原子的分数坐标为。
29. 金属镍作为重要的战略金属资源对国民经济和国防工业发挥着至关重要的作用。铜镍矿(主要成分为镍、镁、铜、铁、硅的氧化物)的湿式冶炼是获取镍的重要途径,其工艺流程如图所示: (1)、“氧压酸浸”滤液中含有、、、等离子,通入氧气时加压的目的是。(2)、萃取剂是由
(1)、“氧压酸浸”滤液中含有、、、等离子,通入氧气时加压的目的是。(2)、萃取剂是由 与
与 按一定比例调配而成的,其与形成的络合物含有的作用力有。
按一定比例调配而成的,其与形成的络合物含有的作用力有。a.离子键|b.极性共价键|c.非极性共价键 d.配位键
(3)、已知铁矾渣的成分是 , 在沉淀除铁过程中的作用是 , 其参与生成铁矾渣的离子反应方程式为。(4)、沉镍步骤所得滤液中的溶质主要是(填化学式)。(5)、沉镍过程中的加入量对镍沉淀的影响如图所示,当为8.5时,溶液中的浓度为(已知该温度下)结合图中信息回答,选择加入量为的理由是。 30. 碱土金属(IIA族)元素单质及其相关化合物的性质、合成一直以来是化学界研究的重点。回答下列问题:(1)、对于碱土金属元素Be、Mg、Ca、Sr、Ba,随着原子序数的增加,以下性质呈单调递减变化的是____。A、原子半径 B、单质的硬度 C、第一电离能(2)、(NH4)2BeF4是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为 , 阴离子中心原子杂化方式为。(3)、Sr是人体必需的微量元素,SrCO3是其重要的化合物之一。Sr2+的电子排布式为。判断SrCO3的热分解温度(填“大于”、“小于”)CaCO3的热分解温度,理由是。(4)、MgH2和金属Ni在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的储氢化合物,其立方晶胞结构如图所示:
30. 碱土金属(IIA族)元素单质及其相关化合物的性质、合成一直以来是化学界研究的重点。回答下列问题:(1)、对于碱土金属元素Be、Mg、Ca、Sr、Ba,随着原子序数的增加,以下性质呈单调递减变化的是____。A、原子半径 B、单质的硬度 C、第一电离能(2)、(NH4)2BeF4是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为 , 阴离子中心原子杂化方式为。(3)、Sr是人体必需的微量元素,SrCO3是其重要的化合物之一。Sr2+的电子排布式为。判断SrCO3的热分解温度(填“大于”、“小于”)CaCO3的热分解温度,理由是。(4)、MgH2和金属Ni在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的储氢化合物,其立方晶胞结构如图所示:
①Mg原子周围距离最近且相等的Ni原子有个,若晶胞边长为646pm,则Mg—Ni核间距为pm(结果保留小数点后两位,取1.73)。
②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为(列出计算式即可。假定该化合物中所有的H可以全部放出,液氢密度为dg•cm-3;设NA代表阿伏加德罗常数的值)。
31. 我国科学家开发了一种高电化学活性和水氧稳定的方酸锂可作为电池电解质的锂补偿剂和锂源。回答下列问题:(1)、方酸可用作合成有机光导体、液晶显示材料等的中间体,其结构如图所示。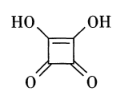
①1 mol方酸中含有的σ键数目为 , 其中 C的杂化轨道类型是。
②羧基中的羟基极性越大,越易电离出H+。三氟乙酸(CF3COOH)的酸性大于三氯乙酸(CCl3COOH),试从键的极性分析其原因可能是。
(2)、LiClO4 、LiBF4、LiPF4等离子液体也常作为锂离子电池的电解质。①LiClO4中阴离子的空间结构名称是。
②是一种配离子,请从配位键来解释其形成过程:。
③LiPF6在一定条件下可分解生成PF5比较PF5和PCl5的热分解温度高低,利用键参数说明理由:。
(3)、1975年,锂键首次被实验证实,即X…Li-Y(X代表NH3 , , H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是____(填字母)。 A、形成氢键(X-H…Y)三原子不一定在一条直线上。 B、氢键具有部分共价键的性质,锂键可能具有部分离子键的性质 C、电负性:Cl>Br;第一电离能:Cl>Br D、
, H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是____(填字母)。 A、形成氢键(X-H…Y)三原子不一定在一条直线上。 B、氢键具有部分共价键的性质,锂键可能具有部分离子键的性质 C、电负性:Cl>Br;第一电离能:Cl>Br D、 分子间能形成氢键, CH3OCH3分子间不能形成氢键
(4)、磷酸亚铁锂是一种锂离子电池的正极材料,其晶胞结构示意图如图(a)所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有个,电池充电时,LiFePO4脱出部分Li+ ,形成Li1-xFePO4 , 结构示意图如图(b)所示,则x=。
分子间能形成氢键, CH3OCH3分子间不能形成氢键
(4)、磷酸亚铁锂是一种锂离子电池的正极材料,其晶胞结构示意图如图(a)所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有个,电池充电时,LiFePO4脱出部分Li+ ,形成Li1-xFePO4 , 结构示意图如图(b)所示,则x=。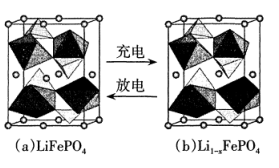 (5)、用于制造激光器的KH2PO4大晶体是由水溶液结晶出来的。分别用
(5)、用于制造激光器的KH2PO4大晶体是由水溶液结晶出来的。分别用 、●表示和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为(填字母)。
、●表示和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为(填字母)。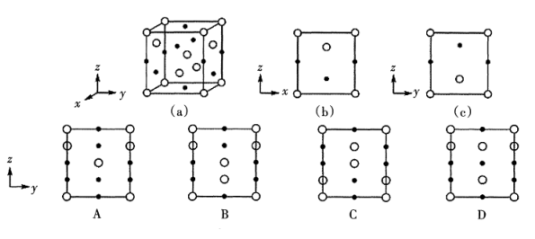 32. 许多元素及它们的化合物在科学研究和工业生产中具有多种用途。请回答下列有关问题:(1)、现代化学中,常利用上的特征谱线来鉴定元素。(2)、某同学画出的基态碳原子的核外电子排布图为
32. 许多元素及它们的化合物在科学研究和工业生产中具有多种用途。请回答下列有关问题:(1)、现代化学中,常利用上的特征谱线来鉴定元素。(2)、某同学画出的基态碳原子的核外电子排布图为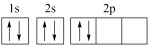 , 该电子排布图背了。CH、-CH3、CH都是重要的有机反应中间体。CH、CH的空间构型分别为、。 (3)、咪唑的结构为
, 该电子排布图背了。CH、-CH3、CH都是重要的有机反应中间体。CH、CH的空间构型分别为、。 (3)、咪唑的结构为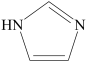 。分子中的大π键可用符号π表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π)。咪唑分子中的大π键可表示为 , 咪唑比环戊烯C5H8熔点高的主要原因是。 (4)、
。分子中的大π键可用符号π表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π)。咪唑分子中的大π键可表示为 , 咪唑比环戊烯C5H8熔点高的主要原因是。 (4)、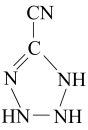 中孤电子对与π键比值为 , 碳原子的杂化方式为。 (5)、铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3 , 阿伏加德罗常数为NA。
中孤电子对与π键比值为 , 碳原子的杂化方式为。 (5)、铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3 , 阿伏加德罗常数为NA。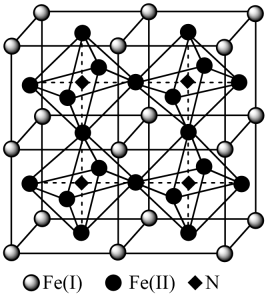
①写出氮化铁中铁的堆积方式为。
②该化合物的化学式为。
③计算出Fe(II)围成的八面体的体积为cm3。
33. 铀氮化合物是核燃料循环系统中的重要材料。已知。回答下列问题:
(1)、基态氮原子价电子轨道表示式为。(2)、反应中断裂的化学键有(填标号)。a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(3)、反应所得的气态产物中属于非极性分子的是(填化学式,下同);氢化物中更易与形成配离子的是 , 解释原因。(4)、基态U原子的外围电子排布式为 , 则处于下列状态的铀原子或离子失去一个电子所需能量最高的是____(填标号)。A、 B、 C、 D、(5)、的空间构型为 , 其结构中存在大π键,可表示为(用表示,m代表参与形成大键的原子数,n代表参与形成大键的电子数)。(6)、某种铀氮化物的晶胞如图。已知晶胞密度为 , U原子半径为 , N原子半径为 , 设为阿伏加德罗常数的值,则该晶胞的空间利用率为(用含d、、、的式子表示)。 34. 金属镍及其化合物在军工机械、生产生活中有着广泛的用途。(1)、与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验。
34. 金属镍及其化合物在军工机械、生产生活中有着广泛的用途。(1)、与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验。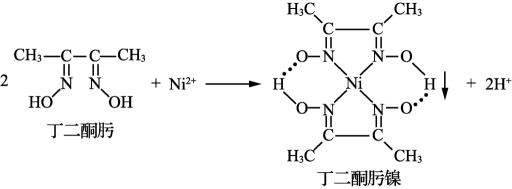
①基态核外电子排布式为。
②丁二酮肟镍分子中采取杂化,为平面正方形构型,则该分子中共面的原子最多为个。
③丁二酮肟镍分子内存在的化学键有(填标号)。
A.离子键 B.配位键 C.氢键 D.范德华力
(2)、镍能形成多种配合物,如、等。①晶体中含有的键与键数目之比为。
②中键角H-N-H比独立存在的分子中键角略大,其原因是。
(3)、苯与在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知键长为 , 键长为。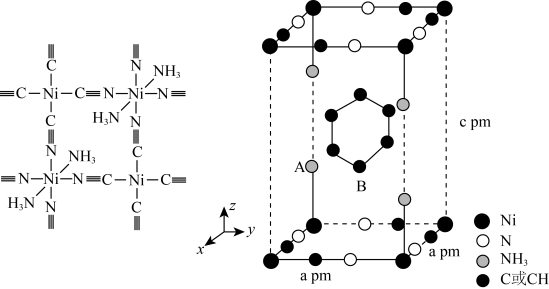
则该晶体的化学式为;A点的分数坐标为;晶胞中A、B间距离d=pm。
35. CIGS靶材是一种主要含铜、铟(In)、镓(Ga)、硒(Se)的合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域。回答下列问题:(1)、基态Ga的核外电子排布为[Ar]3d104s24p1 , 转化为下列激发态时所需能量最少的是____(填字母)。A、 B、
B、 C、
C、 D、
D、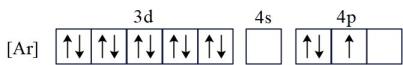 (2)、硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2CH2N(CH2COOH)2]可形成配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。
(2)、硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2CH2N(CH2COOH)2]可形成配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。①的空间构型为 ,EDTA中碳原子杂化方式为 。
②C、N、O、S四种元素中,第一电离能最大的是。
③在[Cu(NH3)4(H2O)₂]SO4化合物中,阳离子呈轴向狭长的八面体结构 (如图),该阳离子中存在的化学键类型 , 该化合物加热时首先失去的组分是。
 (3)、人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因。
(3)、人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因。有机物
甲醇
甲硫醇(CH3SH)
甲硒醇
沸点/℃
64.7
5.95
25.05
(4)、四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=m pm,c=2m pm,晶胞棱边夹角均为90°。设阿伏加德罗常数的值为NA , CuInSe2的相对质量为M,则该晶体密度ρ=g•cm-3 (用含有m、M和NA的代数式表示)。该晶胞中,原子坐标分别为2号Cu原子(0,0.5,0.25),3号In原子(0,0.5,0.75),4号Se原子(0.75,0.75,0.125)。则1号Se原子的坐标为 , 晶体中与单个In键合的Se有个。
-