高考二轮复习知识点:原子结构与元素的性质
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 2016年IUPAC命名117号元素为Ts(中文名“
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A、Ts是第七周期第ⅦA族元素 B、Ts的同位素原子具有相同的电子数 C、Ts在同族元素中非金属性最弱 D、中子数为176的TS核素符号是 Ts2. 用粒子轰击可得到一个中子和一种放射性核素 , 即。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是A、b=13 B、最高价含氧酸的酸性:X<Y C、XF3与YF3中X与Y的杂化方式相同 D、单质的沸点:X>Y3. W、X、Y、Z均为周期表中前两周期元素,其原子序数依次增大,X原子基态电子排布中无单电子。四种元素可以组成型离子化合物,阴阳离子皆由两种元素组成,且均为正四面体形。下列说法错误的是A、阴阳离子中都含有配位键 B、第一电离能:X<Y<Z C、Y与Z可形成三角锥形的分子 D、简单氢化物的还原性:Y<Z4. X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。X是宇宙中含量最高的元素,YX3分子呈三角锥形,Z的价电子排布式为nsnnpn+2 , 五种元素中M的电负性最小,N的最高价含氧酸酸性最强。下列说法正确的是A、的VSEPR模型为V形 B、由X、Y、Z三种元素组成的化合物的水溶液均显酸性 C、同周期中第一电离能大于Z的元素有3种 D、MN晶体中M离子的配位数为85. W、R、X、Y、Z为原子序数依次增大的短周期元素.、和三种微粒的空间构型相同,Y原子的电子层数等于最外层电子数。以下说法错误的是A、氢化物稳定性: B、最高价氧化物对应水化物酸性: C、电负性: D、原子晶体中Z的配位数为46. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是植物所需三大营养素之一,基态Y原子的电子总数是其最高能级电子数的2倍,Z与Y形成的物质可用作潜水艇的供氧剂,Y、W最外层电子数相同。下列说法错误的是A、简单氢化物形成的晶体中,一个分子周围紧邻的分子数: B、简单离子的半径: C、第一电离能: D、简单氢化物沸点:7. X、Y、Z、N是原子序数依次增大的4种短周期元素,其元素性质或原子结构如下表。下列说法正确的是元素
元素性质或原子结构
X
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素
Y
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能高于同周期相邻元素
Z
其价电子中,在不同形状的原子轨道中运动的电子数相等
N
只有一个不成对电子
A、原子半径: B、元素的电负性: C、元素的第一电离能: D、X的基态原子的电子轨道表示式: 8. 前四周期元素W、X、Y、Z的原子序数依次增大,且都不在同一周期。X的价电子排布式为nsxnpx+1 , Y的最高能级的单电子数是W的3倍,Z与W中的单电子数和最外层电子数均相同,但两者族序数不同。下列说法正确的是A、电负性比较:Y>X>Z B、Y元素的第一电离能高于其同周期相邻元素 C、Z元素在周期表中的位置可能为第四周期ⅥB族 D、X的简单氢化物比Y的简单氢化物键角小9. X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是A、Z、Y的氢化物稳定性:Z<Y B、Q与Y原子形成的分子空间结构为四面体型 C、Q单质可从Z的简单气态氢化物中置换出Z D、[W(ZX3)4]2+中σ键数为1210. 四种短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是元素周期表中原子半径最小的元素;Y元素基态原子的最外层有1个未成对电子,次外层有2个电子;Z元素原子最高能级的不同轨道都有电子,且自旋方向相同;W元素原子的价层电子排布式是nsnnp2n。下列说法正确的是A、氢化物的稳定性:一定有Z<W B、同周期中第一电离能小于Z的有5种 C、Y、Z的最高价氧化物对应的水化物为强酸 D、X、Z可形成Z2X4 , 该分子中所有原子均满足8e﹣稳定结构11. 1934年居里夫妇用a粒子轰击金属原子 , 发现了人工放射性。涉及反应:(为中子),其中X、Y的最外层电子数之和为8。下列说法正确的是( )A、元素Y的相对原子质量为30 B、X是铝元素 C、原子半径:Y>X D、Y的含氧酸属于强电解质12. 短周期主族元素X、Y、Z、R、W的原子序数依次增大,X、Y、Z位于同一周期,Y和R位于同一主族,这五种元素构成的一种分子的结构如图所示。下列说法正确的是( )
8. 前四周期元素W、X、Y、Z的原子序数依次增大,且都不在同一周期。X的价电子排布式为nsxnpx+1 , Y的最高能级的单电子数是W的3倍,Z与W中的单电子数和最外层电子数均相同,但两者族序数不同。下列说法正确的是A、电负性比较:Y>X>Z B、Y元素的第一电离能高于其同周期相邻元素 C、Z元素在周期表中的位置可能为第四周期ⅥB族 D、X的简单氢化物比Y的简单氢化物键角小9. X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是A、Z、Y的氢化物稳定性:Z<Y B、Q与Y原子形成的分子空间结构为四面体型 C、Q单质可从Z的简单气态氢化物中置换出Z D、[W(ZX3)4]2+中σ键数为1210. 四种短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是元素周期表中原子半径最小的元素;Y元素基态原子的最外层有1个未成对电子,次外层有2个电子;Z元素原子最高能级的不同轨道都有电子,且自旋方向相同;W元素原子的价层电子排布式是nsnnp2n。下列说法正确的是A、氢化物的稳定性:一定有Z<W B、同周期中第一电离能小于Z的有5种 C、Y、Z的最高价氧化物对应的水化物为强酸 D、X、Z可形成Z2X4 , 该分子中所有原子均满足8e﹣稳定结构11. 1934年居里夫妇用a粒子轰击金属原子 , 发现了人工放射性。涉及反应:(为中子),其中X、Y的最外层电子数之和为8。下列说法正确的是( )A、元素Y的相对原子质量为30 B、X是铝元素 C、原子半径:Y>X D、Y的含氧酸属于强电解质12. 短周期主族元素X、Y、Z、R、W的原子序数依次增大,X、Y、Z位于同一周期,Y和R位于同一主族,这五种元素构成的一种分子的结构如图所示。下列说法正确的是( ) A、.上述五种元素中,非金属性最强的是Z B、最高正化合价:Z>Y>X C、最简单氢化物的还原性:Z>W>R D、Y2Z2、RZ4分子中每个原子都符合8电子结构13. 科学家利用原子序数依次递增的W、X、Y、Z四种短周期元素,“组合”成一种具有高效催化性能的超分子,其分子结构示意图如图所示(短线代表共价键)。其中W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是( )
A、.上述五种元素中,非金属性最强的是Z B、最高正化合价:Z>Y>X C、最简单氢化物的还原性:Z>W>R D、Y2Z2、RZ4分子中每个原子都符合8电子结构13. 科学家利用原子序数依次递增的W、X、Y、Z四种短周期元素,“组合”成一种具有高效催化性能的超分子,其分子结构示意图如图所示(短线代表共价键)。其中W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是( )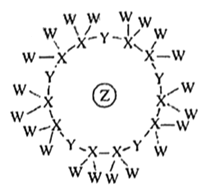 A、简单离子半径:Z>Y>W B、Y与W、X、Z均能形成至少两种化合物 C、氢化物的沸点: Y>X D、1mol ZW与水发生反应生成1mol W2 , 转移电子2mol14. 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
A、简单离子半径:Z>Y>W B、Y与W、X、Z均能形成至少两种化合物 C、氢化物的沸点: Y>X D、1mol ZW与水发生反应生成1mol W2 , 转移电子2mol14. 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( ) A、熔点:Y单质高于X单质 B、元素非金属性强弱的顺序为W>Y>Z C、W的简单氢化物稳定性比Y的简单氢化物稳定性低 D、W分别与X、Y、Z形成的二元化合物均只有两种15. “医用酒精”和“84消毒液”混合,产生ZQ、X2W4Y、XW3Q等多种物质,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素。下列叙述不正确的是( )A、简单气态氢化物热稳定性: Y>X B、W与Z可形成离子化合物ZW C、简单离子半径: Q->Y2->Z+ D、常温下,XW3Q为气态,且X、W、Q均满足8电子稳定结构16. 短周期主族元素W、X、Y、Z的原子序数依次增加,仅X、Y处于同周期,Y是地壳中含量最高的元素,Z的原子序数是X的两倍,X与Y形成的化合物可与Z的单质反应生成X的单质。下列说法正确的是( )。A、简单离子的半径: B、简单氢化物的热稳定性: C、W与Y形成的化合物只含有极性共价键 D、Z的最高价氧化物对应的水化物为强碱17. 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
A、熔点:Y单质高于X单质 B、元素非金属性强弱的顺序为W>Y>Z C、W的简单氢化物稳定性比Y的简单氢化物稳定性低 D、W分别与X、Y、Z形成的二元化合物均只有两种15. “医用酒精”和“84消毒液”混合,产生ZQ、X2W4Y、XW3Q等多种物质,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素。下列叙述不正确的是( )A、简单气态氢化物热稳定性: Y>X B、W与Z可形成离子化合物ZW C、简单离子半径: Q->Y2->Z+ D、常温下,XW3Q为气态,且X、W、Q均满足8电子稳定结构16. 短周期主族元素W、X、Y、Z的原子序数依次增加,仅X、Y处于同周期,Y是地壳中含量最高的元素,Z的原子序数是X的两倍,X与Y形成的化合物可与Z的单质反应生成X的单质。下列说法正确的是( )。A、简单离子的半径: B、简单氢化物的热稳定性: C、W与Y形成的化合物只含有极性共价键 D、Z的最高价氧化物对应的水化物为强碱17. 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( ) A、WX是共价化合物 B、原子半径:W>Z>Y C、最高价氧化物对应的水化物的酸性:Q<Y D、Z和X、Y、W、Q均形成至少两种二元化合物18. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Y最外层电子数之和为11,W与Y同族且都是复合化肥的营养元素,Z的氢化物遇水可产生最轻的气体。下列说法正确的是( )A、常温常压下X的单质为气态 B、简单气态氢化物的热稳定性:Y>W C、Z的氢化物含有共价键 D、简单离子半径:W>X19. 短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )A、简单离子半径:W>Z>Y>X B、Y原子的价电子轨道表示式为
A、WX是共价化合物 B、原子半径:W>Z>Y C、最高价氧化物对应的水化物的酸性:Q<Y D、Z和X、Y、W、Q均形成至少两种二元化合物18. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Y最外层电子数之和为11,W与Y同族且都是复合化肥的营养元素,Z的氢化物遇水可产生最轻的气体。下列说法正确的是( )A、常温常压下X的单质为气态 B、简单气态氢化物的热稳定性:Y>W C、Z的氢化物含有共价键 D、简单离子半径:W>X19. 短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )A、简单离子半径:W>Z>Y>X B、Y原子的价电子轨道表示式为 C、r与m可形成离子化合物,其阳离子电子式为
C、r与m可形成离子化合物,其阳离子电子式为 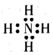 D、一定条件下,m能与Z的单质反应生成p
20. 由一种原子直接构成的物质,不可能( )A、硬度很大 B、常温下为气态 C、属于原子晶体 D、属于非电解质21. 短周期1-10号元素W、X、Y、Z的原子序数依次增大,W的最高正价和最低负价的代数和为0;X的一种核素在考古时常用来鉴定此文物的年代,Y的常见氢化物和最高价氧化物的水化物能反应生成一种离子化合物,工业上.采用液态空气分馏方法来生产Y的单质。根据以上叙述,下列说法中错误的是( )A、元素简单气态气化物的热稳定性:Z>Y>X B、W可与同主族的元素形成离子化合物 C、W、X、Y、Z四种元素可形成水溶液显中性的盐 D、X、Z分别与W形成化合物的沸点一定有:X<Z22. 全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5﹣ , N5﹣是制备全氮类物质N5+N5﹣的重要中间体.下列说法中,不正确的是( )A、全氮类物质属于绿色能源 B、每个N5+中含有35个质子 C、每个N5﹣中含有35个电子 D、N5+N5﹣结构中含共价键23. a、b、c、d均为短周期元素,它们原子的最外层电子数分别为1、3、6、7.a、d的简单离子的电子层结构相同,b、c原子的次外层电子数均为8.下列说法正确的是( )A、氢化物的沸点:c>d B、a、b、d的最高价氧化物对应的水化物两两皆能反应 C、a、b、c的简单离子都会破坏水的电离平衡 D、简单离子的半径:c>d>a>b24. 短周期元素X,Y,Z,Q,T的原子序数与其常见化合价关系如图.下列说法正确的是( )
D、一定条件下,m能与Z的单质反应生成p
20. 由一种原子直接构成的物质,不可能( )A、硬度很大 B、常温下为气态 C、属于原子晶体 D、属于非电解质21. 短周期1-10号元素W、X、Y、Z的原子序数依次增大,W的最高正价和最低负价的代数和为0;X的一种核素在考古时常用来鉴定此文物的年代,Y的常见氢化物和最高价氧化物的水化物能反应生成一种离子化合物,工业上.采用液态空气分馏方法来生产Y的单质。根据以上叙述,下列说法中错误的是( )A、元素简单气态气化物的热稳定性:Z>Y>X B、W可与同主族的元素形成离子化合物 C、W、X、Y、Z四种元素可形成水溶液显中性的盐 D、X、Z分别与W形成化合物的沸点一定有:X<Z22. 全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5﹣ , N5﹣是制备全氮类物质N5+N5﹣的重要中间体.下列说法中,不正确的是( )A、全氮类物质属于绿色能源 B、每个N5+中含有35个质子 C、每个N5﹣中含有35个电子 D、N5+N5﹣结构中含共价键23. a、b、c、d均为短周期元素,它们原子的最外层电子数分别为1、3、6、7.a、d的简单离子的电子层结构相同,b、c原子的次外层电子数均为8.下列说法正确的是( )A、氢化物的沸点:c>d B、a、b、d的最高价氧化物对应的水化物两两皆能反应 C、a、b、c的简单离子都会破坏水的电离平衡 D、简单离子的半径:c>d>a>b24. 短周期元素X,Y,Z,Q,T的原子序数与其常见化合价关系如图.下列说法正确的是( ) A、1 mol TX2与足量X2反应生成TX3的分子数目为NA B、Z元素形成的可溶性盐溶液可能显碱性 C、1 mol Y2X2与足量H2O反应转移的电子数目为2NA D、0.1 molQ元素的含氧酸在水中电离出的H十数目为3NA25. 短周期元素W,X,Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )A、元素W,X的氯化物中,各原子均满足8电子的稳定结构 B、元素X与氢形成的原子比为1:1的化合物有很多种 C、元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 D、元素Z可与元素X形成共价化合物XZ226. X,Y是第2或第3周期中的两种元素,它们可形成离子化合物XmYn , 且离子均有稀有气体原子的电子结构.若X的原子序数为a,则Y的原子序数不可能为( )A、a+8﹣m﹣n B、a﹣8+m﹣n C、a+16﹣m﹣n D、a﹣m﹣n27. 位于不同短周期的两种主族元素X,Y,已知Y的原子序数为X的2倍,下列说法正确的是( )A、X元素原子的半径一定小于Y元素原子的半径 B、Y元素的氧化物不可能与X元素的气态氢化物反应 C、X元素与氢元素形成的化合物中一定不含非极性键 D、Y元素与X元素原子的最外层电子数一定不相等28. 已知短周期元素的离子aA2+、bB+、cC3﹣都具有相同的电子层结构,下列叙述正确的是( )A、原子半径A>B>C B、原子序数C>B>A C、单质的还原性A>B>C D、离子半径C>B>A29. 已知1~18号元素的离子W3+、X+、Y2﹣、Z﹣都具有相同的电子层结构,下列关系正确的是( )A、元素第一电离能:X>W B、离子的还原性:Y2﹣>Z﹣ C、氢化物的稳定性:H2Y>HZ D、原子半径:X<W
A、1 mol TX2与足量X2反应生成TX3的分子数目为NA B、Z元素形成的可溶性盐溶液可能显碱性 C、1 mol Y2X2与足量H2O反应转移的电子数目为2NA D、0.1 molQ元素的含氧酸在水中电离出的H十数目为3NA25. 短周期元素W,X,Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )A、元素W,X的氯化物中,各原子均满足8电子的稳定结构 B、元素X与氢形成的原子比为1:1的化合物有很多种 C、元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 D、元素Z可与元素X形成共价化合物XZ226. X,Y是第2或第3周期中的两种元素,它们可形成离子化合物XmYn , 且离子均有稀有气体原子的电子结构.若X的原子序数为a,则Y的原子序数不可能为( )A、a+8﹣m﹣n B、a﹣8+m﹣n C、a+16﹣m﹣n D、a﹣m﹣n27. 位于不同短周期的两种主族元素X,Y,已知Y的原子序数为X的2倍,下列说法正确的是( )A、X元素原子的半径一定小于Y元素原子的半径 B、Y元素的氧化物不可能与X元素的气态氢化物反应 C、X元素与氢元素形成的化合物中一定不含非极性键 D、Y元素与X元素原子的最外层电子数一定不相等28. 已知短周期元素的离子aA2+、bB+、cC3﹣都具有相同的电子层结构,下列叙述正确的是( )A、原子半径A>B>C B、原子序数C>B>A C、单质的还原性A>B>C D、离子半径C>B>A29. 已知1~18号元素的离子W3+、X+、Y2﹣、Z﹣都具有相同的电子层结构,下列关系正确的是( )A、元素第一电离能:X>W B、离子的还原性:Y2﹣>Z﹣ C、氢化物的稳定性:H2Y>HZ D、原子半径:X<W二、非选择题
-
30. 回答下列问题(1)、四种元素的原子半径如下表:
元素符号
Li
Be
Na
S
Cl
原子半径/pm
152
89
186
102
99
由此可推理:决定原子半径大小的因素有
(2)、和都是化工生产中的重要物质。①的沸点(-33.5℃)高于的沸点(-129℃)的主要原因是
②的一种下游产品三聚氟氰(分子式为:),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式。
31. 碳酸二甲酯( )是一种环保性能优异,用途广泛的化工原料,其合成方法有多种。 (1)、Ⅰ.在催化剂作用下由CO2制备碳酸二甲酯的过程如图:
)是一种环保性能优异,用途广泛的化工原料,其合成方法有多种。 (1)、Ⅰ.在催化剂作用下由CO2制备碳酸二甲酯的过程如图:
尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而电离能较低;
②。
(2)、下列关于氨气的叙述不正确的是(填字母)。a.NH3的键角小于CH4的键角,是因为NH3的中心原子上孤电子对有较大斥力
b.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
c.NH3的沸点比PH3的高,是因为N—H的键能比P—H的大
(3)、Ⅱ.在CeO2—ZrO2固溶体的催化体系中也能将CO2转化为碳酸二甲酯。氧化锆(化学式为ZrO2)晶胞结构如图所示,Zr4+在晶胞中的配位数是 , 若该晶胞的密度为ρg·cm-3 , 用NA表示阿伏加德罗常数的值,则该晶胞的体积是cm3(列出计算式)。(氧化锆的摩尔质量M=123g·mol-1)
 (4)、Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如表所示。
(4)、Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如表所示。元素
电离能(kJ·mol-1)
I1
I2
I3
Mn
717
1509
3248
Fe
759
1561
2957
①铁元素位于元素周期表族,属于区。
②比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子更难,请从原子结构分析原因。
32. 不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:(1)、写出碳原子最外层电子的轨道表示式 , 其最外层有种不同运动状态的电子。(2)、硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:。(3)、下面是工业上冶炼Cr时涉及到的反应:①请将方程式补充完整并配平。
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
②上述反应中,若转移了3mol电子,得到的还原产物是mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式。
(4)、镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4 , 呈四面体构型。Ni(CO)4是晶体,Ni(CO)4易溶于下列(填序号)。a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
33. Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:元素
相关信息
Y
原子核外有6个不同运动状态的电子
Z
非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同
W
主族元素,与Z原子的价电子数相同
R
价层电子排布式为3d64s2
M
IB族,其被称作“电器工业的主角”
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)、Z、W元素相比,第一电离能较大的是 , M2+的核外电子排布式为。(2)、M2Z的熔点比M2W的(填“高”或“低”) ,请解释原因 。(3)、N3-和YZ2是等电子体,则N3-的结构式为 。(4)、WZ2分子中W原子价层电子对数是对,WZ2的VSEPR 模型名称为 , WZ3气态为单分子,该分子中W原子的杂化轨道类型为;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为(填图2中字母) ,该分子中含有个σ键。 (5)、MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与个W原子相连,晶体密度ρ=g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023mol-1)。34. B元素和N元素对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。(1)、基态氮原子的外围电子排布图为;晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的性。(2)、氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,与氨硼烷互为等电子体的分子、离子的化学式分别是、。 (各举一例),第二周期元素中第一电离能介于B和N之间的元素是(填元素符号)。(3)、血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如下图:
(5)、MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与个W原子相连,晶体密度ρ=g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023mol-1)。34. B元素和N元素对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。(1)、基态氮原子的外围电子排布图为;晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的性。(2)、氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,与氨硼烷互为等电子体的分子、离子的化学式分别是、。 (各举一例),第二周期元素中第一电离能介于B和N之间的元素是(填元素符号)。(3)、血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如下图: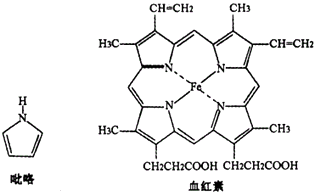
①已知吡咯中的各个原子均在同一平面内;则吡咯分子中N原子的杂化类型为。
②1mol吡咯分子中所含的σ键总数为个;分子中的大π键可用Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为。
③C、N、O三种元素的简单氢化物键角由小到大的顺序为(填化学式),原因是。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过键相结合。
(4)、氮化硼(BN)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。已知该晶体密度为ag/cm3 , 根据硬球接触模型计算晶体中两个最近的N原子间的距离为:pm。(用含a的代数式表示,NA表示阿伏加德罗常数)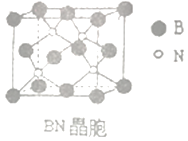 35. 磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:(1)、磷原子的最外层电子排布式是 , 氧原子核外有种不同运动状态的电子。C、O两种元素非金属性较强的是。(2)、白磷在空气中露置时间长了会因温度达到而自燃,使白磷升温的热量主要来自。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5 , 发生反应PCl5(g) PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。(3)、该反应的平衡常数表达式 K=;(4)、其他条件不变,起始时向上述容器中充入1.0 mol PCl5 , 达到平衡时,PCl5的转化率(选填“增大”、 “减小”“不变”),平衡常数 K(选填“增大”、 “减小”“不变”)。(5)、在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
35. 磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:(1)、磷原子的最外层电子排布式是 , 氧原子核外有种不同运动状态的电子。C、O两种元素非金属性较强的是。(2)、白磷在空气中露置时间长了会因温度达到而自燃,使白磷升温的热量主要来自。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5 , 发生反应PCl5(g) PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。(3)、该反应的平衡常数表达式 K=;(4)、其他条件不变,起始时向上述容器中充入1.0 mol PCl5 , 达到平衡时,PCl5的转化率(选填“增大”、 “减小”“不变”),平衡常数 K(选填“增大”、 “减小”“不变”)。(5)、在不同时间(t)测得反应过程中 PCl5 的部分数据如下:t(s)
0
50
100
250
350
n(mol)
0.5
0.42
0.41
0.40
0.40
则 100s 时, PCl3的物质的量浓度是。