高考二轮复习知识点:原子核外电子的跃迁及应用
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列说法错误的是( )A、高压钠灯可用于道路照明 B、 可用来制造光导纤维 C、工业上可采用高温冶炼黄铜矿的方法获得粗铜 D、 不溶于水,可用作医疗上检查肠胃的钡餐2. 化学与生产、生活、科技密切相关。下列说法错误的是A、硅胶、生石灰均可用作食品干燥剂 B、葡萄糖在酒化酶的作用下发生水解反应生成乙醇 C、将CO2还原为甲醇,有利于实现“碳中和” D、焰火、激光都与原子核外电子跃迁释放能量有关3. 下列说法错误的是A、激光、荧光、LED灯光都与电子跃迁释放能量有关 B、臭氧为弱极性分子,在水中的溶解度高于在四氯化碳中的溶解度 C、等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的气态物质 D、由于甲基(--CH3)推电子,甲酸的pKa小于乙酸的pKa4. 下列说法错误的是A、激光、焰火都与电子跃迁释放能量有关 B、可燃冰()中甲烷与水分子间存在氢键 C、冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别” D、晶体的自范性是晶体在微观空间呈周期性有序排列的宏观表象5. 以下化学与生活、科技相关的说法错误的是( )A、北京冬奥会闭幕式上绽放的璀璨烟火与原子核外电子发生跃迁释放能量有关 B、以棉质好、产量高著称的新疆长绒棉主要成分与蔗糖属于同系物 C、“天宫课堂”中过饱和乙酸钠溶液析晶放热与形成新的化学键有关 D、“冰墩墩”透明外壳是二氯硅烷水解缩聚生成的,属于合成高分子材料6. 中国科学家经过光谱分析发现了一颗锂元素含量极高的恒星。下列说法不正确的是( )A、LiOH的碱性弱于Be(OH)2 B、在碱金属元素中,锂元素的第一电离能最大 C、依据对角线规则,锂元素和镁元素的有些性质相似 D、原子光谱的产生与电子跃迁有关,可利用原子光谱中的特征谱线来鉴定锂元素7. 利用反应2FeC2O4·2H2O+H2O2+3K2C2O4+H2C2O4=2K3[Fe(C2O4)3]·3H2O可制备光敏材料三草酸合铁酸钾晶体。下列说法正确的是( )A、H2O2是含有非极性键的极性分子 B、激发态的钾原子回到基态,会形成吸收光谱 C、向草酸亚铁溶液中滴加酸性KMnO4溶液,紫色褪去可证明溶液中含有Fe2+ D、H2C2O4 (
 )与CH3COOH相比,可电离出的H+个数更多,所以酸性更强
8. 下列说法正确的是A、原子光谱是由基态原子吸收能量到激发态时,电子跃迁产生的 B、与中,键角大于键角 C、某元素基态原子的最外层电子排布式为 , 则该元素为ⅡA族元素 D、因为分子间有氢键,所以的稳定性比强9. 中华文化博大精深,蕴含着许多化学知识。下列说法错误的是A、“蜡(主要成分为石蜡)炬成灰泪始干”,“泪”是蜡烛燃烧的产物 B、“强烧之,紫青烟起……云是真硝石也”,此现象涉及电子的跃迁 C、“春蚕到死丝方尽”中,“丝”的主要成分为蛋白质 D、“葡萄美酒夜光杯”中的“美酒”的酿制包含了淀粉的水解过程10. 化学与生产生活、能源、航空航天、医疗健康等诸多领域的需求密切相关。下列说法错误的是A、北京冬奥会吉祥物“冰墩墩”的制作原料之一聚氯乙烯可通过加聚反应制得 B、汕头海湾隧道风塔亮灯,美轮美奂的LED灯光与原子核外电子跃迁释放能量有关 C、“神舟十三号”飞船返回舱外壳的烧蚀材料之一酚醛树脂是酚与醛在碱的催化下相互缩合而成的具有网状结构的高分子 D、核酸是生物体遗传信息的载体,通过红外光谱仪可检测其结构中存在的多种单键、双键、氢键等化学键11. 2022年北京冬奥会的成功举办离不开各种科技力量的支持。下列说法错误的是( )
)与CH3COOH相比,可电离出的H+个数更多,所以酸性更强
8. 下列说法正确的是A、原子光谱是由基态原子吸收能量到激发态时,电子跃迁产生的 B、与中,键角大于键角 C、某元素基态原子的最外层电子排布式为 , 则该元素为ⅡA族元素 D、因为分子间有氢键,所以的稳定性比强9. 中华文化博大精深,蕴含着许多化学知识。下列说法错误的是A、“蜡(主要成分为石蜡)炬成灰泪始干”,“泪”是蜡烛燃烧的产物 B、“强烧之,紫青烟起……云是真硝石也”,此现象涉及电子的跃迁 C、“春蚕到死丝方尽”中,“丝”的主要成分为蛋白质 D、“葡萄美酒夜光杯”中的“美酒”的酿制包含了淀粉的水解过程10. 化学与生产生活、能源、航空航天、医疗健康等诸多领域的需求密切相关。下列说法错误的是A、北京冬奥会吉祥物“冰墩墩”的制作原料之一聚氯乙烯可通过加聚反应制得 B、汕头海湾隧道风塔亮灯,美轮美奂的LED灯光与原子核外电子跃迁释放能量有关 C、“神舟十三号”飞船返回舱外壳的烧蚀材料之一酚醛树脂是酚与醛在碱的催化下相互缩合而成的具有网状结构的高分子 D、核酸是生物体遗传信息的载体,通过红外光谱仪可检测其结构中存在的多种单键、双键、氢键等化学键11. 2022年北京冬奥会的成功举办离不开各种科技力量的支持。下列说法错误的是( ) A、滑冰场上的冰中水分子的热稳定性高于甲烷 B、用于跨临界直冷技术制冰的二氧化碳是非极性分子 C、颁奖礼服内胆中添加的石墨烯(部分结构如图)是分子晶体 D、闭幕式的水上烟火与原子核外电子发生跃迁有关12. 下列说法中,正确的是( )A、不同能层的s轨道大小、形状都相同 B、最外层电子数为2的元素一定位于s区 C、电离能越大的元素,电负性也越大 D、碳原子的能量:激发态>基态13. 化学源于生活,生活中蕴含着丰富的化学知识。下列说法正确的是( )A、二氧化碳作制冷剂与断裂碳氧键需要吸收热量有关 B、含有苯酚的药皂用于皮肤的杀菌消毒,说明苯酚没有腐蚀性 C、焰火五颜六色,是因为某些原子的电子从基态跃迁到激发态释放能量 D、北京冬奥会使用的可降解餐具,主要成分聚乳酸是由乳酸经过缩聚反应合成的14. 下列说法错误的是( )A、某些金属盐灼烧呈现不同焰色是因为电子从高能轨道跃迁至低能轨道释放不同波长的光 B、超分子具有分子识别和自组装的特征 C、右上角的3表示该能级有3个轨道 D、的VSEPR模型和离子的空间构型一致15. 下列有关原子结构的说法正确的是( )A、霓虹灯发光与原子核外电子跃迁释放能量有关 B、氖原子与钠离子两粒子的2p能级上的电子离核的距离相同 C、M能层中有3s、3p、3d、3f四个能级,共16个轨道 D、基态镁原子核外电子的轨道表示式为
A、滑冰场上的冰中水分子的热稳定性高于甲烷 B、用于跨临界直冷技术制冰的二氧化碳是非极性分子 C、颁奖礼服内胆中添加的石墨烯(部分结构如图)是分子晶体 D、闭幕式的水上烟火与原子核外电子发生跃迁有关12. 下列说法中,正确的是( )A、不同能层的s轨道大小、形状都相同 B、最外层电子数为2的元素一定位于s区 C、电离能越大的元素,电负性也越大 D、碳原子的能量:激发态>基态13. 化学源于生活,生活中蕴含着丰富的化学知识。下列说法正确的是( )A、二氧化碳作制冷剂与断裂碳氧键需要吸收热量有关 B、含有苯酚的药皂用于皮肤的杀菌消毒,说明苯酚没有腐蚀性 C、焰火五颜六色,是因为某些原子的电子从基态跃迁到激发态释放能量 D、北京冬奥会使用的可降解餐具,主要成分聚乳酸是由乳酸经过缩聚反应合成的14. 下列说法错误的是( )A、某些金属盐灼烧呈现不同焰色是因为电子从高能轨道跃迁至低能轨道释放不同波长的光 B、超分子具有分子识别和自组装的特征 C、右上角的3表示该能级有3个轨道 D、的VSEPR模型和离子的空间构型一致15. 下列有关原子结构的说法正确的是( )A、霓虹灯发光与原子核外电子跃迁释放能量有关 B、氖原子与钠离子两粒子的2p能级上的电子离核的距离相同 C、M能层中有3s、3p、3d、3f四个能级,共16个轨道 D、基态镁原子核外电子的轨道表示式为 16. 下列有关原子光谱的说法中,错误的是( )A、通过光谱分析可以鉴定某些元素 B、电子由低能级跃迁至较高能级时,一定发生的是化学变化 C、燃放的焰火在夜空中呈现五彩缤纷的礼花与原子核外电子的跃迁有关 D、原子中的电子在跃迁时能量的表现形式之一是光,这也是原子光谱产生的原因17. 下列关于原子结构的说法不正确的是( )A、原子光谱上的特征谱线可用于元素鉴定 B、同一原子中,2p、3p、 4p电子的能量依次增强 C、日常生活中的焰火、LED灯都与原子核外电子跃迁释放能量有关 D、在同一能层上运动的电子,其自旋方向肯定不同18. 下列有关叙述不正确的是( )A、分子、原子和离子是构成物质的基本微粒 B、带有单电子的原子或原子团是自由基 C、一个非可逆化学反应是一个基元反应 D、处于最低能量状态的原子是基态原子19. 2021年10月16日0时23分,神舟十三号载人飞船发射取得圆满成功,我国太空计划再次迈出重要一步。下列与这次载人飞行任务有关化学知识的描述中错误的是( )A、研究和改变合金中原子排布可以为航天工业寻找性能优越的材料 B、太空中观测恒星的光谱来自于原子中电子在轨道上的跃迁 C、宇航员所呼吸的氧气可通过电解水反应制备 D、太空舱中的太阳能电池翼工作时是将化学能转化为电能20. 下列叙述中正确的有( )A、运用价层电子对互斥理论,CO离子的空间构型为三角锥型 B、具有相同核外电子排布的粒子,化学性质相同 C、NCl3中N—Cl键的键长比CCl4中C—Cl键的键长短 D、日常生活中的焰火、LED灯与原子核外电子跃迁释放能量无关21. 生活中的下列现象与原子核外电子发生跃迁有关的是( )A、钢铁长期使用后生锈 B、霓虹灯广告 C、平面镜成像 D、金属导线可以导电22. 下列N原子电子排布图表示的状态中,能量最高的是( )A、
16. 下列有关原子光谱的说法中,错误的是( )A、通过光谱分析可以鉴定某些元素 B、电子由低能级跃迁至较高能级时,一定发生的是化学变化 C、燃放的焰火在夜空中呈现五彩缤纷的礼花与原子核外电子的跃迁有关 D、原子中的电子在跃迁时能量的表现形式之一是光,这也是原子光谱产生的原因17. 下列关于原子结构的说法不正确的是( )A、原子光谱上的特征谱线可用于元素鉴定 B、同一原子中,2p、3p、 4p电子的能量依次增强 C、日常生活中的焰火、LED灯都与原子核外电子跃迁释放能量有关 D、在同一能层上运动的电子,其自旋方向肯定不同18. 下列有关叙述不正确的是( )A、分子、原子和离子是构成物质的基本微粒 B、带有单电子的原子或原子团是自由基 C、一个非可逆化学反应是一个基元反应 D、处于最低能量状态的原子是基态原子19. 2021年10月16日0时23分,神舟十三号载人飞船发射取得圆满成功,我国太空计划再次迈出重要一步。下列与这次载人飞行任务有关化学知识的描述中错误的是( )A、研究和改变合金中原子排布可以为航天工业寻找性能优越的材料 B、太空中观测恒星的光谱来自于原子中电子在轨道上的跃迁 C、宇航员所呼吸的氧气可通过电解水反应制备 D、太空舱中的太阳能电池翼工作时是将化学能转化为电能20. 下列叙述中正确的有( )A、运用价层电子对互斥理论,CO离子的空间构型为三角锥型 B、具有相同核外电子排布的粒子,化学性质相同 C、NCl3中N—Cl键的键长比CCl4中C—Cl键的键长短 D、日常生活中的焰火、LED灯与原子核外电子跃迁释放能量无关21. 生活中的下列现象与原子核外电子发生跃迁有关的是( )A、钢铁长期使用后生锈 B、霓虹灯广告 C、平面镜成像 D、金属导线可以导电22. 下列N原子电子排布图表示的状态中,能量最高的是( )A、 B、
B、 C、
C、 D、
D、 23. 生活是化学的源泉。下列叙述错误的是( )A、浓度为75%的酒精、含氯消毒剂、双氧水均可以有效灭活新型冠状病毒 B、煤、石油、太阳能、风能等均属于新能源 C、许多食品包装盒里用小袋包装的铁粉来防止食品氧化变质 D、节日里燃放的焰火与电子的跃迁有关24. 生活中的化学无处不在,下列关于生活中的化学描述错误的是( )A、可以用光谱分析的方法来确定太阳的组成元素是否含氦 B、壁虎在天花板上爬行自如是因为壁虎的脚与墙体之间有范德华力 C、汽油不易溶解于水是因为水分子的极性和汽油分子的极性不同 D、“挑尽寒灯梦不成”所看到的灯光和原子核外电子跃迁无关25. 下列现象和应用与电子跃迁无关的是( )A、石墨导电 B、焰色反应 C、原子光谱 D、激光26. 下列现象和应用与电子跃迁无关的是( )A、焰色反应 B、石墨导电 C、激光 D、原子光谱
23. 生活是化学的源泉。下列叙述错误的是( )A、浓度为75%的酒精、含氯消毒剂、双氧水均可以有效灭活新型冠状病毒 B、煤、石油、太阳能、风能等均属于新能源 C、许多食品包装盒里用小袋包装的铁粉来防止食品氧化变质 D、节日里燃放的焰火与电子的跃迁有关24. 生活中的化学无处不在,下列关于生活中的化学描述错误的是( )A、可以用光谱分析的方法来确定太阳的组成元素是否含氦 B、壁虎在天花板上爬行自如是因为壁虎的脚与墙体之间有范德华力 C、汽油不易溶解于水是因为水分子的极性和汽油分子的极性不同 D、“挑尽寒灯梦不成”所看到的灯光和原子核外电子跃迁无关25. 下列现象和应用与电子跃迁无关的是( )A、石墨导电 B、焰色反应 C、原子光谱 D、激光26. 下列现象和应用与电子跃迁无关的是( )A、焰色反应 B、石墨导电 C、激光 D、原子光谱二、非选择题
-
27. [化学——选修3:物质结构与性质]
卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)、氟原子激发态的电子排布式有 , 其中能量较高的是。(填标号)a. b. c. d.
(2)、①一氯乙烯分子中,C的一个杂化轨道与的轨道形成键,并且的轨道与C的轨道形成3中心4电子的大键。②一氯乙烷、一氯乙烯、一氯乙炔分子中,键长的顺序是 , 理由:(ⅰ)C的杂化轨道中s成分越多,形成的键越强;(ⅱ)。
(3)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为。解释X的熔点比Y高的原因。(4)、晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为。
已知阿伏加德罗常数为 , 则晶体的摩尔体积(列出算式)。
28. 铁是一种常见的金属,在生产生活中用途广泛。(1)、铁在元素周期表中的位置是 , 其基态原子的电子排布式为;铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用摄取铁元素的原子光谱。(2)、Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁(Fe3N),NH3分子的立体构型为;1mol Fe(CO)5分子中含有σ键为mol。(3)、把氯气通入黄血盐{K4[Fe(CN)6]}溶液中,得到赤血盐{K3[Fe(CN)6]},该反应的化学方程式为;CN- 中碳原子的杂化轨道类型为。C、N、O元素的第一电离能的大小顺序为。(4)、FeCl3可与KSCN溶液发生显色反应。SCN- 与N2O互为等电子体,则SCN-的电子式为。29. 硫及其化合物有许多用途。请回答下列问题。(1)、基态硫原子的价电子排布式为 , 其电子占据最高能级的电子云轮廓图形状为(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是 , SO2中心原子的价层电子对数为。(4)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有A. H2O B. CO2 C. SO2 D. CH4
(5)、方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为 g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm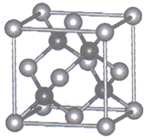 30. 氟及其化合物用途非常广泛。回答下列问题:(1)、聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过方法区分晶体、准晶体和非晶体。(2)、基态锑(Sb)原子价电子排布的轨道式为。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+ , 该离子的空间构型为 , 依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是、。(3)、硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
30. 氟及其化合物用途非常广泛。回答下列问题:(1)、聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过方法区分晶体、准晶体和非晶体。(2)、基态锑(Sb)原子价电子排布的轨道式为。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+ , 该离子的空间构型为 , 依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是、。(3)、硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序(填元素符号)。
②H3BO3本身不能电离出H+ , 在水中易结合一个OH﹣生成[B(OH)4]﹣ , 而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力
(4)、SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为kJ·mol-1。 (5)、CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
(5)、CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。①CuF比CuCl熔点高的原因是;
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=nm (列出计算式)。
31.(1)、许多金属元素有焰色反应,金属存在焰色反应的原因是。(2)、基态铝原子中,有种电子运动状态,其中p轨道的电子云轮廓图的形状为。(3)、我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。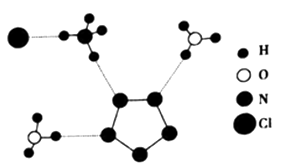
①图中R中阳离子是(填写化学式),相对分子质量较大的阳离子中心原子的杂化类型是。
②图中R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则N5- 中的大π键应表示为。
(4)、氮与铝之间形成化合物X,具有耐高温抗冲击等性能。X的晶体结构如图所示。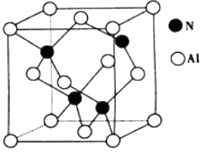
①已知氮化硼与X晶体类型相同,推测氮化硼的熔点比X的熔点(填“高”、“低“ ) ,可能的原因是。
②若X的密度为ρg·cm-3 , 则晶体中最近的两个Al原子的距离为cm。(阿伏加德罗常数的值用NA表示)
32.(1)、福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。
①氨基氰CH2N2)分子中C、N 原子均满足8电子稳定结构,则该分子的结构式为;该分子为(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是。
③关于g- C3N4的叙述正确的是。
A.电负性:C>N
B.该物质的熔点比石墨更高
C.该物质属于原子晶体
D.该物质中C和N原子均采取SP2杂化
(2)、NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。
①NH3的空间构型为。
②[Zn(NH3)6]2+离子中存在的化学键类型有;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H 键角107.3°( 填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有。(写一种)
(3)、N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。
①Xn+中所有的电子恰好充满K、L、M 三个电子层,则基态X原子的价电子的轨道表示式为。
②已知该晶体的密度为5.84g·cm-3 , 则阿伏加德罗常数NA的计算表示式为(含a)。
33. ⅡB-ⅥA化合物半导体纳米材料(如 、 、 、 )等在光电子器件、太阳能电池以及生物探针等方面有广阔前景。回答下列问题:(1)、砷元素基态原子价层电子排布式为:(2)、下列状态的锌,分别失去最外层一个电子所需能量最小的是___________。A、 B、
B、 C、
C、 D、
D、 (3)、雄黄( )如图1和雌黄( )如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中 原子轨道杂化类型为。图2中 键角 键角(填 , 或 )。
(3)、雄黄( )如图1和雌黄( )如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中 原子轨道杂化类型为。图2中 键角 键角(填 , 或 )。 (4)、 分子中 键数目有个,分子的空间构型为。分子中大 键可用符号 表示,其中m代表参与形成的大 键原子数,n代表参与形成大 键电子数(如苯分子中的 键可表示为 ,则 中大 键应表示为。(5)、 具有独特的电学及光学特性,是一种应用广泛的功能材料。
(4)、 分子中 键数目有个,分子的空间构型为。分子中大 键可用符号 表示,其中m代表参与形成的大 键原子数,n代表参与形成大 键电子数(如苯分子中的 键可表示为 ,则 中大 键应表示为。(5)、 具有独特的电学及光学特性,是一种应用广泛的功能材料。①已知 和O的电负性分别为1.65、3.5, 中化学键类型为 , 可以与 溶液溶解生成 ,请从化学键角度解释能形成该离子的原因。
②一种 晶体的晶胞(立方体)如图3所示, 为阿伏加德罗常数的值, 原子半径为 。图4是沿着立方格子对角面取得的截图,则 原子与O原子间最短距离x= 。晶体的密度为 (列出计算式即可)。
 34. 铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:(1)、铜或铜盐的焰色反应为绿色,该光谱是(填“吸收光谱”或“发射光谱”)。(2)、基态Cu原子中,核外电子占据的最低能层符号是 , 其价电子层的电子排布式为 , Cu与Ag均属于IB族,熔点:CuAg (填“>”或“<”)。(3)、[Cu(NH3)4]SO4 中阴离子的立体构型是;中心原子的轨道杂化类型为 , [Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为。(4)、用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为。(5)、氯、铜两种元素的电负性如表: CuCl属于(填“共价”或“离子”)化合物。
34. 铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:(1)、铜或铜盐的焰色反应为绿色,该光谱是(填“吸收光谱”或“发射光谱”)。(2)、基态Cu原子中,核外电子占据的最低能层符号是 , 其价电子层的电子排布式为 , Cu与Ag均属于IB族,熔点:CuAg (填“>”或“<”)。(3)、[Cu(NH3)4]SO4 中阴离子的立体构型是;中心原子的轨道杂化类型为 , [Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为。(4)、用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为。(5)、氯、铜两种元素的电负性如表: CuCl属于(填“共价”或“离子”)化合物。元素
Cl
Cu
电负性
3.2
1.9
(6)、Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3 , 晶胞边长为a cm,则阿伏加德罗常数为(用含ρ、a的代数式表示)。 35. 卤族元素的单质和化合物在生产生活中有重要的用途。(1)、基态溴原子的核外电子排布式为[Ar]。(2)、在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是。(3)、HIO3的酸性(填“强于”或“弱于”) HIO4 , 原因是。(4)、ClO2-中心氯原子的杂化类型为 , ClO3-的空间构型为。(5)、晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为( , ,0);C处为(1,1,1)。则D处微粒的坐标参数为。
35. 卤族元素的单质和化合物在生产生活中有重要的用途。(1)、基态溴原子的核外电子排布式为[Ar]。(2)、在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是。(3)、HIO3的酸性(填“强于”或“弱于”) HIO4 , 原因是。(4)、ClO2-中心氯原子的杂化类型为 , ClO3-的空间构型为。(5)、晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为( , ,0);C处为(1,1,1)。则D处微粒的坐标参数为。

②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3 , 则晶胞中Ca2+与离它最近的F-之间的距离为nm (设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。