高考二轮复习知识点:原子核外电子排布1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式:
 C、的空间结构:
C、的空间结构: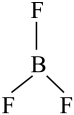 (平面三角形)
D、的形成过程:
(平面三角形)
D、的形成过程: 2. 下列化学用语表述错误的是A、HClO的电子式:
2. 下列化学用语表述错误的是A、HClO的电子式: B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型:
B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型: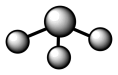 D、基态N原子的价层电子排布图:
D、基态N原子的价层电子排布图: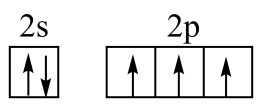 3. 下列化学用语或表述正确的是
3. 下列化学用语或表述正确的是 A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:4. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。基于结构视角,下列说法正确的是
A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:4. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。基于结构视角,下列说法正确的是 A、所有C原子的杂化方式均相同 B、所含元素的第一电离能:O>N>C C、该分子能与水形成分子间氢键 D、O的价层电子轨道表示式:5. 下列化学用语表示正确的是A、离子结构示意图:
A、所有C原子的杂化方式均相同 B、所含元素的第一电离能:O>N>C C、该分子能与水形成分子间氢键 D、O的价层电子轨道表示式:5. 下列化学用语表示正确的是A、离子结构示意图: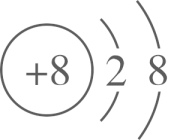 B、基态铜原子价电子的轨道表示式:
B、基态铜原子价电子的轨道表示式: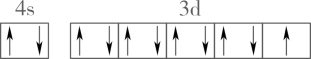 C、的空间结构:
C、的空间结构: (正四面体形)
D、的电子式:
(正四面体形)
D、的电子式: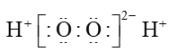 6. 三星堆遗址出土了大量的青铜器,其主要成分为Cu、Sn、Pb,还含少量Fe、As、O等元素。对上述有关元素,下列说法正确的是A、基态Cu原子的价层电子轨道表示式为
6. 三星堆遗址出土了大量的青铜器,其主要成分为Cu、Sn、Pb,还含少量Fe、As、O等元素。对上述有关元素,下列说法正确的是A、基态Cu原子的价层电子轨道表示式为 B、基态Fe原子最高能级的轨道形状为哑铃形
C、第一电离能最大的是As
D、电负性最大的是O
7. 下列化学用语或图示错误的是A、1-丁烯的实验式:CH2 B、的VSEPR模型:
B、基态Fe原子最高能级的轨道形状为哑铃形
C、第一电离能最大的是As
D、电负性最大的是O
7. 下列化学用语或图示错误的是A、1-丁烯的实验式:CH2 B、的VSEPR模型: C、基态Cr原子的价层电子排布式:3d54s1
D、HCl分子中σ键的形成:
C、基态Cr原子的价层电子排布式:3d54s1
D、HCl分子中σ键的形成: 8. 高铁酸钠(Na2FeO4)是一种新型净水剂,可用于饮用水处理。湿法制高铁酸钠的反应原理为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。下列有关说法错误的是A、H2O的球棍模型为
8. 高铁酸钠(Na2FeO4)是一种新型净水剂,可用于饮用水处理。湿法制高铁酸钠的反应原理为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。下列有关说法错误的是A、H2O的球棍模型为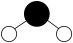 B、基态Fe3+的简化电子排布式为[Ar]3d34s2
C、NaClO的电子式为
B、基态Fe3+的简化电子排布式为[Ar]3d34s2
C、NaClO的电子式为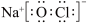 D、37Cl原子结构示意图为
D、37Cl原子结构示意图为 9. 某水性钠离子电池电极材料由、、、组成,其立方晶胞嵌入和嵌出过程中,与含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是
9. 某水性钠离子电池电极材料由、、、组成,其立方晶胞嵌入和嵌出过程中,与含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是 A、普鲁士蓝中与个数比为1∶2 B、格林绿晶体中周围等距且最近的数为6 C、基态Fe原子的价电子排布式为 , 失去4s电子转化为 D、若普鲁士白的晶胞棱长为apm,则其晶体的密度为10. 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是A、N元素基态原子所有价电子的电子云轮廓图均为哑铃形 B、Se元素基态原子的电子排布式为[Ar]4s24p4 C、O、F、Cl电负性由大到小的顺序为F>Cl>O D、第一电离能As>Se11. (CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+ , 下列说法正确的是
A、普鲁士蓝中与个数比为1∶2 B、格林绿晶体中周围等距且最近的数为6 C、基态Fe原子的价电子排布式为 , 失去4s电子转化为 D、若普鲁士白的晶胞棱长为apm,则其晶体的密度为10. 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是A、N元素基态原子所有价电子的电子云轮廓图均为哑铃形 B、Se元素基态原子的电子排布式为[Ar]4s24p4 C、O、F、Cl电负性由大到小的顺序为F>Cl>O D、第一电离能As>Se11. (CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+ , 下列说法正确的是 A、Pb2+的价电子排布式为:6s26p2 B、A代表I- C、若原子分数坐标A为(0,0,0),B为( , , ),则C的原子分数坐标为(0, , ) D、已知CH3NH3)PbI3的摩尔质量为Mg·mol-1 , NA为阿伏加德罗常数的值,则该晶体的密度为g•cm-312. “太空金属”钛广泛应用于新型功能材料等方面,工业上用钛铁矿(主要成分是TiO2 , 含少量FeO和Fe2O3)冶炼金属钛的工艺流程如图所示,下列说法正确的是
A、Pb2+的价电子排布式为:6s26p2 B、A代表I- C、若原子分数坐标A为(0,0,0),B为( , , ),则C的原子分数坐标为(0, , ) D、已知CH3NH3)PbI3的摩尔质量为Mg·mol-1 , NA为阿伏加德罗常数的值,则该晶体的密度为g•cm-312. “太空金属”钛广泛应用于新型功能材料等方面,工业上用钛铁矿(主要成分是TiO2 , 含少量FeO和Fe2O3)冶炼金属钛的工艺流程如图所示,下列说法正确的是 A、基态钛原子核外有4个未成对电子 B、金属Mg与TiCl4可在氮气气氛条件下进行反应 C、步骤II加热可促进TiO2+的水解 D、步骤III中可能发生的反应为TiO2+2Cl2+CTiCl4+CO13. 砷化镓(GaAs)作为第二代半导体材料的代表,是目前研究最成熟、生产量最大的半导体材料。GaAs晶胞结构如图所示,晶胞边长为apm,下列说法正确的是( )
A、基态钛原子核外有4个未成对电子 B、金属Mg与TiCl4可在氮气气氛条件下进行反应 C、步骤II加热可促进TiO2+的水解 D、步骤III中可能发生的反应为TiO2+2Cl2+CTiCl4+CO13. 砷化镓(GaAs)作为第二代半导体材料的代表,是目前研究最成熟、生产量最大的半导体材料。GaAs晶胞结构如图所示,晶胞边长为apm,下列说法正确的是( )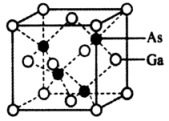 A、GaAs属于离子晶体 B、基态砷原子价电子排布图为
A、GaAs属于离子晶体 B、基态砷原子价电子排布图为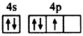 C、As的配位数为4
D、该晶体密度为
C、As的配位数为4
D、该晶体密度为
二、多选题
-
14. 金属钴及其化合物在航天、航空、航海和催化剂等领域发挥着重要的作用。回答下列问题:(1)、基态钴原子的价电子排布式为 , 其最高能层电子云轮廓图为形。(2)、钴能够形成以钴中心原子的多种配位化合物。
①CO分子作为配体时,碳原子和氧原子均能够提供孤电子对。CO与钴形成配位化合物时,提供孤电子对的为原子(填元素名称)。
②高氯酸六氨合钴(II)的结构为
 。其外界离子的空间构型为;下列对[Co(NH3)6]2+的中心原子采取的杂化类型判断合理的是(填标号)。
。其外界离子的空间构型为;下列对[Co(NH3)6]2+的中心原子采取的杂化类型判断合理的是(填标号)。A.sp3 B.sp3d C.sp3d2 D.dsp2
(3)、工业上用CH4处理N2O的化学方程式为:CH4+N2ON2+CH3OH。①写出一种与N2O互为等电子体的阴离子的化学式:。
②CH3OH与水任意比互溶,其原因除与水分子的极性相似外,还有。
(4)、金属钴有两种堆积方式,其晶体结构如图所示。
①甲图所示的堆积方式中,每个晶胞中实际占有的钴原子数为;乙图所示的堆积方式中,晶胞的原子空间利用率为。
②已知:NA为阿伏加德罗常数的值,钴原子半径为r pm。甲图中正六棱柱的高为hpm,则该晶胞的密度为g·cm-3(用含r、h、NA的式子表示,列出计算式即可)。
15. 某蓝色晶体可表示为(x、y、z为正整数),其中M的化合价为+1价,其晶体中阴离子的晶胞结构如图所示(晶胞棱长为a cm,为阿伏加德罗常数的值)。下列说法正确的是( ) A、 B、基态的最外层电子排布式为 C、中含有配位键、极性共价键和离子键 D、阴离子晶胞密度16. M、X、Y、Z、W为原子序数依次增大的短周期主族元素。M、X是形成有机物的主要元素,Y的基态原子的2p能级中含有3个未成对电子,Z的s能级和p能级上的电子总数相等,W是短周期元素中电负性最小的元素。下列说法正确的是( )A、YM3是由极性键构成的极性分子 B、的空间构型为平面三角形 C、M、Y、Z三种元素形成的化合物溶于水均会抑制水的电离 D、工业上采用电解W的氯化物水溶液的方法制取W的单质17. 实验室中常用丁二酮肟来检验Ni2+ , 反应时形成双齿配合物.离子方程式如下:
A、 B、基态的最外层电子排布式为 C、中含有配位键、极性共价键和离子键 D、阴离子晶胞密度16. M、X、Y、Z、W为原子序数依次增大的短周期主族元素。M、X是形成有机物的主要元素,Y的基态原子的2p能级中含有3个未成对电子,Z的s能级和p能级上的电子总数相等,W是短周期元素中电负性最小的元素。下列说法正确的是( )A、YM3是由极性键构成的极性分子 B、的空间构型为平面三角形 C、M、Y、Z三种元素形成的化合物溶于水均会抑制水的电离 D、工业上采用电解W的氯化物水溶液的方法制取W的单质17. 实验室中常用丁二酮肟来检验Ni2+ , 反应时形成双齿配合物.离子方程式如下: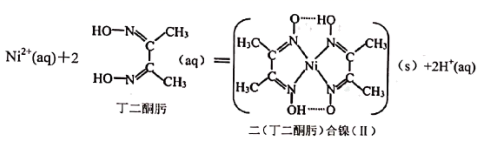
下列说法错误的是( )
A、基态Ni2+的电子排布式为1s22s22p63s23p63d8 B、丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2 C、每个二(丁二酮肟)合镍(II)含有32个σ键 D、二(丁二酮肟)合镍( II )的中心原子的配体数目和配位数均为418. 下列说法错误的是( )A、基态Cr原子有6个未成对电子 B、元素Ga的核外电子排布式为 ,位于元素周期表中p区 C、NH3中N-H键间的键角比CH中C-H键间的键角小 D、XY2分子为V形,则X原子一定为sp2杂化19. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种同位素可用于考古时测定一些文物的年代,Y是短周期中金属性最强的元素,X、Z同主族,Y与W原子的电子数之差等于X原子的最外层电子数。下列说法错误的是( )A、W能形成多种氢化物 B、原子半径: C、X的最高价氧化物的水化物是弱酸 D、简单氢化物的稳定性:20. 下列说法正确的是( )A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 D、SO2、H2O都是由极性键形成的非极性分子21. 下列化学用语的书写正确的是( )A、基态Mg原子的核外电子排布图: B、过氧化氢的电子式:
B、过氧化氢的电子式:  C、As原子的简化电子排布式:[Ar]4s24p3
D、羟基的电子式:
C、As原子的简化电子排布式:[Ar]4s24p3
D、羟基的电子式:  22. 下列元素中,原子最外层电子数与其电子层数相同的有( )A、H B、Na C、Al D、Si
22. 下列元素中,原子最外层电子数与其电子层数相同的有( )A、H B、Na C、Al D、Si三、非选择题
-
23. 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根可看作是中的一个原子被原子取代的产物。(1)、基态原子价层电子排布式是。(2)、比较原子和原子的第一电离能大小,从原子结构的角度说明理由:。(3)、的空间结构是。(4)、同位素示踪实验可证实中两个原子的化学环境不同,实验过程为。过程中,断裂的只有硫硫键,若过程所用试剂是和 , 过程含硫产物是。(5)、的晶胞形状为长方体,边长分别为、 , 结构如图所示。

晶胞中的个数为。已知的摩尔质量是 , 阿伏加德罗常数为 , 该晶体的密度为。
(6)、浸金时,作为配体可提供孤电子对与形成。分别判断中的中心原子和端基原子能否做配位原子并说明理由:。24. 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)、基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为 , 铁的化合价为。(2)、已知一些物质的熔点数据如下表:物质
熔点/℃
800.7
与均为第三周期元素,熔点明显高于 , 原因是。分析同族元素的氯化物、、熔点变化趋势及其原因。的空间结构为 , 其中的轨道杂化形式为。
(3)、一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有个。该物质化学式为 , B-B最近距离为。 25. 【选修3:物质结构与性质】
25. 【选修3:物质结构与性质】含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)、基态S原子的价电子中,两种自旋状态的电子数之比为。(2)、Cu与Zn相比,第二电离能与第一电离能差值更大的是 , 原因是。(3)、SnCl的几何构型为 , 其中心离子杂化方式为。(4)、将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____(填标号)。A、[Cu(NH3)2]Cl B、[Cu(NH3)4]SO4 C、[Zn(NH3)4]SO4 D、Na2[Zn(OH)4](5)、如图是硫的四种含氧酸根的结构:A.
 B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。
(6)、如图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( , , ),则B原子的坐标为。
26. 物质结构理论是材料科学、医学科学和生命科学的重要基础。请回答:(1)、常常作为有机反应的催化剂,画出基态原子的价层电子轨道表示式;要制备高纯可先制得 , 其中C原子的杂化方式为。(2)、乙二酸具有优良的还原性,易被氧化成。测得乙二酸中的的键长比普通的键长要长,说明理由。(3)、下列说法正确的是____。 A、现代化学,常利用原子光谱上特征谱线鉴定元素 B、电负性大于1.8一定是非金属 C、配合物的稳定性不仅与配体有关,还与中心原子的所带电荷等因素有关。 D、晶体的密度为 , 图示晶胞与的距离(4)、锌黄锡矿外观漂亮,晶胞结构如图所示,请写出锌黄锡矿的化学式;并在晶胞中找出平移能完全重合的两个。(请选择合适的编号填写一种组合)
A、现代化学,常利用原子光谱上特征谱线鉴定元素 B、电负性大于1.8一定是非金属 C、配合物的稳定性不仅与配体有关,还与中心原子的所带电荷等因素有关。 D、晶体的密度为 , 图示晶胞与的距离(4)、锌黄锡矿外观漂亮,晶胞结构如图所示,请写出锌黄锡矿的化学式;并在晶胞中找出平移能完全重合的两个。(请选择合适的编号填写一种组合) 27. 是普鲁士蓝类化合物中的一种,可用于钠离子电池的正极材料。晶胞如图所示(未标出)。
27. 是普鲁士蓝类化合物中的一种,可用于钠离子电池的正极材料。晶胞如图所示(未标出)。 (1)、基态Mn原子的外围电子轨道表示式为。(2)、Mn、Fe元素的第三电离能(I3):(填“>”或“<”)。(3)、中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小,从结构角度分析其原因是。其中分子中N原子的杂化类型为。(4)、晶胞中,与形成配位键的元素有。晶胞结构的另一种表示中,若O点处于晶胞体心位置,则晶胞中处于位置。28. 科学工作者合成了含镁、镍、碳、氮4种元素的超导材料,具有良好的应用前景。回答下列问题:(1)、下列属于碳原子激发态轨道表示式的有(填字母,下同),其中失去最外层上一个电子所需能量最低的是。
(1)、基态Mn原子的外围电子轨道表示式为。(2)、Mn、Fe元素的第三电离能(I3):(填“>”或“<”)。(3)、中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小,从结构角度分析其原因是。其中分子中N原子的杂化类型为。(4)、晶胞中,与形成配位键的元素有。晶胞结构的另一种表示中,若O点处于晶胞体心位置,则晶胞中处于位置。28. 科学工作者合成了含镁、镍、碳、氮4种元素的超导材料,具有良好的应用前景。回答下列问题:(1)、下列属于碳原子激发态轨道表示式的有(填字母,下同),其中失去最外层上一个电子所需能量最低的是。 (2)、含有碳元素的有机化合物分布极广,最简单的为碳正离子 , 该离子的几何构型为;乙醇的挥发性比水的强,原因是;如图是叶绿素的结构示意图,配体是一种平面大环有机物,该结构中N原子的杂化方式为 , C-Nσ键有个。
(2)、含有碳元素的有机化合物分布极广,最简单的为碳正离子 , 该离子的几何构型为;乙醇的挥发性比水的强,原因是;如图是叶绿素的结构示意图,配体是一种平面大环有机物,该结构中N原子的杂化方式为 , C-Nσ键有个。 (3)、某种半导体NiO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,半径r(O2-)=anm。
(3)、某种半导体NiO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,半径r(O2-)=anm。
①阿伏加德罗常数的值为NA , 则该晶体密度为g·cm-3.(用含a,NA的表达式表示)。
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,Ni-N键中离子键成分的百分数小于Ni-O键,原因是。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为;N所替代的O的位置可能是。
29.(1)、I.2022年4月,大型运输机运−20向塞尔维亚远程运送“常规军事物资”,展示了大国重器“鲲鹏”的突出性能,为世人瞩目。运−20的外壳大量使用了AM系列Mg−Al−Mn,铝的价电子排布图为 , 第一电离能铝(填“大于”、“等于”或“小于”)镁,镁原子核外有种不同运动状态的电子。
(2)、为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为 , 其个数比为。 (3)、Ⅱ.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。
(3)、Ⅱ.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式。
(4)、图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为 , 其中一个钨原子周围距离最近且相等的碳原子有个。 (5)、已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为M g∙mol−1。该晶体密度为 g∙cm−3。30. 氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。(1)、NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350℃),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
(5)、已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为M g∙mol−1。该晶体密度为 g∙cm−3。30. 氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。(1)、NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350℃),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。①基态氮原子的电子排布图为。
②上述涉及的元素H、B 、C、N、O中电负性最大的是(填元素符号)。
(2)、BF3、NH3和PH3分子中键角由大到小的顺序为。(3)、若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=。(4)、咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:
①上述三种物质中,沸点最高的是(填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是(填“①”或“②” )号氮原子。
(5)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。 (6)、某铁氮化合物晶体的晶胞结构如图所示。
(6)、某铁氮化合物晶体的晶胞结构如图所示。
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
31. 奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:(1)、5G芯片主要材质是高纯硅。基态原子的电子排布式为;该原子价层电子的运动状态有种。(2)、硅元素能够形成多种化合物,其中,沸点:(填“>”或“<”),原因是。(3)、复兴号高铁车体材质用到等元素。①的一种配合物的化学式为 , 其中原子的配位数为 , 中C原子的杂化类型为。
②均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
元素
电离能
717
759
1509
1561
3248
2957
锰元素位于第四周期第VIIB族。比较两元素的 , 可知,气态再失去1个电子比气态再失去1个电子难,对此你的解释是。
(4)、时速的磁浮列车需用到超导材料。超导材料具有型结构(如图),晶胞参数(晶胞边长)为 , 其中阴离子采用面心立方最密堆积方式,该氮化钛的密度(列出计算式即可)。 32. 金属及其化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题:(1)、与Fe最外层电子数相同且同周期的过渡元素有种。(2)、次磷酸的正盐KH2PO2中P的杂化轨道与O的轨道形成键。(3)、Zn、Fe、Cu等过渡金属的原子或离子易通过配位键形成配合物或配离子。
32. 金属及其化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题:(1)、与Fe最外层电子数相同且同周期的过渡元素有种。(2)、次磷酸的正盐KH2PO2中P的杂化轨道与O的轨道形成键。(3)、Zn、Fe、Cu等过渡金属的原子或离子易通过配位键形成配合物或配离子。①
 和
和 中所有原子均共面,其中氮原子较易形成配位键的是。
中所有原子均共面,其中氮原子较易形成配位键的是。②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3 , 配体SCN-中提供孤电子对的原子是(填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
(4)、硫化锌(ZnS)晶体属于六方晶系,Zn原子位于4个S原子形成的正四面体空隙中。晶胞参数如图所示α=120°,β=γ=90°。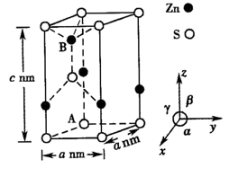
①该晶体中,锌的配位数为。
②已知空间利用率 , 设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为。
33. 锌在工业中有重要作用,也是人体必须的微量元素。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图所示:
回答下列问题:
(1)、Zn基态原子核外电子排布式 。(2)、碳酸酐酶的部分结构中与Zn2+配位的原子是(填元素符号) ;该物质中碳原子的轨道杂化类型是;与H2O互为等电子体的一 种微粒为(填化学式)。(3)、黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能I1(Zn)I1(Cu)(填“大于”或“小于”),原因是。(4)、Zn(NO3)2 中除了含有离子键以外还含有____。A、氢键 B、σ键 C、π键 D、非极性共价键(5)、立方硫化锌晶胞如图所示,该晶体中Zn2+的配位数为; 设晶胞中S离子与其最近的Zn离子的距离为d nm,其密度为ρ g·cm-3 , 阿伏加德罗常数NA为 (用含d、ρ的式子表示)。 34. 铬(Cr)及其化合物用途广泛。请回答:(1)、基态铬原子的价层电子排布式 , 属于周期表的区。同周期的基态原子中,与Cr最高能层电子数相同的还有(写元素符号)。(2)、的三种结构:①、②、③ , 下列说法正确的是____。A、①②③中Cr的配位数都是6 B、①中配合离子空间结构为
34. 铬(Cr)及其化合物用途广泛。请回答:(1)、基态铬原子的价层电子排布式 , 属于周期表的区。同周期的基态原子中,与Cr最高能层电子数相同的还有(写元素符号)。(2)、的三种结构:①、②、③ , 下列说法正确的是____。A、①②③中Cr的配位数都是6 B、①中配合离子空间结构为 或
或 (已略去位于正八面体中心的Cr)
C、②中存在的化学键有离子键、共价键、配位键和氢键
D、等物质的量的①②③分别与足量溶液反应,得到AgCl物质的量也相等
(3)、对配合物进行加热时,配体比更容易失去,请解释原因。(4)、铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为 , 阿伏加德罗常数为 , 则晶胞中Cr原子之间的最近核间距为pm(写出表达式即可)。
(已略去位于正八面体中心的Cr)
C、②中存在的化学键有离子键、共价键、配位键和氢键
D、等物质的量的①②③分别与足量溶液反应,得到AgCl物质的量也相等
(3)、对配合物进行加热时,配体比更容易失去,请解释原因。(4)、铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为 , 阿伏加德罗常数为 , 则晶胞中Cr原子之间的最近核间距为pm(写出表达式即可)。 35. 高纯度六氟磷酸锂()是锂离子电池的常用电解液锂盐。HF合成高纯的绿色低温工艺如下。
35. 高纯度六氟磷酸锂()是锂离子电池的常用电解液锂盐。HF合成高纯的绿色低温工艺如下。 (1)、中基态的电子排布式为 , 中P原子上的孤电子对数为。(2)、反应釜1中生成的在反应釜2中转化为LiF沉淀,其反应的离子方程式为。本工艺未采用(工业级)与氢氟酸直接反应制备LiF的原因是。(3)、为提高原料的利用率,本工艺将反应釜4与5串联。向反应釜4和5中加入LiF溶液后,将反应釜3中生成的气体通入反应釜5中,发生反应得到 , 其化学反应方程式为;再将剩余的气体通入反应釜4中发生反应,尾气经水吸收得到的主要副产品是。(4)、遇水易发生水解反应,生成等,其化学反应方程式为。(5)、某温度下, , 不考虑水解,饱和水溶液中的浓度为mol/L。
(1)、中基态的电子排布式为 , 中P原子上的孤电子对数为。(2)、反应釜1中生成的在反应釜2中转化为LiF沉淀,其反应的离子方程式为。本工艺未采用(工业级)与氢氟酸直接反应制备LiF的原因是。(3)、为提高原料的利用率,本工艺将反应釜4与5串联。向反应釜4和5中加入LiF溶液后,将反应釜3中生成的气体通入反应釜5中,发生反应得到 , 其化学反应方程式为;再将剩余的气体通入反应釜4中发生反应,尾气经水吸收得到的主要副产品是。(4)、遇水易发生水解反应,生成等,其化学反应方程式为。(5)、某温度下, , 不考虑水解,饱和水溶液中的浓度为mol/L。