高考二轮复习知识点:原子中的数量关系2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 反应 可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )A、中子数为9的氮原子: B、N2分子的电子式: C、Cl2分子的结构式:Cl-Cl D、Cl-的结构示意图:
 2. 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )A、中子数为18的氯原子: B、N2的结构式:N=N C、Na+的结构示意图:
2. 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )A、中子数为18的氯原子: B、N2的结构式:N=N C、Na+的结构示意图: D、H2O的电子式:
D、H2O的电子式: 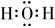 3. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油是可再生能源 B、 燃烧过程中热能转化为化学能 C、火星陨石中的 质量数为20 D、月壤中的 与地球上的 互为同位素4. 下列分子中,其中子总数为24的是( )A、18O3 B、2H217O2 C、14N16O2 D、14C16O25. 等物质的量的氢化锂(7LiH)、氘化锂(7LiD)、氚化锂(7LiT),肯定不同的是( )A、质子数 B、中子数 C、化学键类型 D、化学性质6. 下列化学用语正确的是( )A、碳-14原子表示为:14C B、CH4的比例模型
3. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油是可再生能源 B、 燃烧过程中热能转化为化学能 C、火星陨石中的 质量数为20 D、月壤中的 与地球上的 互为同位素4. 下列分子中,其中子总数为24的是( )A、18O3 B、2H217O2 C、14N16O2 D、14C16O25. 等物质的量的氢化锂(7LiH)、氘化锂(7LiD)、氚化锂(7LiT),肯定不同的是( )A、质子数 B、中子数 C、化学键类型 D、化学性质6. 下列化学用语正确的是( )A、碳-14原子表示为:14C B、CH4的比例模型 C、醋酸钠的分子式:CH3COONa
D、二氧化碳的结构式 O—C—O
7. 下列化学用语中正确的是( )A、Fe3+的最高能层电子排布式为3d5 B、质量数为127的碘原子: C、S2-的结构示意图:
C、醋酸钠的分子式:CH3COONa
D、二氧化碳的结构式 O—C—O
7. 下列化学用语中正确的是( )A、Fe3+的最高能层电子排布式为3d5 B、质量数为127的碘原子: C、S2-的结构示意图: D、反-2-丁烯的结构简式:
D、反-2-丁烯的结构简式:  8. 利用反应4NH3+COCl2= CO(NH2)2+2NH4Cl可去除COCl2污染。下 列说法正确的是( )A、中子数为10的氧原子 O B、NH3的电子式为
8. 利用反应4NH3+COCl2= CO(NH2)2+2NH4Cl可去除COCl2污染。下 列说法正确的是( )A、中子数为10的氧原子 O B、NH3的电子式为 C、COCl2 是极性分子
D、CO(NH2)2含离子键和共价键
9. 反应Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脱氯。下列相关微粒的说法正确的是( )A、中子数为20的氯原子: Cl B、H2O的电子式:
C、COCl2 是极性分子
D、CO(NH2)2含离子键和共价键
9. 反应Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脱氯。下列相关微粒的说法正确的是( )A、中子数为20的氯原子: Cl B、H2O的电子式: C、Na+的结构示意图:
C、Na+的结构示意图:  D、SO 的空间构型为平面三角形
10. 下列化学用语正确的是( )A、中子数为18的硫原子:18S B、H2S的比例模型:
D、SO 的空间构型为平面三角形
10. 下列化学用语正确的是( )A、中子数为18的硫原子:18S B、H2S的比例模型: C、H2O的结构式:H-O-H
D、CH3Cl的电子式为:
C、H2O的结构式:H-O-H
D、CH3Cl的电子式为:  11. 下列有关化学用语表述正确的是( )A、中子数为16的硫原子: S B、还原性:Na<Mg C、CO2的电子式:
11. 下列有关化学用语表述正确的是( )A、中子数为16的硫原子: S B、还原性:Na<Mg C、CO2的电子式: D、Al3+的结构示意图:
D、Al3+的结构示意图:  12. 我国学者发明了一种低压高效电催化还原CO2的新方法,其原理可以表示为:NaCl+CO2CO+NaClO,下列有关化学用语表示正确的是( )A、中子数为12的钠离子: B、NaClO的电子式:
12. 我国学者发明了一种低压高效电催化还原CO2的新方法,其原理可以表示为:NaCl+CO2CO+NaClO,下列有关化学用语表示正确的是( )A、中子数为12的钠离子: B、NaClO的电子式: C、CO2的比例模型:
C、CO2的比例模型: D、CO晶体模型:
D、CO晶体模型: 13. 下列表述不正确的是( )A、原子轨道能量:1s<2s<3s<4s B、M电子层存在3个能级、9个原子轨道 C、4s电子能量较高,总是在比3s电子离核更远的地方运动 D、同一周期,碱金属元素的第一电离能最小,最容易失电子14. 铋可改善钢的加工性能。周期表中铋与砷同主族,其最稳定的同位素是。下列说法不正确的是( )A、是第六周期元素 B、的中子数是126 C、的原子半径比的小 D、和具有相同的电子数15. “嫦娥五号”采回的月壤中含有的是一种清洁、安全的核聚变发电燃料。下列有关说法正确的是( )A、核聚变属于化学变化 B、之间通过共价键形成单质分子 C、发电代替火电有利于实现碳达峰 D、等物质的量的与所含中子数相等16. 工业上通过Al2O3+N2+3C2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是( )A、N2的电子式为:
13. 下列表述不正确的是( )A、原子轨道能量:1s<2s<3s<4s B、M电子层存在3个能级、9个原子轨道 C、4s电子能量较高,总是在比3s电子离核更远的地方运动 D、同一周期,碱金属元素的第一电离能最小,最容易失电子14. 铋可改善钢的加工性能。周期表中铋与砷同主族,其最稳定的同位素是。下列说法不正确的是( )A、是第六周期元素 B、的中子数是126 C、的原子半径比的小 D、和具有相同的电子数15. “嫦娥五号”采回的月壤中含有的是一种清洁、安全的核聚变发电燃料。下列有关说法正确的是( )A、核聚变属于化学变化 B、之间通过共价键形成单质分子 C、发电代替火电有利于实现碳达峰 D、等物质的量的与所含中子数相等16. 工业上通过Al2O3+N2+3C2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是( )A、N2的电子式为: B、AlN是分子晶体
C、27Al用原子中的中子数为14
D、基态氮原子轨道表示式:
B、AlN是分子晶体
C、27Al用原子中的中子数为14
D、基态氮原子轨道表示式: 17. 工业合成尿素的原理:CO2+2NH3CO(NH2)2+H2O,有关化学用语表示正确的是( )A、中子数为8的碳原子:8C B、NH3的电子式:
17. 工业合成尿素的原理:CO2+2NH3CO(NH2)2+H2O,有关化学用语表示正确的是( )A、中子数为8的碳原子:8C B、NH3的电子式: C、氧原子的核外电子轨道表示式:
C、氧原子的核外电子轨道表示式: D、CO(NH2)2的结构简式:
D、CO(NH2)2的结构简式: 18. 自年福岛核电站泄漏以来,日本核污水即将蓄满,日本政府最近打算将其排放入海,引起了全世界人民的恐慌。据悉,福岛核电站受损以来,一直在对核污水进行处理,其中氚很难被清除,此次拟排放的废水中主要污染物为氚,下列与氚有关说法中正确的是( )A、氚是核反应产生的一种新元素 B、氚与氕、氘互为同位素 C、超重水T216O分子中的中子总数为 D、、、互为同分异构体19. 下列化学用语表示错误的是( )A、原子核内有8个中子的碳原子: B、乙烯的结构简式:CH2CH2 C、羟基的电子式:
18. 自年福岛核电站泄漏以来,日本核污水即将蓄满,日本政府最近打算将其排放入海,引起了全世界人民的恐慌。据悉,福岛核电站受损以来,一直在对核污水进行处理,其中氚很难被清除,此次拟排放的废水中主要污染物为氚,下列与氚有关说法中正确的是( )A、氚是核反应产生的一种新元素 B、氚与氕、氘互为同位素 C、超重水T216O分子中的中子总数为 D、、、互为同分异构体19. 下列化学用语表示错误的是( )A、原子核内有8个中子的碳原子: B、乙烯的结构简式:CH2CH2 C、羟基的电子式: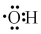 D、硫离子的结构示意图:
D、硫离子的结构示意图: 20. 下列化学用语描述正确的是( )A、CCl4的球棍模型:
20. 下列化学用语描述正确的是( )A、CCl4的球棍模型: B、
B、 的名称:3-乙基-1,3-丁二烯
C、氦-3的符号:
D、次氯酸的结构式:H-Cl-O
21. 近期,中国科学家在实验室中首次实现从二氧化碳到淀粉的全合成,其路径如图所示。下列表示相关微粒的化学用语正确的是( )
的名称:3-乙基-1,3-丁二烯
C、氦-3的符号:
D、次氯酸的结构式:H-Cl-O
21. 近期,中国科学家在实验室中首次实现从二氧化碳到淀粉的全合成,其路径如图所示。下列表示相关微粒的化学用语正确的是( ) A、分子的电子式:
A、分子的电子式: B、图中(甲醇)的结构式:
C、中子数为8的碳原子:
D、的结构示意图:
B、图中(甲醇)的结构式:
C、中子数为8的碳原子:
D、的结构示意图: 22. 科学家在对原子结构进行分析研究时,用中子( )轰击金属原子 ,得到核素 和 H: 。元素Y的原子半径在短周期元素中最大。下列叙述错误的是( )A、 的质量数为23 B、Y的常见氧化物有Y2O、Y2O2 C、X的最高价氧化物对应水化物的碱性比Y的强 D、工业上通过电解熔融X或Y的氯化物来制取单质X或Y23. 下列说法错误的是( )A、将地沟油转化为生物柴油是发生了取代反应 B、 、 与 三种微粒中质子数和电子数均相同 C、碘单质与 固体混合物不可用加热的方法分离 D、1L0.3mol/LNaClO溶液中含有的 数目小于24. NF3是一种优良的蚀刻气体。HF、F2均可用于制备NF3 , F2制备NF3的反应为4NH3+3F2 NF3+3NH4F.Ka(HF)=6.3×10−4 , Kb(NH3·H2O)=1.8×10−5。下列说法正确的是( )A、中子数为10的氟原子: F B、HF的电子式:
22. 科学家在对原子结构进行分析研究时,用中子( )轰击金属原子 ,得到核素 和 H: 。元素Y的原子半径在短周期元素中最大。下列叙述错误的是( )A、 的质量数为23 B、Y的常见氧化物有Y2O、Y2O2 C、X的最高价氧化物对应水化物的碱性比Y的强 D、工业上通过电解熔融X或Y的氯化物来制取单质X或Y23. 下列说法错误的是( )A、将地沟油转化为生物柴油是发生了取代反应 B、 、 与 三种微粒中质子数和电子数均相同 C、碘单质与 固体混合物不可用加热的方法分离 D、1L0.3mol/LNaClO溶液中含有的 数目小于24. NF3是一种优良的蚀刻气体。HF、F2均可用于制备NF3 , F2制备NF3的反应为4NH3+3F2 NF3+3NH4F.Ka(HF)=6.3×10−4 , Kb(NH3·H2O)=1.8×10−5。下列说法正确的是( )A、中子数为10的氟原子: F B、HF的电子式: C、NF3的空间构型为平面正三角形
D、第一电离能:I1(F)>I1(N)>I1(O)
C、NF3的空间构型为平面正三角形
D、第一电离能:I1(F)>I1(N)>I1(O)
二、多选题
-
25. 用NA表示阿伏加德罗常数的值。下列说法正确的是A、1.9gH3O+中含有的质子数为NA B、53.5gNH4Cl中含有的共价键数目为4NA C、1molCu与足量S充分反应,转移的电子数为NA D、标准状况下,22.4LCl2溶于足量水中得到HClO的数目为NA
三、非选择题
-
26. 已知A、B、C、D、E都是短周期的主族元素,原子序数依次增大,其中A是空气中含量最多的元素,C是短周期中原子半径最大的元素,C与B可形成C2B和C2B2两种物质,E是地壳中含量最多的金属元素。请回答下列问题:(1)、①A在元素周期表中的位置。
②上述元素的最高价氧化物对应的水化物中碱性最强的是(填化学式)。
③写出C2B2的电子式。
(2)、C、D、E三种元素对应的简单离子的半径由大到小的顺序是(填离子符号)。(3)、写出单质E与 溶液反应的离子方程式。27. 汽车尾气(NOx、CO、烃等)是造成雾霾的主要元凶。(1)、N与H可以组成一种18电子的分子,该分子的化学式为 , 其中N元素的化合价。(2)、已知反应NO2(g)+CO(g)⇌NO(g)+CO2(g),其反应的能量变化示意图为:
根据能量变化示意图,则该反应为(填“放热”或“吸热”)反应。
(3)、已知反应2NO(g)+O2(g)⇌2NO2(g)的正反应速率方程为v=kcm(O2)•cn(NO),k只与温度有关,一定温度下测得数据如下表:c(NO)/mol•L-1
c(O2)/mol•L-1
v/mol•L-1·s-1
1.0×10-4
1.0×10-4
2.8×10-5
1.0×10-4
3.0×10-4
8.4×10-5
2.0×10-4
3.0×10-4
3.36×10-4
该反应速率方程中m= , n=(m,n为自然数或简单分数)。
(4)、在2L恒容的密闭容器中,充入一定量的NO和O2发生反应2NO(g)+O2(g)⇌2NO2(g),其中氮的氧化物的物质的量(n)随时间(t/min)的变化曲线如图所示。
①图像中曲线Ⅰ表示的变化。
②0~10min内,用O2表示该反应的平均速率为。
③当达到平衡时,NO的转化率为。
28. 有A,B,C,D,E,F 六种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6 L H2 , E的阳离子与A的阴离子核外电子层结构完全相同,F原子半径在短周期元素中最大,回答下列问题: (1)、元素的名称:B;(2)、画出C离子的结构示意图:;(3)、写出D元素在周期表中的位置:;D元素的单质可用于制漂白液和漂白粉,写出制漂白液的离子方程式: , 漂白粉的有效成分是;(4)、B的同族上一周期元素的氢化物为(化学式) ,实验室制取该物质的方程式为 , 制取该气体时用做干燥剂。29. 阅读下面短文.
(1)、元素的名称:B;(2)、画出C离子的结构示意图:;(3)、写出D元素在周期表中的位置:;D元素的单质可用于制漂白液和漂白粉,写出制漂白液的离子方程式: , 漂白粉的有效成分是;(4)、B的同族上一周期元素的氢化物为(化学式) ,实验室制取该物质的方程式为 , 制取该气体时用做干燥剂。29. 阅读下面短文.原子核究竟是什么形状的?
你也许会说,原子核应该是球形的吧.没错,对于大多数的原子而言,它们的原子核都是球形(如图1)或者比较接近球形的椭球形,就像橄榄球一样(如图2).但是,科学家也发现极少数的原子核中的质子和中子会聚集成罕见的梨形(如图3).

要想验证原子核是否为梨形,最直接的方法就是寻找不同核状态间的八极形变(octupole transition),这是梨形结构原子核特有的现象.利用这一手段,研究人员先后确认了224Ra、226Ra及其他一些重原子核均为梨形的,但一直没有发现质量数小于200的梨形原子核.
近日,来自美国、英国和法国的一组科研团队制备了144Ba原子束,使其与铅箔发生碰撞并进入激发态.通过分析原子核产生的伽马射线光谱,研究人员发现几次八极形变的强度是核结构模型中预测数值的两倍多.由此,确认了144Ba的原子核也是梨形的.
请回答下列问题:
(1)、224Ra原子核的形状是 .(2)、224Ra和226Ra可以互称为 .(3)、Ba元素的原子序数是56,则144Ba原子核中的中子数是 .(4)、科学家确认144Ba的原子核是梨形的,其根据是(填序号).a.直接观察了144Ba原子核的形状
b.由核结构模型做出的理论计算
c.发现了八极形变现象.
30. 用表示原子:(1)、中性原子的中子数N=。(2)、共有x个电子,则该阳离子的中子数N=。(3)、共有x个电子,则该阴离子的中子数N=。31.(1)、现有14.4gCO和CO2的混合气体,在标准状况下所占的体积约为8.96L,该混合气体的平均摩尔质量为。(2)、将上述混合气体依次通过如图装置,最后收集在气球中。
①标准状况下,气球中收集到的气体的体积为。
②气球中收集到的气体所含的电子总数为。(阿伏加德罗常数用NA表示)
32. 按要求完成下列有关题目:(1)、下列物质①6gH2、②0.5molCO2、③1.204×1024 个 HCl 分子、④4℃ 时 27mL 水。它们的物质的量最大的是(填序号,下同),所含分子数最多的是 , 所含原子数最多的是 , 质量最小的是。(2)、4.8gCH4中所含氢原子数与g 水所含氢原子数相等。(3)、写出下列反应的化学反应方程式:①少量 NaHCO3 和 Ca(OH)2
②Ba(OH)2和 NaHSO4恰好沉淀
(4)、写出焰色试验中相应元素的颜色:①钠②钾③钡④铜33. CO2的减排已引起国际社会的广泛关注。近日,中科院大连化物所用一种双金属固溶体氧化物催化剂,实现了CO2合成甲醇(CH3OH),原理示意图如下: (1)、16g CH3OH的物质的量是 , 含H原子的数目为。(2)、0.2mol H2O中含电子总物质的量为。(3)、标准状况下,H2与CO2混合气体的总质量为9.0g,n(H2):n(CO2)=1:2。
(1)、16g CH3OH的物质的量是 , 含H原子的数目为。(2)、0.2mol H2O中含电子总物质的量为。(3)、标准状况下,H2与CO2混合气体的总质量为9.0g,n(H2):n(CO2)=1:2。①CO2的质量是。
②H2的体积是。
③混合气体的平均摩尔质量为。
34. 同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,11.6 g B的氢氧化物恰好能与200 mL 2 mol/L盐酸完全反应,B原子核中质子数与中子数相等。回答以下问题:(1)、B的相对原子质量是多少?原子序数是多少?(2)、A和C各是什么元素?(3)、A、B、C的单质各1 mol分别与足量的稀硫酸反应,产生H2最多的是哪一种单质?该单质产生H2的体积在标准状况下是多少?35.(1)、在 H、 H、 H、 Mg、 Mg和 Cu中共有种元素,种原子,中子数最多的是。(2)、α射线是由α粒子组成的,α粒子是一种没有核外电子的粒子,它带有2个单位正电荷,它的质量数等于4,由此推断α粒子带有个质子,个中子。
-