高考二轮复习知识点:原子中的数量关系1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式:
 C、的空间结构:
C、的空间结构: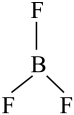 (平面三角形)
D、的形成过程:
(平面三角形)
D、的形成过程: 2. (锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法错误的是( )A、位于元素周期表中第六周期、第ⅡA族 B、可用质谱法区分和 C、和含有的中子数分别为49和48 D、同一地域产出的同种土壤生物中值相同3. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为2 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定4. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )
2. (锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法错误的是( )A、位于元素周期表中第六周期、第ⅡA族 B、可用质谱法区分和 C、和含有的中子数分别为49和48 D、同一地域产出的同种土壤生物中值相同3. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为2 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定4. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )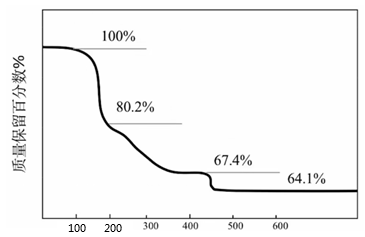 A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物5. 下列有关放射性核素氚( H)的表述错误的是( )A、 H原子核外电子数为1 B、 H原子核内中子数为3 C、 与H2化学性质基本相同 D、 具有放射性6. 镅(Am)用于高铁车厢的烟雾传感器。下列关于Am的说法错误的是A、中子数为146 B、质量数为241 C、质子数为95 D、电子数为1467. 下列有关化学用语表示正确的是A、氟原子的结构示意图:
A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物5. 下列有关放射性核素氚( H)的表述错误的是( )A、 H原子核外电子数为1 B、 H原子核内中子数为3 C、 与H2化学性质基本相同 D、 具有放射性6. 镅(Am)用于高铁车厢的烟雾传感器。下列关于Am的说法错误的是A、中子数为146 B、质量数为241 C、质子数为95 D、电子数为1467. 下列有关化学用语表示正确的是A、氟原子的结构示意图: B、质子数为53中子数为78的碘原子:
C、硫化钠的电子式:
B、质子数为53中子数为78的碘原子:
C、硫化钠的电子式: D、明矾的化学式:Al2(SO4)3
8. 下列化学用语表示正确的是A、中子数为16的磷原子: B、羟基的电子式:
D、明矾的化学式:Al2(SO4)3
8. 下列化学用语表示正确的是A、中子数为16的磷原子: B、羟基的电子式: C、的VSEPR模型:
C、的VSEPR模型: (平面三角形)
D、基态最高能级的电子云轮廓图:
(平面三角形)
D、基态最高能级的电子云轮廓图: 9. 下列化学用语使用正确的是A、H2O的VSEPR模型:
9. 下列化学用语使用正确的是A、H2O的VSEPR模型: B、次氯酸的电子式:
B、次氯酸的电子式: C、中子数为20的硫原子:S
D、乙醛的结构简式:CH3COH
10. 工业焊接钢管时常用进行“无损探伤”,该原子( )A、质子数是82 B、中子数是55 C、与互为同位素 D、摩尔质量是13711. 氯水中存在:Cl2+H2OHCl+HClO,下列化学用语表达正确的是( )A、中子数为20的氯原子:35Cl B、HCl的电子式:
C、中子数为20的硫原子:S
D、乙醛的结构简式:CH3COH
10. 工业焊接钢管时常用进行“无损探伤”,该原子( )A、质子数是82 B、中子数是55 C、与互为同位素 D、摩尔质量是13711. 氯水中存在:Cl2+H2OHCl+HClO,下列化学用语表达正确的是( )A、中子数为20的氯原子:35Cl B、HCl的电子式: C、HClO的比例模型:
C、HClO的比例模型: D、氧原子核外电子轨道表示式:
D、氧原子核外电子轨道表示式: 12. 下列指定微粒或化学键的个数比为1:2的是A、C原子中的质子和中子 B、Na2O2固体中的阴离子和阳离子 C、SiO2晶体中的硅原子和共价键 D、FeCl2溶液中的Fe2+和Cl-13. 下列有关化学用语表示正确的是A、乙醚的结构简式: B、HClO的电子式:
12. 下列指定微粒或化学键的个数比为1:2的是A、C原子中的质子和中子 B、Na2O2固体中的阴离子和阳离子 C、SiO2晶体中的硅原子和共价键 D、FeCl2溶液中的Fe2+和Cl-13. 下列有关化学用语表示正确的是A、乙醚的结构简式: B、HClO的电子式: C、质子数为17、中子数为20的氯原子:
D、的空间结构:V形
14. 下列化学用语表示正确的是A、中子数为8的O原子: B、羟基的电子式:
C、质子数为17、中子数为20的氯原子:
D、的空间结构:V形
14. 下列化学用语表示正确的是A、中子数为8的O原子: B、羟基的电子式: C、乙醇分子的比例模型:
C、乙醇分子的比例模型: D、碳原子核外价电子的轨道式:
D、碳原子核外价电子的轨道式: 15. 化学用语具有简便表达化学知识与化学思维的特点。下列化学用语表述正确的是A、异丁烷的结构简式:
15. 化学用语具有简便表达化学知识与化学思维的特点。下列化学用语表述正确的是A、异丁烷的结构简式: B、醛基的电子式:
B、醛基的电子式: C、质子数为78,中子数为124的铂(Pt)的原子符号:
D、原子序数为31的镓原子结构示意图:
C、质子数为78,中子数为124的铂(Pt)的原子符号:
D、原子序数为31的镓原子结构示意图: 16. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、0.2 mol苯甲醇完全燃烧,生成的CO2数目为1.4NA B、1 L0.5 mol·L-1 NaHCO3溶液中含有数目为0.5NA C、56g Fe与1 mol Cl2充分反应时转移的电子数为3NA D、1 mol 中含有电子数为10NA17. 高能粒子是第一个成功观测到双衰变现象的原子核,其双衰变的方程式。下列说法正确的是A、和互为同位素 B、和的中子数相等 C、次外层电子数为8 D、双衰变放出能量18. 设为阿伏加德罗常数的值.下列说法正确的是A、常温下,的溶液中,由水电离出的数目为 B、重水中所含质子数、中子数各为 C、标准状况下,中数目为 D、和于密闭容器中充分反应后,分子数为19. 反应COCl2+4NH3=CO(NH2)2+2NH4Cl可除去COCl2(
16. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、0.2 mol苯甲醇完全燃烧,生成的CO2数目为1.4NA B、1 L0.5 mol·L-1 NaHCO3溶液中含有数目为0.5NA C、56g Fe与1 mol Cl2充分反应时转移的电子数为3NA D、1 mol 中含有电子数为10NA17. 高能粒子是第一个成功观测到双衰变现象的原子核,其双衰变的方程式。下列说法正确的是A、和互为同位素 B、和的中子数相等 C、次外层电子数为8 D、双衰变放出能量18. 设为阿伏加德罗常数的值.下列说法正确的是A、常温下,的溶液中,由水电离出的数目为 B、重水中所含质子数、中子数各为 C、标准状况下,中数目为 D、和于密闭容器中充分反应后,分子数为19. 反应COCl2+4NH3=CO(NH2)2+2NH4Cl可除去COCl2( )污染。下列说法 正确的是( ) A、COCl2是极性分子 B、NH3电子式:
)污染。下列说法 正确的是( ) A、COCl2是极性分子 B、NH3电子式: C、COCl2中含有非极性键
D、中子数为18的Cl原子:18Cl
20. 下列化学用语描述或图示表达正确的是( )A、原子结构示意图
C、COCl2中含有非极性键
D、中子数为18的Cl原子:18Cl
20. 下列化学用语描述或图示表达正确的是( )A、原子结构示意图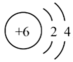 , 可以表示和
B、中子数为127的碘原子:
C、过氧化氢的比例模型:
, 可以表示和
B、中子数为127的碘原子:
C、过氧化氢的比例模型: D、NaClO的电子式:
D、NaClO的电子式: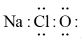 21. 下列表示正确的是( )A、MgH2的电子式
21. 下列表示正确的是( )A、MgH2的电子式 B、2,2—二甲基戊烷的键线式:
B、2,2—二甲基戊烷的键线式: C、中子数为18的氯原子:Cl
D、
C、中子数为18的氯原子:Cl
D、 的实验式:C5H9
22. 基因测序研究中,常用P作标记物,下列关于P的说法正确的是( )A、质子数为32 B、质量数为15 C、与互为同位素 D、中子数为1523. 反应Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脱氯。下列说法正确的是( )A、中子数为20的氯原子:Cl B、H2O分子中含极性共价键 C、Na+的结构示意图:
的实验式:C5H9
22. 基因测序研究中,常用P作标记物,下列关于P的说法正确的是( )A、质子数为32 B、质量数为15 C、与互为同位素 D、中子数为1523. 反应Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脱氯。下列说法正确的是( )A、中子数为20的氯原子:Cl B、H2O分子中含极性共价键 C、Na+的结构示意图: D、HCl的电子式:
D、HCl的电子式: 24. 下列说法正确的是( )A、氰酸铵[NH4OCN]和尿素[CO(NH2)2]互为同分异构体 B、乳酸 (C3H6O3)与葡萄糖(C6H12O6)的最简式相同,它们互为同系物 C、同素异形体由相同元素组成,其晶体类型相同 D、核内中子数为N的 , 质量数为A,则的核外电子数为:25. 硼酸和乙醇可以发生酯化反应:B(OH)3+3C2H5OH (C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是( )A、中子数为8的O原子: B、乙醇分子的比例模型:
24. 下列说法正确的是( )A、氰酸铵[NH4OCN]和尿素[CO(NH2)2]互为同分异构体 B、乳酸 (C3H6O3)与葡萄糖(C6H12O6)的最简式相同,它们互为同系物 C、同素异形体由相同元素组成,其晶体类型相同 D、核内中子数为N的 , 质量数为A,则的核外电子数为:25. 硼酸和乙醇可以发生酯化反应:B(OH)3+3C2H5OH (C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是( )A、中子数为8的O原子: B、乙醇分子的比例模型: C、基态C原子核外价电子的轨道表达式:
C、基态C原子核外价电子的轨道表达式: D、硼酸在水中的电离方程式:B(OH)3+H2O=B(OH)+H+
D、硼酸在水中的电离方程式:B(OH)3+H2O=B(OH)+H+
二、多选题
-
26. 设 表示阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的中子数目为 B、密闭容器中1molHI分解后,容器内分子数目为 C、 与K充分反应转移的电子数目为 D、1L 稀硝酸中含有的氢离子数目为27. 反应2NH3+3Cl2=6HCl+N2 , NH3+HCl=NH4Cl(白烟)可用于氯气管道泄漏的检查。下列表示反应中的相关微粒的化学用语正确的是( )A、氯离子的结构示意图:
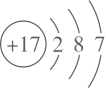 B、HCl的电子式:
B、HCl的电子式: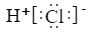 C、中子数为20的氯原子:
D、氮气的结构式:
28. 下列叙述正确的是( )A、1H和2H是不同的核素,它们的质子数相同 B、6Li和7Li的质子数相等,电子数也相等 C、14C和14N的质量数相等,中子数相等 D、13C和14C属于同一种元素,它们质量数相等29. 下列各组微粒中,质子数和电子数均相等的是( )A、Na+和He B、H2O和D2O C、NH4+和NH3 D、H2SO4和H3PO4
C、中子数为20的氯原子:
D、氮气的结构式:
28. 下列叙述正确的是( )A、1H和2H是不同的核素,它们的质子数相同 B、6Li和7Li的质子数相等,电子数也相等 C、14C和14N的质量数相等,中子数相等 D、13C和14C属于同一种元素,它们质量数相等29. 下列各组微粒中,质子数和电子数均相等的是( )A、Na+和He B、H2O和D2O C、NH4+和NH3 D、H2SO4和H3PO4三、非选择题
-
30. 开发利用核能可以减少对化石能源的依赖。UO2是一种常用的核燃料,其铀元素中 需达到5%。该核燃料的一种制备流程如下:(1)、天然铀主要含99.3% 和0.7% , 和 互为。(2)、I中,将含有硫酸的UO2SO4溶液通入电解槽,如下图所示。

①A电极是(填“阴极”或“阳极”),其电极反应式是。
②U4+有较强的还原性。用质子交换膜隔开两极区溶液可以 , 从而提高U4+的产率。
(3)、III中使用的F2可通过电解熔融KF、HF混合物制备,不能直接电解液态HF的理由是HF属于化合物,液态HF几乎不电离。(4)、IV中利用了相对分子质量对气体物理性质的影响。铀的氟化物的熔沸点如下:UF4
UF6
熔点/℃
1036
64(150kPa)
沸点/℃
1417
56.5升华
①离心富集 时,采用UF6的优点:
a.F只有一种核素 ,且能与U形成稳定的氟化物;
b.。
② 和 的相对分子质量之比约为(列出计算表达式)。
31. 第四周期中某些元素的相关化合物在化工、医药、材料等领域有着广泛应用(1)、现代化学中,常利用上的特征谱线来鉴定元素。Ga的外围电子排布式为: , 基态Ga原子核外有种运动状态不同的电子。(2)、锗、砷、硒、溴的第一电离能由大到小的顺序为(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为 , 中心原子的杂化类型为;砷酸的酸性弱于硒酸,从分子结构的角度解释原因。(3)、铁能形成[Fe(Bipy)2Cl2]ClO4等多种配合物(Bipy结构如下图A)。
①该配合物中中心原子的化合价为;与中心原子形成配位键的原子是。
②与ClO4-互为等电子体的一种非极性分子是(举1例)。
③1 mol Bipy中所含σ键mol。
(4)、钛(Ti)被誉为“21世纪金属”,Ti晶体的堆积方式是六方最密堆积如图B所示,晶胞可用图C表示。设金属Ti的原子半径为a cm,空间利用率为。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为。32. 元素在周期表中的位置反映了元素的原子结构和性质,矿物白云母是一种重要的化工原料,其化学式的氧化物形式为:K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:(1)、Al元素在元素周期表中的位置为 , K2O的电子式为。(2)、上述元素中(Si、H除外),形成的简单离子的半径最小,该离子与过量氨水反应的离子方程式为。(3)、根据KH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第族。(4)、某元素R与氧元素同主族,对延长人类寿命起着重要作用,被誉为“生命元素”。已知R元素的原子有4个电子层,则元素R的质子数是。33. 根据下列叙述,回答下列问题:(1)、A元素原子的最外层电子数为电子层数的3倍,写出A的原子结构示意图。(2)、与Ar原子电子层结构相同的-1价阴离子,则其离子符号为 。(3)、质量数为23,中子数为12的原子,写出其在周期表中的位置。(4)、《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种核素的比例确定“北京人”生存年代的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:①26Al和27Al (选填编号)。
A.是同一种元素 B.是同一种核素
C.具有相同的中子数 D.具有相同的化学性质
②碳元素的一种核素也可以考古断代,其原子符号为 。
③10g10Be所含的中子数与质子数之差为 个。
34. A、B、C、X、Y、Z、E为前四周期元素,且原子序数依次增大。A原子核外有三个能级,且每个能级上的电子数相等,C原子成对电子数是未成对电子数的3倍,X、Y、Z、E是位于同一周期的金属元素,X、E 原子的最外层电子数均为1,Y有“生物金属”之称,Y4+和氩原子的核外电子排布相同,Z原子核外电子的运动状态数目是最外层电子数的14倍。用元素符号回答下列问题:(1)、B 原子的电子排布式为 , Y原子的价电子轨道表示式为 , Z2+的价电子排布式为。(2)、E元素位于元素周期表第周期族,属于区元素。(3)、①A、B、C三种元素的第一电离能由小到大的顺序为。②A、C 元素简单气态氢化物的稳定性:>(用分子式表示),原因是。
③AC2的电子式为。
35.(1)、0.5L1.0molL-1FeCl3溶液与0.2L1.0molL-1MgCl2溶液中的Cl-的物质的量浓度之比为。(2)、某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为。(3)、配制90mL0.1mol/LCuSO4溶液,需要胆矾g。(4)、氧化还原反应S+KOH→K2S+K2SO3+H2O(未配平)中,氧化剂与还原剂的物质的量之比为 , 若反应中消耗了0.6molS,则反应中转移的电子为mol。(5)、某元素R的简单阴离子Rn-核外有a个电子,中子数为b,则其质量数为。