高考二轮复习知识点:离子共存2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、 氨水溶液:Na+、K+、OH-、NO B、 盐酸溶液:Na+、K+、SO 、SiO C、 KMnO4溶液:NH 、Na+、NO 、I- D、 AgNO3溶液:NH 、Mg2+、Cl-、SO2. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1 mol·L−1NaOH溶液:Na+、K+、 、 B、0.1 mol·L−1FeCl2溶液:K+、Mg2+、 、 C、0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH− D、0.1 mol·L−1H2SO4溶液:K+、 、 、3. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明的溶液中:Fe3+、Mg2+、SCN ﹣、Cl ﹣ B、c(H+)/c(OH﹣)=1×10 ﹣12的溶液中:K+、Na+、CO32﹣、NO3﹣ C、c(Fe2+ )=1 mol•L﹣1的溶液中:K+、NH4+、MnO4﹣、SO42﹣ D、能使甲基橙变红的溶液中:Na+、NH4+、SO42﹣、HCO3﹣4. 制备(NH4)2Fe(SO4)2•6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理.常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )A、通入过量Cl2:Fe2+、H+、NH4+、Cl﹣、SO42﹣ B、加入过量NaClO溶液:NH4+、Fe2+、H+、SO42﹣、ClO﹣ C、加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42﹣、OH﹣ D、加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42﹣、Cl﹣、ClO﹣、OH﹣5. 下列关于离子共存或离子反应的说法正确的是( )A、某无色溶液中可能大量存在H+、Cl﹣、MnO4﹣ B、pH=2的溶液中可能大量存在Na+、NH4+、SiO32﹣ C、Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O D、稀硫酸与Ba(OH)2溶液的反应:H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O6. 在的含有、、三种阳离子的溶液中,可能存在的阴离子是 ( )
① ② ③ ④
A、①② B、②③ C、③④ D、①③7. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是选项
粒子组
判断和分析
A
透明溶液中:Mg2+、Cu2+、Br-、
不能大量共存,因为Cu2+呈蓝色
B
能溶解Al2O3的溶液中:Na+ 、、Cl-、
能大量共存,粒子间不反应
C
NaCl溶液中:Fe3+、I-、Ba2+、CH3COO-
不能大量共存,Fe3+和I- 会发生氧化还原反应
D
NaHSO4溶液中:K+ 、Cl-、、
不能大量共存,和发生反应
A、A B、B C、C D、D8. 下列各组离子在指定溶液中能大量共存的是A、无色溶液中:、、 B、酸性溶液中:、、 C、碱性溶液中:、、 D、溶液中:、、9. 离子鉴别能让我们感受微观世界的神奇。下列在透明溶液中能大量共存的离子组是A、、、、 B、、、、 C、、、、 D、、、、10. 常温下,下列各组离子在指定溶液中能大量共存的是A、pH=1的溶液中:Fe2+、NO、SO、Na+ B、由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Al3+、K+、Cl-、HCO C、=1012的溶液中:NH、Al3+、NO、Cl- D、c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO、SCN-11. 下列无色透明的溶液中,离子能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、12. 下列各组离子在给定溶液中一定能大量共存的是A、在的氨水中: B、在的氯化钠溶液中: C、在的醋酸溶液中: D、时,的溶液中:13. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是选项
粒子组
判断和分析
A
、、、
不能大量共存,因发生反应:
B
、、、
不能大量共存,与可发生氧化还原反应
C
、、、
能大量共存,钠盐、铵盐都溶于水
D
、、、
不能大量共存,、会发生氧化还原反应
A、A B、B C、C D、D14. 以含锌废液(主要成分为ZnSO4 , 含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如下。下列说法错误的是 A、1mol过二硫酸钠(Na2S2O8)中含有σ键数9NA B、氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、 C、调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质 D、氧化除锰过程中生成MnO2的离子方程式:Mn2++S2O+2H2O=MnO2↓+2SO+4H+15. 下列各粒子组在溶液中能否大量共存的判断和分析均正确的是
A、1mol过二硫酸钠(Na2S2O8)中含有σ键数9NA B、氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、 C、调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质 D、氧化除锰过程中生成MnO2的离子方程式:Mn2++S2O+2H2O=MnO2↓+2SO+4H+15. 下列各粒子组在溶液中能否大量共存的判断和分析均正确的是选项
粒子组
判断和分析
A
、、、
不能大量共存,因发生反应:
B
、、、
不能大量共存,因发生水解
C
、、、
不能大量共存,因和发生氧化还原反应
D
、、、
不能大量共存,因发生反应:
A、A B、B C、C D、D二、多选题
-
16. 某无色溶液可能含有中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
 A、原溶液中一定不存在 , 可能存在 B、原溶液中一定存在离子有 , 可能存在 C、该过程中可能涉及到氧化还原反应 D、若原溶液中 , 则一定存在17. 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
A、原溶液中一定不存在 , 可能存在 B、原溶液中一定存在离子有 , 可能存在 C、该过程中可能涉及到氧化还原反应 D、若原溶液中 , 则一定存在17. 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是( ) A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、18. 表中的操作、现象和解释或结论对应都正确的是( )
A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、18. 表中的操作、现象和解释或结论对应都正确的是( )操作
现象
解释或结论
A
向滴有酚酞的Na2CO3溶液中加入少量BaCl2固体
生成白色沉淀、溶液红色变浅
水解显碱性
B
将0.1 mol•L-1氨水稀释到0.01 mol•L-1 , 用pH计测量其pH
pH由11.1变为10.6
稀释氨水NH3•H2O的电离程度减小
C
冰水浴环境下向滴有酚酞的饱和氨盐水中通入过量CO2
溶液红色褪去时析出沉淀
利用物质溶解度的不同制备NaHCO3
D
向2 mL0.1 mol•L-1ZnSO4溶液中加入1 mL1 mol•L-1Na2S溶液,再加入2 mL0.1 mol•L-1CuSO4溶液
先出现白色沉淀,后变为黑色沉淀
CuS的溶度积比ZnS小
A、A B、B C、C D、D19. 向盛有溶液的两支试管中,分别滴入、溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法错误的是( ) A、曲线①表示的是氢氧化钡溶液中滴加硫酸 B、a、d点溶液呈中性 C、b点溶液中大量存在的离子是、、 D、用离子方程式表示ob段的反应20. 下列各组离子在指定溶液中一定能大量共存的是( )A、碳酸钠溶液中:、Ca2+、Cl-、 B、能使酚酞变红的溶液中:Na+、Ba2+、Cl-、 C、与铁反应产生无色无气味气体的溶液中:Na+、K+、Cl-、 D、常温下pH=1的溶液中:K+、Na+、、OH-21. 下列各组离子,在强酸性无色溶液中可以大量共存的是( )A、K+、HCO、NO、Cu2+ B、Mg2+、NO、Cl-、Fe3+ C、Na+、K+、Cl-、SO D、Na+、Cl-、NH、Ba2+22. 某地区的雾霾中可能含有Na+、Ba2+、Mg2+、Fe3+、SO、Cl-、CO、HCO等离子。某同学收集雾霾样品,经必要的预处理配成试样溶液,设计如下实验探究其中含有的离子。①取一定体积的溶液,加入足量BaCl2溶液,产生白色沉淀,继续滴加足量盐酸,沉淀不溶解,同时得到无色气体。②另取一定体积的溶液,加入足量NaOH溶液,产生白色沉淀,继续滴加足量稀盐酸,沉淀全部溶解。下列判断错误的是( )A、可能含有CO、Na+ B、操作①中产生的无色气体为CO2 C、肯定含有Mg2+、SO、HCO D、一定不存在Ba2+、Fe3+、Cl-23. 某100mL溶液含有、、、、、中的若干种,取该溶液进行实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法错误的是( )
A、曲线①表示的是氢氧化钡溶液中滴加硫酸 B、a、d点溶液呈中性 C、b点溶液中大量存在的离子是、、 D、用离子方程式表示ob段的反应20. 下列各组离子在指定溶液中一定能大量共存的是( )A、碳酸钠溶液中:、Ca2+、Cl-、 B、能使酚酞变红的溶液中:Na+、Ba2+、Cl-、 C、与铁反应产生无色无气味气体的溶液中:Na+、K+、Cl-、 D、常温下pH=1的溶液中:K+、Na+、、OH-21. 下列各组离子,在强酸性无色溶液中可以大量共存的是( )A、K+、HCO、NO、Cu2+ B、Mg2+、NO、Cl-、Fe3+ C、Na+、K+、Cl-、SO D、Na+、Cl-、NH、Ba2+22. 某地区的雾霾中可能含有Na+、Ba2+、Mg2+、Fe3+、SO、Cl-、CO、HCO等离子。某同学收集雾霾样品,经必要的预处理配成试样溶液,设计如下实验探究其中含有的离子。①取一定体积的溶液,加入足量BaCl2溶液,产生白色沉淀,继续滴加足量盐酸,沉淀不溶解,同时得到无色气体。②另取一定体积的溶液,加入足量NaOH溶液,产生白色沉淀,继续滴加足量稀盐酸,沉淀全部溶解。下列判断错误的是( )A、可能含有CO、Na+ B、操作①中产生的无色气体为CO2 C、肯定含有Mg2+、SO、HCO D、一定不存在Ba2+、Fe3+、Cl-23. 某100mL溶液含有、、、、、中的若干种,取该溶液进行实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法错误的是( )
已知:
A、原溶液中一定存在的阴离子有、和 B、原溶液中一定不存在 , 可能存在 C、“沉淀1”中、的物质的量之比为2:1 D、若原溶液中不存在 , 则24. 室温下,在由水电离产生的c(OH-)=1.0×10-12mol·L-1的溶液中,一定不能大量共存的离子组是( )A、F-、Cl-、Na+、K+ B、、、Fe2+、Mg2+ C、I-、、Ca2+、Ba2+ D、、、Na+、K+25. 有一混合溶液中含有以下离子的若干种:K+、Mg2+、 、Ba2+、Cl-、 、 ,现有两份体积相同各为100 mL的该溶液进行如下实验:①向第一份溶液中加入足量的NaOH溶液并加热后,收集到0.224 L的气体(标准状况下测定),并产生0.58 g白色沉淀;②向第二份溶液中加入足量的BaCl2溶液,产生6.99 g白色沉淀。根据上述实验,以下推测错误的是( )A、K+可能存在 B、Ba2+一定不存在 C、可能存在 D、100 mL该溶液中若含有0.01mol Cl- , 则K+的物质的量浓度一定为0.4 mol·L-1三、非选择题
-
26. 某无色透明溶液中可能大量存在Na+、Mg2+、Cu2+、Ca2+、SO、OH-、CO和Cl-中的几种。回答下列问题:(1)、不做任何实验就可以肯定原溶液中不存在的离子是。(2)、取少量溶液滴入紫色石蕊溶液,溶液呈蓝色,原溶液中一定不存在的离子是。(3)、取少许溶液滴入BaCl2溶液,有白色沉淀产生,加入稀硝酸,白色沉淀完全溶解。原溶液一定不存在的离子是;写出白色沉淀溶解的离子方程式:。(4)、由上述过程可知,不能确定是否存在的离子是 , 若要确定该离子,应进行的实验为(写出操作过程和实验现象)。(5)、取原溶液20 mL,逐滴加入0.2 mol∙L−1的Ca(OH)2溶液至恰好完全反应,这时消耗的Ca(OH)2溶液的体积为50 mL。用原溶液配制100 mL0.1 mol∙L−1的Na2CO3溶液,应取用的原溶液的体积为mL。27. 有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH、K+、CO、SO离子中的几种,为分析其成分,取该溶液分别进行如图四个实验,其操作和有关现象如图所示:
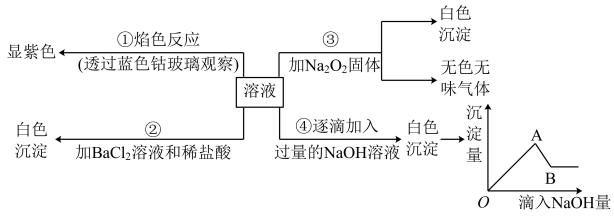
回答下列问题:
(1)、原溶液中一定存在的离子是 , 一定不存在的离子是。(2)、实验②中加入稀盐酸的目的是。(3)、实验③中产生无色无味气体发生反应的化学方程式为。实验反应过程中转移NA个电子,则产生L气体(标准状况下)。(4)、实验④中最终产生的沉淀是(填化学式)。写出A→B过程中发生反应的离子方程式。28. A、B、C、D为四种常见化合物,它们所含的阴阳离子各不相同,由表中的离子组成:阳离子
阴离子
为确定它们的组成,进行以下实验:
①分别将它们溶于水,均为无色溶液。
②将A溶液分别滴入其它三种溶液中,均有沉淀生成,继续滴加至过量,B中沉淀逐渐溶解。
③向D溶液中逐滴加入C溶液,先无气体产生,继续滴加产生无色无味气体。
回答下列问题:
(1)、写出下列物质的化学式:A;B。(2)、D溶液显(选填“中性”、“碱性”或“酸性”)。(3)、实验②中沉淀溶解的离子方程式为。(4)、D溶液中滴加少量C发生反应的离子方程式为。29. 某无色透明溶液中可能大量存在离子为 、 、 、 、 、 、 、 中的几种,回答下列回答(用离子符号填空):(1)、不做任何实验就可以确定原溶液中不存在的离子是。(2)、取少量溶液,加入过量盐酸,有白色沉淀生成;再加入过量稀硝酸,沉淀不消失。根据此现象你得出的结论是。(3)、取(2)中的滤液,加入过量稀氨水,出现白色沉淀,说明原溶液中肯定存在的离子是。生成白色沉淀的离子方程式是。(4)、原溶液中一定含有的离子有;可能存在的离子有。30. 有一无色溶液,其中可能含有Al3+、Fe2+、Mg2+、Cu2+、Ba2+、K+、 、 、 等离子中的几种,为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如下:⑴用洁净的铂丝蘸取少量溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色。
⑵取少量原溶液,滴加足量 溶液,有白色沉淀产生,再滴加足量的稀硝酸,无气泡产生且沉淀不溶解,过滤得到滤液a。
⑶另取少量原溶液,逐滴滴加过量的NaOH溶液,白色沉淀先增多后减少,但不完全溶解。
①原溶液中一定存在的离子有;一定不存在的离子有。
②补齐检验溶液中不能确定离子的操作:取少量滤液a,。
③写出第(3)个实验中白色沉淀减少过程中发生的离子反应方程式:。
④结合实验(3),你认为实验室制备 ,用可溶性铝盐和反应更佳(填化学式)。
31. 已知:为四种可溶性盐,它们的阳离子分别是中的某一种,阴离子分别是中的某一种。(1)、根据所学知识推断这四种盐的化学式分别为。(2)、设计实验确定此猜想:①将四种盐分别加入试管中,并加水溶解,可观察到溶液颜色的情况为。
②向①的四支试管中分别加入稀盐酸,可观察到的现象为。
(3)、检验上述四种溶液中的某一种中含有氯离子的方法为。32. 某无色透明溶液中可能含有大量的K+、Ba2+、Cu2+、Mg2+、、Cl-、OH-、中的多种离子。对此混合溶液进行以下分析。①取250 mL该混合溶液,加入过量盐酸,收集到标准状况下气体5.6 L;
②在操作①后的溶液中加入过量的NaOH溶液,过滤、洗涤、干燥得到白色沉淀5.8 g;
③在操作②后的溶液中加入过量的BaCl2溶液,过滤、洗涤、干燥得到白色沉淀23.3 g;
④在操作③后的溶液中加入过量的稀硝酸酸化的硝酸银溶液,产生大量的白色沉淀。
回答下列问题:
(1)、不做实验就可确定一定不含有的离子是。(2)、通过实验①确定一定不含有的离子是;通过实验②确定一定含有的离子是;通过实验③确定一定含有的离子是。(3)、写出操作②涉及的化学反应的离子方程式 。(4)、通过上述实验分析不能确定是否存在的离子是;K+的物质的量浓度至少为。(5)、在操作③的过程中判断加入的BaCl2溶液过量的操作是。33. 某无色溶液中可能含有H+、OH-、Na+、K+、NO ,加入铝粉后,只产生H2 , 为探究该溶液中存在的离子,某学习小组进行了如下实验。(1)、甲同学分析“若H+大量存在,则NO 就不能大量存在”,设计实验证实如下:装置
现象

Ⅰ.实验初始,未见明显现象
Ⅱ.过一会儿,出现气泡,液面上方出现浅棕色气体
Ⅲ.试管变热,溶液沸腾
①现象Ⅲ产生的原因。
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验
内容
现象
实验1
将湿润KI—淀粉试纸置于空气中
试纸未变蓝
实验2
用湿润KI—淀粉试纸检验浅棕色气体
试纸变蓝
实验1、2说明反应生成了NO。
请用化学方程式解释气体变为浅棕色的原因。
(2)、乙同学分析“若OH-大量存在,NO 也可能不大量存在”,重新设计实验证实如下:装置
现象

Ⅰ.实验初始,未见明显现象
Ⅱ.过一会儿,出现气泡,有刺激性气味
为确认:"刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
产生该刺激性气味气体的离子方程式是。
(3)、甲、乙两位同学设计的实验初始时均未见明显现象的原因是。(4)、根据以上实验分析,该溶液中一定大量存在的离子是。34. 已知某溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、 、 、 、I-、 、 中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。(1)、根据下列实验步骤和现象,推断实验结论:实验步骤与实验现象
实验结论
Ⅰ.观察溶液:无色透明
①原溶液中一定不含的离子是。
Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液
②原溶液中一定不含的离子是 , 一定含有的离子是。
Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A
③原溶液中还一定含有的离子是 , 生成沉淀A的离子方程式为。
Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B
④白色沉淀B中一定含有 , 可能含有。
(2)、上述实验步骤Ⅳ中开始阶段一定发生的离子方程式是。(3)、该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示。
Y可能为(填化学式) , B的组成为。
35. 1L某混合溶液,可能含有的离子如下表:可能大量含有的阳离子
H+、Mg2+、Al3+、NH4+
可能大量含有的阴离子
Cl-、CO32-
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
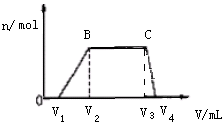 (1)、该溶液中一定不含有的离子是。(2)、V1、V2、V3、V4之间的关系。(3)、V3V4段离子方程式为。
(1)、该溶液中一定不含有的离子是。(2)、V1、V2、V3、V4之间的关系。(3)、V3V4段离子方程式为。