高考二轮复习知识点:离子共存1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 25℃时,下列各组离子中可以在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、2. 下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO等离子大量共存的是( )A、加入ZnSO4 B、加入Fe粉 C、通入NH3 D、通入CO23. 下列各组离子在给定溶液中能大量共存的是( )A、在氨水中: B、在氯化钠溶液中: C、在醋酸溶液中: D、在硝酸银溶液中:4. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、5. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
粒子组
判断和分析
A
、 、 、
不能大量共存,因发生反应:
B
、 、 、
不能大量共存,因发生反应:
C
、 、 、
能大量共存,粒子间不反应
D
、 、 、
能大量共存,粒子间不反应
A、A B、B C、C D、D6. 下列各组离子在溶液中能大量共存,加入氢氧化钠溶液有沉淀生成,加入盐酸有气体生成的一组离子是( )A、、Na+ 、Ba2+、 B、K+、Mg2+ 、Cl- 、 C、、 、、Na+ D、、Cl- 、 、K+7. 常温下,下列各组离子一定能在指定溶液中大量共存的是A、加入铝产生氢气的溶液: B、澄清透明的溶液: C、能使甲基橙试液显红色的溶液: D、水电离的的溶液:8. 室温时,下列各组离子在水溶液中可以大量共存的是A、、、、 B、、、、 C、、、、 D、、、、9. 室温下,经指定操作后,下列各组溶液中离子还能大量共存的是A、加入:、、、 B、加入:、、、 C、加入:、、、 D、加入:、、、10. 现有一澄清透明的溶液,可能含有大量的Fe3+、Fe2+、Al3+、H+、AlO、CO、NO七种离子中的几种,向该溶液中逐滴加入1mol•L-1NaOH溶液一定体积后才产生沉淀,则下列判断正确的是A、溶液中可能含有Fe2+ B、溶液中一定含有NO C、溶液中可能含有CO D、溶液中一定不含Al3+11. 常温下,下列指定溶液中,各组离子一定能大量共存的是( )A、的溶液:、、、 B、溶液:、、、 C、甲基橙为黄色的溶液:、、、 D、的溶液:、、、12. 在烧杯中混合含等物质的量溶质的KOH溶液和Cu(NO3)2溶液,能正确显示反应后存在物质的是( )A、 B、
B、 C、
C、 D、
D、 13. 室温时,下列各组离子在水溶液中可以大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、14. 常温下,下列各组离子在指定溶液中能大量共存的是A、澄清透明的溶液中:、、、 B、能使酚酞变红的溶液中:、、、 C、麦芽糖溶液中:、、、 D、含的溶液中:、、、15. 下列有关Fe2(SO4)3溶液的叙述正确的是A、该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存 B、和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 C、和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓ D、1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
13. 室温时,下列各组离子在水溶液中可以大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、14. 常温下,下列各组离子在指定溶液中能大量共存的是A、澄清透明的溶液中:、、、 B、能使酚酞变红的溶液中:、、、 C、麦芽糖溶液中:、、、 D、含的溶液中:、、、15. 下列有关Fe2(SO4)3溶液的叙述正确的是A、该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存 B、和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 C、和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓ D、1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe二、多选题
-
16. 某固体X可能含有、Fe3+、Na+、Cl-、、中的几种离子,将固体X均分为两份,进行如下实验:
①一份固体溶于水得透明溶液,加入足量BaCl2溶液,得白色沉淀6. 63 g,在沉淀中加入过量稀盐酸,仍有4. 66g白色沉淀。
②另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0. 672 L(标准状况)。
下列说法正确的是( )
A、该固体中一定含有、、、Na+ B、固体X中Na+物质的量至少为0.03mol C、该固体中一定没有Fe3+和Cl- D、该固体中只含有、、17. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如图实验: 下列说法错误的是( )A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 D、滤液X中大量存在的阳离子有 和18. 对有关NaClO和NaCl混合溶液的叙述正确的是( )A、该溶液中,H+、NH 、SO 、Br﹣可以大量共存 B、该溶液中,K+、OH﹣、S2﹣、NO3﹣不能大量共存 C、向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO﹣+2H+→Cl﹣+2Fe3++H2O D、向该溶液中加入浓盐酸,每产生1molCl2 , 转移电子约为6.02×1023个19. 铝粉投入某无色澄清溶液中产生H2 , 则下列离子可能大量共存的是( )A、H+、Mg2+、Al3+、NO B、Na+、Al3+、Cl-、Ba2+ C、OH-、Al3+、Cl-、NO D、Na+、Ba2+、Cl-、NO20. 在某澄清透明的溶液中,能大量共存的离子组是( )A、Ba2+、Na+、Cl-、HCO3- B、Fe3+、NH4+、NO3-、SCN- C、H+、Fe2+、NO3-、SO42- D、NH4+、Al3+、SO42-、Cl-21. 下列各组离子在水溶液中能大量共存的是()A、CO32-、Na+、H+ B、Cu2+、Cl-、OH- C、Mg2+、Ca2+、NO3- D、H+、Al3+、SO42-22. 向含有 、 、 、 的溶液中加入过量的 ,微热并搅拌,然后加入过量的稀盐酸,充分反应后溶液中离子的数目减少的是A、 B、 C、 D、23. 若在加入铝粉能产生氢气的无色溶液中,分别加入下列各组离子,可能共存的是( )A、NH4+、NO3﹣、Al3+、Cl﹣ B、Na+、AlO2﹣、K+、NO3﹣ C、MnO4﹣、K+、SO42﹣、Na+ D、AlO2﹣、K+、NO3﹣、OH﹣24. 在强酸性溶液中,能大量共存的离子组是( )A、K+、Cu2+、OH﹣、SO42﹣ B、K+、Na+、Cl﹣、NO3﹣ C、Zn2+、NH4+、NO3+、Cl﹣ D、K+、Na+、CO32﹣、SO42﹣25. 在由水电离产生的H+浓度为1×10﹣13mol•L﹣1的溶液中,一定能大量共存的离子组是( )A、K+、Cl﹣、NO3﹣、S2﹣ B、K+、Fe2+、I﹣、SO42﹣ C、Na+、Cl﹣、NO3﹣、SO42﹣ D、K+、Ba2+、Cl﹣、NO3﹣
下列说法错误的是( )A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 D、滤液X中大量存在的阳离子有 和18. 对有关NaClO和NaCl混合溶液的叙述正确的是( )A、该溶液中,H+、NH 、SO 、Br﹣可以大量共存 B、该溶液中,K+、OH﹣、S2﹣、NO3﹣不能大量共存 C、向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO﹣+2H+→Cl﹣+2Fe3++H2O D、向该溶液中加入浓盐酸,每产生1molCl2 , 转移电子约为6.02×1023个19. 铝粉投入某无色澄清溶液中产生H2 , 则下列离子可能大量共存的是( )A、H+、Mg2+、Al3+、NO B、Na+、Al3+、Cl-、Ba2+ C、OH-、Al3+、Cl-、NO D、Na+、Ba2+、Cl-、NO20. 在某澄清透明的溶液中,能大量共存的离子组是( )A、Ba2+、Na+、Cl-、HCO3- B、Fe3+、NH4+、NO3-、SCN- C、H+、Fe2+、NO3-、SO42- D、NH4+、Al3+、SO42-、Cl-21. 下列各组离子在水溶液中能大量共存的是()A、CO32-、Na+、H+ B、Cu2+、Cl-、OH- C、Mg2+、Ca2+、NO3- D、H+、Al3+、SO42-22. 向含有 、 、 、 的溶液中加入过量的 ,微热并搅拌,然后加入过量的稀盐酸,充分反应后溶液中离子的数目减少的是A、 B、 C、 D、23. 若在加入铝粉能产生氢气的无色溶液中,分别加入下列各组离子,可能共存的是( )A、NH4+、NO3﹣、Al3+、Cl﹣ B、Na+、AlO2﹣、K+、NO3﹣ C、MnO4﹣、K+、SO42﹣、Na+ D、AlO2﹣、K+、NO3﹣、OH﹣24. 在强酸性溶液中,能大量共存的离子组是( )A、K+、Cu2+、OH﹣、SO42﹣ B、K+、Na+、Cl﹣、NO3﹣ C、Zn2+、NH4+、NO3+、Cl﹣ D、K+、Na+、CO32﹣、SO42﹣25. 在由水电离产生的H+浓度为1×10﹣13mol•L﹣1的溶液中,一定能大量共存的离子组是( )A、K+、Cl﹣、NO3﹣、S2﹣ B、K+、Fe2+、I﹣、SO42﹣ C、Na+、Cl﹣、NO3﹣、SO42﹣ D、K+、Ba2+、Cl﹣、NO3﹣三、非选择题
-
26. 一种废镍催化剂中含有Ni、 Al、Cr。、Cu、FeS及碳粉,以其为原料制备环烷酸镍[(C10H8COO)2Ni,常温下为难溶于水的液体]的工艺流程如图所示:

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子
Fe3+
Fe2+
Ni2+
Cu2+
开始沉淀的pH
1.9
7.0
6.4
5.4
完全沉淀的pH
3.2
9.0
8.4
6.7
回答下列问题:
(1)、充分“灼烧”后,产生废气中的有毒气体的化学式为。(2)、“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、。基态Cr原子的价层电子排布式为。(3)、“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是。(4)、“调pH”时,溶液pH的范围为。(5)、常温下,CuS的Ksp极小,用S2-可将Cu2+完全沉淀。CuS晶胞中S2-的位置如图1所示,Cu2+位于S2-所构成的四面体中心,晶胞侧视图如图2所示。
①与S2-距离最近的S2-数目为。
②CuS的晶胞参数为a pm,阿伏加德罗常数的值为NA , 则CuS晶体的密度为g·cm-3。
(6)、环烷酸的化学式为C10H8COOH,写出“合成”反应的化学方程式: 。(7)、测定样品纯度:已知环烷酸镍样品中含有环烷酸杂质。取1.000g环烷酸镍样品,加入足量稀硫酸[发生反应:(C10H8COO)2Ni+H2SO4=2C10H8COOH+ NiSO4]后,用氨水调节溶液pH为9~10时,加入紫脲酸胺作指示剂,用0.1000mol· L-1 EDTA标准溶液滴定(Ni2+与EDTA反应的化学计量数之比为1:1),消耗EDTA标准溶液20.00mL。则环烷酸镍样品纯度为%。27. 工业上可以用天青石生产碳酸锶后的含锶废渣制备高纯六水氯化锶(SrCl2•6H2O),含锶废渣主要成分为SrCO3 , 且含钡、铁、钙等元素。六水氯化锶是一种无色长针状晶体,易溶于水,微溶于无水乙醇和丙酮,下面为实验室模拟SrCl2•6H2O的制作流程: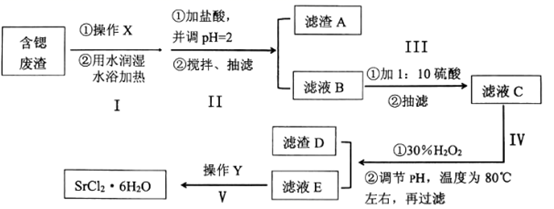
已知:①SrSO4微溶于水;
②SrCl2•6H2O在61.5℃以上即会失去4个结晶水生成SrCl2•2H2O。
(1)、关于上述实验操作下列说法错误的是___。A、步骤I中操作X为研磨粉碎,可以增大反应接触面积 B、步骤III为提高产率,可以用滤液淋洗布氏漏斗中的滤渣 C、抽滤时,如果溶液有强酸性,可以用玻璃纤维代替滤纸 D、减压过滤不宜过滤胶状沉淀,因为胶状沉淀会在滤纸上形成一层密实的沉淀 E、步骤IV中的温度控制在80℃左右,可以用水浴加热,也可以用油浴或砂浴加热代替,更安全(2)、下表为实验中硫酸加入量对溶液中Ba2+和Sr2+含量的影响,实验发现在步骤III中加入硫酸量过量20%较合适,请解释原因:。硫酸加入量/mL
4.50
4.95
5.40
5.85
6.30
Ba2+/(g/L)
0.37
0.21
0.13
0.11
0.10
Sr2+/(g/L)
90.21
89.86
89.57
89.23
88.90
(3)、①步骤IV调节pH时,为避免引入新的杂质,最适宜加入的试剂为 , 如图为在80℃时,pH对除杂的影响,通过加入试剂将pH调至。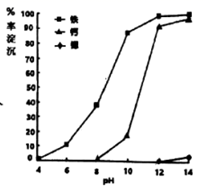
②往滤渣D中加入NaClO溶液,发生反应的离子方程式为:。
(4)、在步骤V中,若要从滤液E通过操作Y得到大颗粒的高纯六水氯化锶晶体,操作Y包含下列步骤中的某几项,请选择合适的操作并排序。(填相应步骤的字母)滤液E→()→()→()→抽滤→()→()
a.蒸发浓缩至有大量晶体析出
b.在过饱和溶液中加入晶种
c.6l.5℃以上减压蒸发浓缩
d.6l.5℃以下减压蒸发浓缩
e.往溶液中加入无水乙醇
f.在30℃真空烘箱中干燥
g.在室温下缓慢冷却结晶
h.用氯化锶饱和溶液洗涤晶体
I.用冷水洗涤晶体
(5)、为侧定所制SrCl2•6H2O晶体的纯度,取1.12g实验制得的产物加水溶解,配成100mL溶液,用移液管取出25mL于锥形瓶中,滴入几滴K2CrO4 , 已知Ag2CrO4为砖红色沉淀,用浓度为0.100mol/L的硝酸银标准溶液滴定。①判断滴定终点的现象为;
②实验时未采用棕色滴定管滴定,会使测得的晶体纯度(填“偏高”、“偏低”或“不变”)。
28. 硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.(1)、已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ・mol﹣1
BaS(s)=Ba(s)+S(s)△H=+460kJ・mol﹣1
已知:2C(s)+O2(g)=2CO(g)△H=﹣221kJ・mol﹣1则Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= .
(2)、雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3﹣=2H3AsO4+3S+10NO2↑+2H2O,当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 .(3)、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS﹣、S2﹣)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).①含硫物种B表示 . 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母).
a.c(Na+)=c(H2S)+c(HS﹣)+2c(S2﹣)
b.2c(Na+)=c(H2S)+c(HS﹣)+c(S2﹣)
c.c(Na+)=3[c(H2S)+c(HS﹣)+c(S2﹣)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示).
(4)、硫的有机物( )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.  及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为  的核磁共振氢谱图.写出X的结构简式: .
的核磁共振氢谱图.写出X的结构简式: .  29. 某工业废水中存在大量的Na+、Cl-、Cu2+、SO , 欲除去其中的Cu2+、SO , 设计工艺流程如图所示:
29. 某工业废水中存在大量的Na+、Cl-、Cu2+、SO , 欲除去其中的Cu2+、SO , 设计工艺流程如图所示: (1)、试剂a溶液为 , 试剂 b溶液为。(2)、操作X为 , 试剂 a、b(填“能”或“不能”)对调顺序。(3)、如果在工业废水中直接加入氢氧化钡溶液,写出发生反应的离子方程式。(4)、如何检验废水中的SO已除尽(写出对应的操作及现象)。30. 有五种短周期元素A、B、X、D、E,它们的原子序数依次递增,A元素的一种核素可用于考古时判断文物的年代,X是地壳中含量最多的元素,D的氧化物具有两性,E和X同族。F为第四周期的元素,F3+离子的3d能级电子为半充满。根据以上信息,回答下列问题:(1)、元素A基态原子的价电子排布图(轨道表示式)为 , F2+的电子排布式为。(2)、元素A、B、X电负性由大到小的顺序为 (用元素符号表示,下同),基态X原子比基态B原子的第一电离能低的原因是。(3)、元素E原子核外有种不同运动状态的电子。 D元素基态原子的最高能级符号为。(4)、元素B的简单氢化物的沸点比同主族相邻元素氢化物的高,原因是。(5)、下列说法正确的是 (填标号)。
(1)、试剂a溶液为 , 试剂 b溶液为。(2)、操作X为 , 试剂 a、b(填“能”或“不能”)对调顺序。(3)、如果在工业废水中直接加入氢氧化钡溶液,写出发生反应的离子方程式。(4)、如何检验废水中的SO已除尽(写出对应的操作及现象)。30. 有五种短周期元素A、B、X、D、E,它们的原子序数依次递增,A元素的一种核素可用于考古时判断文物的年代,X是地壳中含量最多的元素,D的氧化物具有两性,E和X同族。F为第四周期的元素,F3+离子的3d能级电子为半充满。根据以上信息,回答下列问题:(1)、元素A基态原子的价电子排布图(轨道表示式)为 , F2+的电子排布式为。(2)、元素A、B、X电负性由大到小的顺序为 (用元素符号表示,下同),基态X原子比基态B原子的第一电离能低的原因是。(3)、元素E原子核外有种不同运动状态的电子。 D元素基态原子的最高能级符号为。(4)、元素B的简单氢化物的沸点比同主族相邻元素氢化物的高,原因是。(5)、下列说法正确的是 (填标号)。①简单离子半径:X>D
②简单氢化物的稳定性:X<E
③B的氧化物对应的水化物都是强酸
④D和E的简单离子在水溶液中不能大量共存
31. 某工厂排放的澄清废水中,可能含、、、、、、、、中的部分离子。(1)、用pH试纸检验,溶液呈现强碱性,说明溶液中一定不含的离子是。(2)、向少量废水中滴加稀盐酸至溶液里酸性的过程中出现无色气泡,说明溶液中一定含有的离子是 , 一定不含的离子是 , 判断的理由是(用离子方程式并结合文字说明来回答)。32. 某强酸性无色溶液中可能含下表离子中的若干种。阳离子
、、、、
阴离子
、、、、
实验Ⅰ:取少量该强酸性溶液A进行如图1实验。
实验Ⅱ:为了进一步确定该溶液的组成,取100mL原溶液A,向该溶液中滴加的溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图2所示。


回答下列问题:
(1)、不进行实验就可以推断出,上表中的离子一定不存在的有。(2)、该溶液中一定存在的离子是有。(3)、检验气体X的方法是有。(4)、写出图2中BC段对应的离子方程式有。(5)、通过上述信息可知,该溶液中阴离子的浓度为有。33. 某一无色澄清透明溶液,可能含有Na+、Mg2+、Cu2+、K+、Cl-、CO、SO中的一种或几种,小铭为探究该溶液中可能含有那些离子,做了如下实验:①用铂丝蘸取少量该溶液置于无色酒精灯火焰中灼烧,火焰呈黄色;
②取少量该溶液加入溶液有白色沉淀生成,过滤,往沉淀中加入足量盐酸后,沉淀部分溶解,并有气体生成;
③在滤液中滴加溶液,产生白色沉淀。
由此推断,该溶液中肯定含有的离子为 , 肯定不含有的离子为 , 可能含有的离子为。
34. 某混合物的水溶液,只可能含有以下离子中的若干种: ,现取三份100mL该溶液进行如下实验:①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀8.6g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验数据,填写下列空白。
(1)、一定不存在的离子有。(2)、第②步操作发生反应的离子方程式为。(3)、第③步操作确定的离子有。(4)、对无法确定是否存在的离子,满足时,则能确定其存在。35. 现有A、B、C、D四种可溶性物质,它们溶于水后电离产生的所有离子如下表所示:(各物质中所含离子均不相同)阳离子
阴离子
已知
①A溶液呈碱性;
②实验室常用B的浓溶液制取化工原料氯气;
③B溶液与C溶液混合有白色沉淀产生;
④向D溶液中逐滴滴加A溶液至过量,有白色沉淀产生,且沉淀量先增加后减少但不消失。
回答下列问题:
(1)、写出下列物质的化学式:A , C 。(2)、B溶液与C溶液混合后发生反应的离子方程式为。(3)、写出④中沉淀减少发生反应的离子方程式。(4)、设计实验检验D中所含的阴离子:。