高考二轮复习知识点:溶液酸碱性的判断及相关计算2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 常温下,用 氨水滴定 浓度均为 的 和 的混合液,下列说法错误的是( )A、在氨水滴定前, 和 的混合液中 B、当滴入氨水 时, C、当滴入氨水 时, D、当溶液呈中性时,氨水滴入量大于 ,2. 25℃时,a mol•L﹣1一元酸HA与b mol•L﹣1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )A、a=b B、a>b C、c (A﹣)=c(Na+) D、c (A﹣)<c(Na+)3. 298K时,在20.0mL 0.10mol•L﹣1氨水中滴入0.10mol•L﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L﹣1氨水的电离度为1.32%,下列有关叙述正确的是( )
 A、该滴定过程应该选择酚酞作为指示剂 B、M点对应的盐酸体积为20.0mL C、M点处的溶液中c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣) D、N点处的溶液中pH<124. 下列有关电解质溶液的说法正确的是( )A、向0.1mol•L﹣1 CH3COOH溶液中加入少量水,溶液中 减小 B、将CH3COONa溶液从20℃升温至30℃,溶液中 增大 C、向盐酸中加入氨水至中性,溶液中 >1 D、向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 不变5.
A、该滴定过程应该选择酚酞作为指示剂 B、M点对应的盐酸体积为20.0mL C、M点处的溶液中c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣) D、N点处的溶液中pH<124. 下列有关电解质溶液的说法正确的是( )A、向0.1mol•L﹣1 CH3COOH溶液中加入少量水,溶液中 减小 B、将CH3COONa溶液从20℃升温至30℃,溶液中 增大 C、向盐酸中加入氨水至中性,溶液中 >1 D、向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 不变5.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
 A、①代表滴加H2SO4溶液的变化曲线 B、b点,溶液中大量存在的离子是Na+、OH﹣ C、c点,两溶液中含有相同量的OH﹣ D、a、d两点对应的溶液均显中性6. 下列物质仅含共价键且水溶液呈酸性的是( )A、NaHCO3 B、(NH4)2SO4 C、NH3 D、CO27. 下列说法正确的是( )A、常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱 B、pH=1的盐酸和pH=12的MOH溶液等体积混合后,恰好完全反应,所用盐酸的浓度等于MOH溶液的浓度 C、升高温度,0.1 mol/L的氢氧化钠溶液pH减小,碱性减弱 D、相同温度下,pH相等的氨水和NaOH溶液, 相等8. 25℃时,下列说法错误的是( )A、0.010mol/L 溶液的 ,可推知HCN为弱酸 B、0.10mol/L 溶液中, 是 的三倍 C、纯水中加入少量 固体,水的电离度增大 D、氨水的pH不一定比NaOH溶液的pH小9. 是一种常用的食品防腐剂。已知 。下列叙述正确的是( )A、 溶液的pH随温度升高而增大 B、 溶液的 C、 溶液中 D、 溶液中10. 探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下, 的 )
A、①代表滴加H2SO4溶液的变化曲线 B、b点,溶液中大量存在的离子是Na+、OH﹣ C、c点,两溶液中含有相同量的OH﹣ D、a、d两点对应的溶液均显中性6. 下列物质仅含共价键且水溶液呈酸性的是( )A、NaHCO3 B、(NH4)2SO4 C、NH3 D、CO27. 下列说法正确的是( )A、常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱 B、pH=1的盐酸和pH=12的MOH溶液等体积混合后,恰好完全反应,所用盐酸的浓度等于MOH溶液的浓度 C、升高温度,0.1 mol/L的氢氧化钠溶液pH减小,碱性减弱 D、相同温度下,pH相等的氨水和NaOH溶液, 相等8. 25℃时,下列说法错误的是( )A、0.010mol/L 溶液的 ,可推知HCN为弱酸 B、0.10mol/L 溶液中, 是 的三倍 C、纯水中加入少量 固体,水的电离度增大 D、氨水的pH不一定比NaOH溶液的pH小9. 是一种常用的食品防腐剂。已知 。下列叙述正确的是( )A、 溶液的pH随温度升高而增大 B、 溶液的 C、 溶液中 D、 溶液中10. 探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下, 的 )实验
装置
试剂a
现象
①

Ca(OH)2溶液(含酚酞)
产生气泡
②
少量NaHCO3溶液
紫色溶液褪色
③
酸性KMnO4溶液
溶液褪色,产生白色沉淀
④
C2H5OH和浓硫酸
加热后产生有香味物质
下列离子方程式或化学方程式错误的是( )
A、草酸有酸性: B、草酸的酸性大于碳酸: C、草酸有还原性: D、草酸可发生酯化反应:HOOCCOOH+2C2H5OH C2H5OOC-COOC2H5+2H2O11. 草酸(H2C2O4)是一种二元弱酸。常温下向草酸溶液中滴加NaOH溶液,混合溶液中lgX[x表示 或 ]随pH的变化如图。下列说法中错误的是( ) A、NaHC2O4溶液呈酸性 B、H2C2O4第二步电离常数数量级是10-5 C、pH=7时,c(Na+)=c( )+2c( ) D、1.22<pH<4.19时,c( )>c( )>c(H2C2O4)12. 常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
A、NaHC2O4溶液呈酸性 B、H2C2O4第二步电离常数数量级是10-5 C、pH=7时,c(Na+)=c( )+2c( ) D、1.22<pH<4.19时,c( )>c( )>c(H2C2O4)12. 常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( ) A、曲线①代表φ(NH ),曲线②代表φ(NH3·H2O) B、a点溶液中存在c(Cl-)>c(NH )=c(NH3·H2O) C、NH3·H2O的电离常数的数量级为10-4 D、应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色13. 25℃时,向100mL水中缓慢通入0.01molCl2 , 然后用0.1mol/LNaOH溶液滴定所得氯水,整个过程中溶液pH的变化如图。下列说法正确的是( )
A、曲线①代表φ(NH ),曲线②代表φ(NH3·H2O) B、a点溶液中存在c(Cl-)>c(NH )=c(NH3·H2O) C、NH3·H2O的电离常数的数量级为10-4 D、应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色13. 25℃时,向100mL水中缓慢通入0.01molCl2 , 然后用0.1mol/LNaOH溶液滴定所得氯水,整个过程中溶液pH的变化如图。下列说法正确的是( ) A、Ca2+、NO 、S2O 能在该氯水中大量共存 B、b点对应溶液所含溶质为HCl和HClO C、对应溶液中水的电离程度:a=c D、d点对应溶液中:c(Na+)=c(HClO)+c(ClO-)14. 工业上,可将Cl2通入石灰乳中制备漂白粉,发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、22.4L Cl2中含有2NA个氯原子 B、反应中每生成1.8g H2O就会转移0.1NA电子 C、0.1 mol∙L−1的Ca(ClO)2溶液中ClO-的数目为0.2NA D、常温下,1L pH=12的Ca(OH)2溶液中OH-的数目为0.02NA15. 草酸(H2C2O4)是一种二元弱酸,已知:Ka1(H2C2O4)=5.4×10-2 , Ka2(H2C2O4)=5.4×10-5。室温下,用0.2000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1H2C2O4溶液至终点。对于滴定过程中的下列描述正确的是( )A、当滴入10.00mLNaOH溶液时,混合溶液的pH可能大于7 B、溶液中,始终存在c(Na+)<c(HC2O )+2c(C2O ) C、选择酚酞作指示剂,滴定终点时溶液可能呈粉红色 D、溶液中 一直增大
A、Ca2+、NO 、S2O 能在该氯水中大量共存 B、b点对应溶液所含溶质为HCl和HClO C、对应溶液中水的电离程度:a=c D、d点对应溶液中:c(Na+)=c(HClO)+c(ClO-)14. 工业上,可将Cl2通入石灰乳中制备漂白粉,发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、22.4L Cl2中含有2NA个氯原子 B、反应中每生成1.8g H2O就会转移0.1NA电子 C、0.1 mol∙L−1的Ca(ClO)2溶液中ClO-的数目为0.2NA D、常温下,1L pH=12的Ca(OH)2溶液中OH-的数目为0.02NA15. 草酸(H2C2O4)是一种二元弱酸,已知:Ka1(H2C2O4)=5.4×10-2 , Ka2(H2C2O4)=5.4×10-5。室温下,用0.2000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1H2C2O4溶液至终点。对于滴定过程中的下列描述正确的是( )A、当滴入10.00mLNaOH溶液时,混合溶液的pH可能大于7 B、溶液中,始终存在c(Na+)<c(HC2O )+2c(C2O ) C、选择酚酞作指示剂,滴定终点时溶液可能呈粉红色 D、溶液中 一直增大二、多选题
-
16. 下列说法中正确的是( )A、在100℃时,pH约为6的纯水呈酸性 B、将1×10-6 mol/L盐酸稀释1000 mL,所得溶液的pH为9 C、常温下,水电离出的c(H+)为1×10-13 mol/L时,此溶液的pH可能为1或13 D、将pH=2的盐酸与醋酸各1 mL分别稀释至100 mL,所得醋酸的pH略小17. 根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向2mL0.1mol/L硝酸银溶液中加入1mL0.1mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1mol/L的Na2S溶液,有黑色沉淀生成
Ksp(Ag2S)<Ksp(AgCl)
B
两支试管,都加入2mL1mol/L的酸性KMnO4溶液,再同时向两支试管分别加入2mL0.1mol/L的H2C2O4溶液和2mL0.05mol/L的H2C2O4溶液,前者高锰酸钾溶液褪色时间短
增大反应物浓度化学反应速率加快
C
经测定25℃时0.1mol/L的NaHC2O4溶液的pH≈5.5
电离平衡常数大于其水解平衡常数
D
向盛有相同浓度KI3溶液的两支试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
溶液中可能存在平衡:I-+I2
A、A B、B C、C D、D18. 在常温下,有关下列4种溶液的叙述中错误的是( )编号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A、在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小 B、分别取1mL稀释至10mL,四种溶液的pH:①>②>③>④ C、将溶液①、④等体积混合,所得溶液中: D、将aL溶液④与bL溶液②混合后,若所得溶液的pH=4,则a:b=11:919. 常温下,下列叙述中正确是( )A、pH=0的溶液不存在 B、酸性溶液中,c(H+)越大,pH越大 C、pH=7的溶液一定呈中性 D、0.1mol/L的氢氧化钠溶液,其pH=1320. MOH和ROH两种一元碱的溶液分别加水稀释,pH变化如图。下列叙述中错误的是( ) A、ROH是一种强碱 B、在x点,MOH已完全电离 C、在x点C(M+)=C(R+) D、稀释前C(ROH) = 10 C(MOH)21. 常温下,用浓度为0.1000mol•L﹣1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L﹣1的HX,HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
A、ROH是一种强碱 B、在x点,MOH已完全电离 C、在x点C(M+)=C(R+) D、稀释前C(ROH) = 10 C(MOH)21. 常温下,用浓度为0.1000mol•L﹣1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L﹣1的HX,HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( ) A、V(NaOH)=10.00 mL时,c(X﹣)>c(Na+)>c(H+)>c(OH﹣) B、V(NaOH)=20.00 mL时,两份溶液中,c(X﹣)>c(Y﹣) C、V(NaOH)=20.00 mL时,c(Na+)>c(X﹣)>c(OH﹣)>c(H+) D、pH=7时,两份溶液中,c(X﹣)=c(Y﹣)22. 常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是( )A、反应过程中,CH3COOH的电离程度增大 B、若混合后pH=7,则a+b=14 C、若混合后pH=5.3,则c(Na+)<c( CH3COO﹣) D、若混合后CH3COOH与NaOH恰好完全反应,则a+b<1423. 常温下,向浓度为 0.1mol/L、体积为 V L 的氨水中逐滴加入 0.1mol/L 的盐酸,下列 各选项中数值变大的有( )A、 B、 C、 D、24. 25℃时,在 10mL 浓度为 0.1mol/L 的 NH3•H2O 溶液中滴加 0.1mol/L 盐酸,下列有关描述正确的是( )A、加入5 mL 盐酸时:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+) B、加入10mL 盐酸时:c(NH4+)+c(H+)=c(OH﹣)+c(Cl﹣) C、在溶液pH=7 时:水的电离程度最大 D、加入20 mL 盐酸时:c(Cl﹣)=2c(NH4+)
A、V(NaOH)=10.00 mL时,c(X﹣)>c(Na+)>c(H+)>c(OH﹣) B、V(NaOH)=20.00 mL时,两份溶液中,c(X﹣)>c(Y﹣) C、V(NaOH)=20.00 mL时,c(Na+)>c(X﹣)>c(OH﹣)>c(H+) D、pH=7时,两份溶液中,c(X﹣)=c(Y﹣)22. 常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是( )A、反应过程中,CH3COOH的电离程度增大 B、若混合后pH=7,则a+b=14 C、若混合后pH=5.3,则c(Na+)<c( CH3COO﹣) D、若混合后CH3COOH与NaOH恰好完全反应,则a+b<1423. 常温下,向浓度为 0.1mol/L、体积为 V L 的氨水中逐滴加入 0.1mol/L 的盐酸,下列 各选项中数值变大的有( )A、 B、 C、 D、24. 25℃时,在 10mL 浓度为 0.1mol/L 的 NH3•H2O 溶液中滴加 0.1mol/L 盐酸,下列有关描述正确的是( )A、加入5 mL 盐酸时:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+) B、加入10mL 盐酸时:c(NH4+)+c(H+)=c(OH﹣)+c(Cl﹣) C、在溶液pH=7 时:水的电离程度最大 D、加入20 mL 盐酸时:c(Cl﹣)=2c(NH4+)三、非选择题
-
25. 运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:(1)、利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(2)、25℃时.将nmol•L﹣1的氨水与0.1mol•L﹣1的盐酸等体积混合.①当混合溶液中,c(NH4+)=c(Cl﹣)时.则溶液的pH= .
②当混合溶液中,c(NH4+)>c(Cl﹣)时.则反应的情况可能为 .
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)、在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)⇌2NH3(g)△H=bkJ•mol﹣1 , 其化学平衡常数K值和温度的关系如下:温度/℃
200
300
400
K
1.0
0.86
0.5
①写出该反应的化学平衡常数的表达式: , b(填“大于”、“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)(填“大于”、“小于”或“等于”)v逆(N2).
(4)、已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJ•mol﹣1②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol﹣1
写出氨高温催化氧化的热化学方程式 .
26. 碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。(1)、用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2 , 氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式。(2)、298 K时,在2L恒容密闭容器中发生反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。

下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”“<”或“=”)。
(3)、NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是;
③在c点,溶液中各离子浓度由大到小的排列顺序是。
27.稀土是我国战略性资源.氟碳铈矿主要化学成分为CeFCO3 , 它是提取铈族稀土元素的重要矿物原料.关于氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下:

请回答下列问题
(1)、为增大反应速率,提高原料的利用率,焙烧前可将矿石处理.(2)、焙烧过程中产生的SO3尾气常采用喷淋法净化,再用石灰乳中和;操作I中滤渣的主要成分是 .(3)、操作II若在实验室中进行,需要的主要玻璃仪器有、烧杯、玻璃棒等;所用萃取剂HT需具备的条件是 .①HT不溶于水,也不和水反应
②Ce3+不和萃取剂HT发生反应
③Ce3+在萃取剂HT中溶解度大于水
④萃取剂HT的密度一定大于水
(4)、已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+6HT(有机层)⇌2CeT3(有机层)+6H+(水层)从平衡角度解释:向CeT3 (有机层)加入稀硫酸获得较纯的含Ce3+的水溶液的原因是 .(5)、常温下,含Ce3+溶液加碱调至pH=8时,c(Ce3+)=b mol•L﹣1 , 已知Ce(OH)3的溶度积=a,则a和b的关系是 .(6)、写出Ce(OH)3悬浊液通入氧气得到产品的化学方程式: .(7)、取上述流程中得到的Ce(OH)4产品0.545g,加硫酸溶解后,用0.100 0mol•L﹣1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液.该产品中Ce(OH)4的质量分数为[Ce(OH)4的相对分子质量为208,结果保留两位有效数字].28.(1)、Ⅰ.实验室用0.100mol/LNaOH标准溶液滴定未知浓度的盐酸。盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的操作(填“甲”、“乙”、“丙”)。选择酚酞作为指示剂,滴定终点的现象为。
 (2)、下列操作会导致实验结果偏低的是___________(填标号)。A、碱式滴定管未用标准NaOH溶液润洗 B、盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 C、滴定终点读数时,仰视滴定管的刻度 D、滴定过程中振荡锥形瓶,液体不慎溅出(3)、某学生进行3次实验得到相关数据如表所示。
(2)、下列操作会导致实验结果偏低的是___________(填标号)。A、碱式滴定管未用标准NaOH溶液润洗 B、盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 C、滴定终点读数时,仰视滴定管的刻度 D、滴定过程中振荡锥形瓶,液体不慎溅出(3)、某学生进行3次实验得到相关数据如表所示。滴定次数
待测盐酸的体积/mL
消耗0.100mol/LNaOH溶液的体积/mL
滴定前读数
滴定后读数
第一次
25.00
0.00
26.11
第二次
25.00
1.56
30.30
第三次
25.00
0.22
26.31
则盐酸的物质的量浓度为mol/L。(保留三位小数)
(4)、Ⅱ.一定浓度的 溶液中含硫元素所有微粒的物质的量分数随pH的变化如图2所示。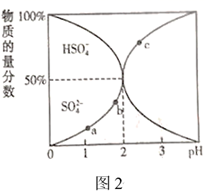
图中a、b、c三点,水电离的 由大到小的顺序分为(用a、b、c表示),pH=3时, 。
29. 盐是一类常见的电解质,实验表明盐溶液不一定呈中性,也可能呈酸性和碱性。(1)、 、 、 的水溶液分别呈性、性、性。(2)、将 溶液蒸干、灼烧,最后得到的主要固体产物是。(3)、纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)。(4)、纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)。30. 下表是25℃时某些弱酸的电离平衡常数化学式
(1)、常温时,向冰醋酸加水稀释过程中溶液的导电能力Ⅰ随加入水的体积V变化的曲线如右图所示,则a、b、c三点处,溶液中pH值最小的点为 , 醋酸的电离程度最大的点为; (2)、物质的量浓度均为 的四种溶液:
(2)、物质的量浓度均为 的四种溶液:① ② ③ ④
水的电离程度由小到大的顺序为;
(3)、向 溶液中通入少量CO2的化学方程式为;(4)、在25℃时向 溶液中滴加 溶液至: ,此时溶液的 .(5)、 溶液呈(填“酸性”“中性”“碱性”),试简述其原因;31. 室温下,用 溶液滴定 (二元弱酸)溶液所得滴定曲线如图,请回答下列问题: (1)、用电离方程式表示草酸溶液显酸性的原因。(2)、带你⑤所示溶液中, (填“>”“<”“=”)。(3)、已知: 、 在酸性条件下均能将草酸钠( )氧化成 ,测定软锰矿中 质量分数的方法是:称取 软锰矿样品,加入 草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,滤去杂质,将所得滤液转移到250 mL容量瓶中并定容,从中取出 待测液放入锥形瓶中,再用 标准溶液进行滴定,反应的离子方程式为: ,当滴入 溶液时恰好完全反应。
(1)、用电离方程式表示草酸溶液显酸性的原因。(2)、带你⑤所示溶液中, (填“>”“<”“=”)。(3)、已知: 、 在酸性条件下均能将草酸钠( )氧化成 ,测定软锰矿中 质量分数的方法是:称取 软锰矿样品,加入 草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,滤去杂质,将所得滤液转移到250 mL容量瓶中并定容,从中取出 待测液放入锥形瓶中,再用 标准溶液进行滴定,反应的离子方程式为: ,当滴入 溶液时恰好完全反应。
①在酸性条件下, 将 氧化的离子方程式为。
② 标准溶液应选用下图中的(填“甲”或“乙”)盛装;
③将锥形瓶置于滴定管下方进行滴定时,眼睛注视直至滴定终点;判断到达滴定终点的现象是。
④软锰矿中 的质量分数为。
32. 现有常温下的四种溶液:① 溶液 ② 溶液 ③ 的氨水 ④ 的 溶液。回答下列问题:(1)、将②③混合后所得溶液 ,则消耗溶液的体积:②(填“>”、“<”或“=”,下同)③;将③④分别稀释100倍后,比较溶液的 :③④。(2)、将②③等体积混合后,所得混合溶液中各离子浓度大小顺序为。(3)、四种溶液中,水的电离程度相同的是(填序号)。(4)、将①④混合,若有 ,则混合液呈______(填字母)。A、酸性 B、碱性 C、中性 D、三性皆有可能(5)、若改变温度后,测得④溶液 ,则该温度下水的离子积 。在该温度下,将①④混合后,测得溶液 ,则所得溶液中 。33. 请回答下列问题:(1)、某温度下,水的离子积常数Kw=2×10-13 , 0.02mol·L-1的NaOH溶液的pH=。(2)、25℃时,0.10 mol·L-1的HA溶液中 =1010 , 该HA溶液的pH=。(3)、pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pHNaOH溶液的pH(填“>”“<””或“=”)。(4)、将物质的量浓度相同的盐酸与氨水混合后,溶液中的c( )=c(Cl-),则盐酸的体积氨水的体积(填“>”“<””或“=”)。(5)、某学生用0.1 mol·L-1盐酸标准溶液滴定未知浓度的NaOH溶液,其操作步骤如下:A、移取20.00 mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。 B、用标准溶液润洗滴定管2~3次。 C、调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。 D、取标准盐酸溶液注入酸式滴定管至零刻度以上2~3 cm。 E、调节液面至零刻度(或以下),记下读数V1。 F、用标准溶液滴定至终点,记下滴定管液面的刻度V2。请写出操作步骤的正确顺序___________(填序号)。
34. 回答下列问题:(1)、下列物质: ①Cu ②SO2 ③冰醋酸 ④NaHCO3 ⑤Cu(OH )2 ⑥H2SO4溶液 ⑦NaCl,其中属于电解质的是 (填序号)。(2)、 时, 溶液的pH=。(3)、已知在25 ℃时,醋酸、碳酸和亚硫酸的电离常数如下表:醋酸
碳酸
亚硫酸
Ka=1.75×10-5
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
①由上表数据可知,Na2SO3溶液显性,其原因是(用离子方程式表示)。
② 时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为 (用字母表示)。
③工业上可用氨水除去尾气SO2 , 将SO2通入氨水中,当c(OH-)降至1.0×10-8mol/L时,溶液中的 = (保留三位有效数字)。
35. 自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,而水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题:(1)、常温下,在体积为20mL、浓度为0.1mol/LHA溶液中滴加0.1mol/LNaOH溶液,反应后溶液中水电离出的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加NaOH溶液体积的关系如图所示。
①B点溶液中,离子浓度由大到小的顺序为:。
②HA的电离常数Ka= (请用含x的代数式表示)。
(2)、常温下,已知 , 。①0.1mol/L的CH3COOK溶液和0.1mol/LHCOONa溶液相比,(填“<”、“=”或“>”)。
②向0.1mol/LHCOOH溶液中滴加相同浓度的NaOH溶液,当溶液中时,此时溶液的pH=。
(3)、工业处理废水时,常加入FeS固体除去废水中的Hg2+ , 使其生成更难溶的HgS。请用平衡移动理论解释原因 , 写出反应的离子方程式。