高考二轮复习知识点:溶液酸碱性的判断及相关计算1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 为某邻苯二酚类配体,其 , 。常温下构建溶液体系,其中 , 。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数 , 已知 , 。下列说法正确的是
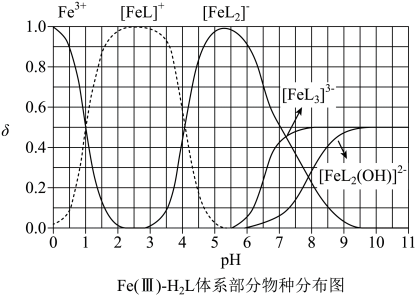 A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的2. 下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是
A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的2. 下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是 A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀3. 根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、4. 依据下列实验和现象,得出结论正确的是( )
A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀3. 根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、4. 依据下列实验和现象,得出结论正确的是( )选项
实验
现象
结论
A
点燃无色气体 ,将生成的气体通入澄清石灰水
澄清石灰水先浑浊后澄清
为
B
25℃时,向无色的 溶液中滴加1~2滴酚酞试液
溶液仍为无色
溶液的
C
在淀粉和 的混合溶液中滴加 溶液。[已知: 、 分别与卤素单质、卤素离子性质相似]
溶液仍为蓝色
氧化性:
D
在稀 中加入少量
溶液由无色变为蓝色并有红色固体生成
反应中 既作氧化剂又作还原剂
A、A B、B C、C D、D5. 25℃时,下列说法正确的是( )A、NaHA溶液呈酸性,可以推测H2A为强酸 B、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐 C、0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2 , 则α1<α2 D、100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol6. 水溶液呈碱性的正盐是( )A、 B、 C、KOH D、7. 下列溶液一定呈中性的是( )A、的溶液 B、等物质的量的强酸和强碱反应得到的溶液 C、c(H+)=c(OH-)的溶液 D、紫色石蕊试液不变色的溶液8. 常温下,向20mL浓度均为0.1mol·L-1的HA与NaA的混合溶液中,分别滴加浓度均为0.1mol·L-1的HCl、NaOH两种溶液,混合溶液的pH变化情况如图所示。下列说法正确的是( ) A、滴加HCl溶液的曲线为I B、水的电离程度:c>b>a C、d点时,lg ≈5.24 D、c点溶液中存在:c(Na+)=2[c(A-)+c(HA)]9. 已知常温下二元弱酸H2A溶液中,H2A、HA-、A2-的分布分数(δ)随pH变化如图所示[如A2-分布分数:δ(A2-)= ],下列说法错误的是( )
A、滴加HCl溶液的曲线为I B、水的电离程度:c>b>a C、d点时,lg ≈5.24 D、c点溶液中存在:c(Na+)=2[c(A-)+c(HA)]9. 已知常温下二元弱酸H2A溶液中,H2A、HA-、A2-的分布分数(δ)随pH变化如图所示[如A2-分布分数:δ(A2-)= ],下列说法错误的是( ) A、曲线x代表H2A,曲线z代表A2- B、pH从1升高至2, 的值一直减小 C、n点对应的溶液中水电离出的c(H+ )=10-12.7 mol·L-1 D、将浓度均为0.05 mol·L-1的NaHA溶液与Na2A溶液等体积混合后,所得溶液pH=4.310. 在常温下,向20mL0.10mol·L-1的Na2CO3溶液中滴加0.10mol·L-1的盐酸,溶液pH随滴定百分率%的变化如图所示。下列说法正确的( )
A、曲线x代表H2A,曲线z代表A2- B、pH从1升高至2, 的值一直减小 C、n点对应的溶液中水电离出的c(H+ )=10-12.7 mol·L-1 D、将浓度均为0.05 mol·L-1的NaHA溶液与Na2A溶液等体积混合后,所得溶液pH=4.310. 在常温下,向20mL0.10mol·L-1的Na2CO3溶液中滴加0.10mol·L-1的盐酸,溶液pH随滴定百分率%的变化如图所示。下列说法正确的( ) A、在a点的溶液中,c(H2CO3)-c(CO)> c(OH-)-c(Cl-) B、在b点的溶液中,2n(H2CO3)+ n(HCO)<0.002 mol C、煮沸目的是除去CO2 , 使突跃变大,冷却后继续滴定到终点 D、若将0.10mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时: c(Na+)=c(CH3COO-)11. 类比 , 对于稀溶液 , 。室温下,向某浓度溶液加入 , 保持溶液体积和温度不变,测得与、、变化如图所示。下列说法错误的是( )
A、在a点的溶液中,c(H2CO3)-c(CO)> c(OH-)-c(Cl-) B、在b点的溶液中,2n(H2CO3)+ n(HCO)<0.002 mol C、煮沸目的是除去CO2 , 使突跃变大,冷却后继续滴定到终点 D、若将0.10mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时: c(Na+)=c(CH3COO-)11. 类比 , 对于稀溶液 , 。室温下,向某浓度溶液加入 , 保持溶液体积和温度不变,测得与、、变化如图所示。下列说法错误的是( ) A、曲线Ⅲ表示变化 B、常温下, C、b点时, D、时,12. 下列说法正确的是( )A、25℃时,水电离出的溶液,其pH>7 B、25℃时,pH=3的HCl与pH=11的MOH溶液混合,测得pH>7,则MOH为弱碱 C、25℃时,若测得HR溶液pH=a,取该溶液10.0mL,滴入10.0mLNaR浓溶液,测得pH=b,b>a,则HR是弱酸 D、25℃时,物质的量浓度相等的盐溶液NaX与NaY,若 , 则HX为强酸13. 下列说法正确的是( )A、测得的一元碱溶液 , 则一定为弱电解质 B、25℃时,可溶性正盐溶液 , 升温至某一温度后仍为 , 则可能为强碱弱酸盐 C、25℃时,测得的一元酸溶液 , 将该溶液加水稀释100倍,所得溶液的 , 则为弱酸 D、25℃时,的溶液与的溶液等体积混合,所得溶液一定等于7.014. 已知:一元弱酸HA的电离平衡常数K =。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
A、曲线Ⅲ表示变化 B、常温下, C、b点时, D、时,12. 下列说法正确的是( )A、25℃时,水电离出的溶液,其pH>7 B、25℃时,pH=3的HCl与pH=11的MOH溶液混合,测得pH>7,则MOH为弱碱 C、25℃时,若测得HR溶液pH=a,取该溶液10.0mL,滴入10.0mLNaR浓溶液,测得pH=b,b>a,则HR是弱酸 D、25℃时,物质的量浓度相等的盐溶液NaX与NaY,若 , 则HX为强酸13. 下列说法正确的是( )A、测得的一元碱溶液 , 则一定为弱电解质 B、25℃时,可溶性正盐溶液 , 升温至某一温度后仍为 , 则可能为强碱弱酸盐 C、25℃时,测得的一元酸溶液 , 将该溶液加水稀释100倍,所得溶液的 , 则为弱酸 D、25℃时,的溶液与的溶液等体积混合,所得溶液一定等于7.014. 已知:一元弱酸HA的电离平衡常数K =。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:化学式
CH3COOH
HCN
H2CO3
K
1.75×10–5
4.9×10–10
K1 = 4.4×10–7
K2 = 5.6×10–11
下列说法正确的是( )
A、稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小 B、NaHCO3溶液中:c(H2CO3) < c() < c(HCO3−) C、25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液 D、向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO215. 常温下,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体(溶液体积变化可忽略不计),溶液中lg 随n(NaOH)的变化如图所示。下列说法错误的是( ) A、酸性强弱:HX>HY B、b点时溶液:c(Na+)=c(Y-) C、水的电离程度:c<d D、c点时溶液的pH=4
A、酸性强弱:HX>HY B、b点时溶液:c(Na+)=c(Y-) C、水的电离程度:c<d D、c点时溶液的pH=4二、多选题
-
16. 25℃时,用0.0500mol•L﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
 A、点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣) B、点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+) C、点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣) D、滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)17. (多选)常温下,向 20mL 0.1mol•L﹣1 NH4HSO4溶液中滴加 0.1mol•L﹣1 Ba(OH)2 溶液,溶液 pH 与 Ba(OH)2溶液体积的关系曲线如图所示.已知NH3•H20的电离常数Kb(NH3•H20)=1.75×10﹣5 . 下列有关分析正确的是( )
A、点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣) B、点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+) C、点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣) D、滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)17. (多选)常温下,向 20mL 0.1mol•L﹣1 NH4HSO4溶液中滴加 0.1mol•L﹣1 Ba(OH)2 溶液,溶液 pH 与 Ba(OH)2溶液体积的关系曲线如图所示.已知NH3•H20的电离常数Kb(NH3•H20)=1.75×10﹣5 . 下列有关分析正确的是( ) A、a点时溶液的pH=7 B、c点时的溶质是(NH3•H2O) C、b点时溶液中c(NH4+)>c(NH3•H2O) D、a~c段参与反应的离子有H+、OH﹣、Ba2+、SO42﹣18. 路易斯酸碱电子论认为凡是能接受电子对的物质称为路易斯酸,凡是能给出电子对的物质称为路易斯碱。下列说法错误的是( )A、NH3、BF3、H2O中,只有NH3是路易斯碱 B、根据路易斯酸碱电子论,BF3与NH3的反应属于酸碱中和反应 C、NH3、BF3和NH4BF4中均含有配位键 D、BF3的键角大于BF19. 高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( )
A、a点时溶液的pH=7 B、c点时的溶质是(NH3•H2O) C、b点时溶液中c(NH4+)>c(NH3•H2O) D、a~c段参与反应的离子有H+、OH﹣、Ba2+、SO42﹣18. 路易斯酸碱电子论认为凡是能接受电子对的物质称为路易斯酸,凡是能给出电子对的物质称为路易斯碱。下列说法错误的是( )A、NH3、BF3、H2O中,只有NH3是路易斯碱 B、根据路易斯酸碱电子论,BF3与NH3的反应属于酸碱中和反应 C、NH3、BF3和NH4BF4中均含有配位键 D、BF3的键角大于BF19. 高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( ) A、K2FeO4、H2FeO4都属于强电解质 B、由B点数据可知,H2FeO4的第一步电离常数Ka1=4.0×10-4 C、25℃,H2FeO4(aq)+H+ H3FeO4+(aq)的平衡常数K>100 D、A,C两点对应溶液中水的电离程度不相等20. 实验教学是化学学科的重要辅助手段。下列实验方案、现象、得出的结论均正确的是( )
A、K2FeO4、H2FeO4都属于强电解质 B、由B点数据可知,H2FeO4的第一步电离常数Ka1=4.0×10-4 C、25℃,H2FeO4(aq)+H+ H3FeO4+(aq)的平衡常数K>100 D、A,C两点对应溶液中水的电离程度不相等20. 实验教学是化学学科的重要辅助手段。下列实验方案、现象、得出的结论均正确的是( )选项
实验及现象
结论及解释
A
向NaCN溶液中通入少量CO2气体,生成碳酸钠(酸性:H2CO3>HCN> )
2CN-+H2O+CO2=2HCN+
B
在KSCN与FeCl3的混合液中再加入少量KCl固体,溶液颜色不变
增大Cl-浓度,平衡不移动
C
用CH3COOH溶液做导电性实验,灯泡很暗
CH3COOH是弱电解质
D
某温度下,相同pH的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸>醋酸
酸性:盐酸>醋酸
A、A B、B C、C D、D21. pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,停止电解,取出电极,将溶液摇匀,测得溶液的pH>a,则该电解质溶液是( )A、K2SO4 B、NaOH C、NaCl D、AgNO322. 部分弱酸的电离平衡常数如表所示:弱酸
电离常数/( )(25℃)
下列说法错误的是( )
A、 B、 C、中和等体积、等pH的 和 溶液,前者消耗 的量小于后者 D、等体积、等浓度的 和 溶液中,前者所含离子总数小于后者23. 煤燃烧排放的烟气含有SO2和NOx , 是大气的重要污染源之一。用Ca(ClO)2溶液对烟气[n(SO2)∶n(NO) =3∶2]同时脱硫脱硝(分别生成SO 、NO ),得到NO、SO2脱除率如图,下列说法错误的是( ) A、酸性环境下脱除NO的反应:2NO+3ClO-+H2O=2H++2NO +3Cl- B、SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO C、依据图中信息,在80 min时,吸收液中n(NO )∶n(Cl-)=2∶3 D、随着脱除反应的进行,吸收剂溶液的pH逐渐减小24. 下列有关说法正确的是( )
A、酸性环境下脱除NO的反应:2NO+3ClO-+H2O=2H++2NO +3Cl- B、SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO C、依据图中信息,在80 min时,吸收液中n(NO )∶n(Cl-)=2∶3 D、随着脱除反应的进行,吸收剂溶液的pH逐渐减小24. 下列有关说法正确的是( ) A、一定条件下反应2SO2+O2 2SO3达到平衡时,v正(O2)=2v逆(SO3) B、用如图所示方法可保护钢闸门不被腐蚀 C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大 D、常温下,pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应25. 室温时,向20mL0.1mol•L﹣1的醋酸溶液中不断滴入0.1mol•L﹣1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
A、一定条件下反应2SO2+O2 2SO3达到平衡时,v正(O2)=2v逆(SO3) B、用如图所示方法可保护钢闸门不被腐蚀 C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大 D、常温下,pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应25. 室温时,向20mL0.1mol•L﹣1的醋酸溶液中不断滴入0.1mol•L﹣1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( ) A、a点时:c( CH3COOH)>c( Na+)>c( CH3COO﹣)>c( H+)>c( OH ﹣) B、b点时:c( Na+)=c( CH3COO﹣)>c(H+)=c( OH﹣) C、c点时:c(H+)=c(CH3COOH)+c( OH﹣) D、d点时:c(Na+)>c(CH3COO ﹣)>c(OH﹣)>c(H+)
A、a点时:c( CH3COOH)>c( Na+)>c( CH3COO﹣)>c( H+)>c( OH ﹣) B、b点时:c( Na+)=c( CH3COO﹣)>c(H+)=c( OH﹣) C、c点时:c(H+)=c(CH3COOH)+c( OH﹣) D、d点时:c(Na+)>c(CH3COO ﹣)>c(OH﹣)>c(H+)三、非选择题
-
26. 用油造气的废镍催化剂(含NiCO3、Na2SiO3、少量Fe2+、Fe3+及Cr3+的化合物)制取NiSO4•7H2O的工艺流程如下图所示(CTAC一种硅酸胶体凝聚剂)。回答下列问题:
 (1)、“浸取”时,在硫酸浓度和用量、溶解时温度、搅拌速率均一定时,提高镍的回收率还可采取的措施是(写出一条)。(2)、“滤渣1”的主要成分是。(3)、“一次碱析”时,Cr(OH)3转化为的CrO 的离子方程式为。(4)、加氨水“溶解”的目的是 , ‘滤渣 2”的主要成分是。(5)、“氧化”时,HNO3被还原为NO,该反应的化学方程式为。(6)、已知0.01mol•L-1Ni(NO3)2开始沉淀时的pH为7.2,计算Ni(OH)2的Ksp=(列出计算式),则“二次碱析”使Ni2+沉淀完全时(c=1.0×10—5 mol•L-1)的pH为。27. 脱去冶金工业排放烟气中 的方法有多种。(1)、利用本生(Bunsen)热化学循环吸收 工艺由下列三个反应组成:
(1)、“浸取”时,在硫酸浓度和用量、溶解时温度、搅拌速率均一定时,提高镍的回收率还可采取的措施是(写出一条)。(2)、“滤渣1”的主要成分是。(3)、“一次碱析”时,Cr(OH)3转化为的CrO 的离子方程式为。(4)、加氨水“溶解”的目的是 , ‘滤渣 2”的主要成分是。(5)、“氧化”时,HNO3被还原为NO,该反应的化学方程式为。(6)、已知0.01mol•L-1Ni(NO3)2开始沉淀时的pH为7.2,计算Ni(OH)2的Ksp=(列出计算式),则“二次碱析”使Ni2+沉淀完全时(c=1.0×10—5 mol•L-1)的pH为。27. 脱去冶金工业排放烟气中 的方法有多种。(1)、利用本生(Bunsen)热化学循环吸收 工艺由下列三个反应组成:则 。
(2)、氧化锌吸收法:配制 悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率 随时间t的变化如图甲;溶液中部分微粒与pH的关系如图乙所示。
①为提高 的吸收效率 ,可采取的措施有:增大悬浊液中 的量、。
②图甲中的 曲线ab段发生的主要化学方程式为。
③ 时,溶液 。
(3)、如图丙所示,利用惰性电极电解含 的烟气回收S及 ,以实现废物再利用。
①阴极的电极反应式为。
②每处理含 的烟气,理论上回收S、 的物质的量分别为、。
28. 碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O H++B(OH)4- , Ka=5.7×10-10 , 碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11(1)、298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是溶液。(2)、少量CO2与B(OH)4-反应的离子方程式为。(3)、采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为。29.(1)、①25℃时,特pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合液的pH=7,则NaOH溶液与H2SO4 , 溶液的体积比为;②25℃时,pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)(填“=”“>”或“<”)c(CH3COO-)。
(2)、电解原理在化学工业中有广泛应用。如图表示一个电解泡,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
①若X、Y都是惰性电极,a是饱和NaCl溶液,)实验开始时,同时在两边各滴入几滴酚酞溶液,电解时Y电极上产生的物质是 , 该反应的总反应式是。
②如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 , Y电极的主要电极反应式为 。
(3)、化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示:实验序号
时间/浓度/温度
0
10
20
30
40
50
60
①
800℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
②
800℃
C2
0.60
0.50
0.50
0.50
0.50
0.50
③
800℃
C3
0.92
0.75
0.63
0.60
0.60
0.60
④
820℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
请根据上述数据,完成下列填空:
①在实验1中,反应在10~20min内反应物A的平均反应速率为mol/(L·min)。
②比较实验1和实验2,可推测c2=mol/L;若实验1和实验2在相同的压强下进行,但在实验2中,反应在20min时就已达到平衡,可推测实验2中还隐含的条件是
③比较实验1和实验4,可推测反应2A(g) B(g)+D(g)的正反应是(填“放热反应”或“吸热反应”)。
30. 二硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行探究。回答下列问题:(1)、在试管中加入少量三硫代碳酸钠样品,加水溶解,所得溶液pH=10,由此可知H2CS3是酸(填“强”或“弱”)。向该溶液中滴加酸性KMnO4溶液,紫色褪去,由此说明Na2CS3具有性。(2)、为了测定某Na2CS3溶液的浓度,按图装置进行实验。将35.0 mLNa2CS3溶液置于下列装置A的三颈瓶中,打开仪器d的活塞,滴入足量2.0 mol/L稀H2SO4 , 关闭活塞。
已知: CS2和H2S均有毒:CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
①仪器d的名称是。反应开始时需要先通入一段时间N2 , 其作用为。
②B中发生反应的离子方程式是。
③反应结束后打开活塞k,再缓慢通入热N2 一段时间,其目的是。
④为了计算三硫代碳酸铀溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前需要进行的实验操作名称是 , 若B中生成沉淀的质量为8.4g则35.0 mL三硫代碳酸钠溶液的物质的量浓度是。
⑤若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值<填“偏高”“偏低”或“无影响”)。
31. 油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。I.称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用c mol/LNa2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液VmL(滴定反应为:2 Na2S2O3+ I2=Na2S4O6+2NaI)。回答下列问题:
(1)、有关滴定的下列说法正确的是________(填标号)。A、标准Na2S2O3溶液应盛装在碱式滴定管中 B、滴定时眼睛只要注视滴定管中溶液体积的变化 C、滴定到溶液由无色变蓝色时应该立即停止滴定 D、同样的滴定应重复2-3次,取几次滴定所用溶液的平均值计算滴定结果(2)、该油脂的碘值为g(列式表示)。(3)、用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是。(4)、II.现要从上述测定碘值实验后的含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I-)。设计如图一所示的实验过程:
为了将含碘废液中的I2完全转化为I-而进入水层,向含碘度液中加入了稍过量的A溶液,则A应该具有性。
(5)、将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2 , 使其在30~40℃反应。反应要控制在30~40℃的原因是;Cl2不能过量,因为过量的Cl2将I2氧化为IO3- , 写出该反应的离子方程式。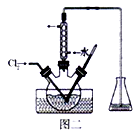 (6)、操作②包含多步操作,将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,在操作②中必须用列下列所示的部分仪器或装置,这些仪器和装置是(填标号)。
(6)、操作②包含多步操作,将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,在操作②中必须用列下列所示的部分仪器或装置,这些仪器和装置是(填标号)。 32. 亚硝酸(HNO3)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:(1)、HNO3的电离常数Ka的表达式为 .(2)、酸性条件下,K2Cr2O7能被NaNO2还原为Cr3+ , 该反应的离子方程式为 .(3)、25℃时,用0.100mol•L﹣1NaOH溶液滴定20.0mL某浓度的HNO3溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示,
32. 亚硝酸(HNO3)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:(1)、HNO3的电离常数Ka的表达式为 .(2)、酸性条件下,K2Cr2O7能被NaNO2还原为Cr3+ , 该反应的离子方程式为 .(3)、25℃时,用0.100mol•L﹣1NaOH溶液滴定20.0mL某浓度的HNO3溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示,
已知:M点对应溶液中,c(OH﹣)=c(H+)+c(HNO2).则:
①原溶液中c(HNO2)为(保留三位有效数字).
②下列关于N点对应溶液的说法正确的是(填选项字母).
A.溶液只有NaNO2
B.水电离出来的c(H+)=1×10﹣7 mol•L﹣1
C.溶液中离子浓度:c(Na+)=c(NO3﹣)
D.溶液中:c(Na+)<c(OH﹣)
33. 运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:(1)、利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+  (对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 . (2)、25℃时,将nmol•L﹣1的氨水与0.1mol•L﹣1的盐酸等体积混合.
(对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 . (2)、25℃时,将nmol•L﹣1的氨水与0.1mol•L﹣1的盐酸等体积混合.①若混合溶液中c(NH )=c(Cl﹣),则溶液的pH= .
②若混合溶液中c(NH )>c(Cl﹣),则反应的情况可能为 .
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)、在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)⇌2NH3(g)△H=bkJ•mol﹣1 , 其化学平衡常数K与温度的关系如下:温度/℃
200
300
400
K
1.0
0.86
0.5
①写出该反应的化学平衡常数的表达式: , b(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)(填“大于”“小于”或“等于”)u正(N2).
(4)、已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJ•mol﹣1②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol﹣1
写出氨高温催化氧化的热化学方程式: .
34. 根据所学知识完成下面题目:(1)、Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气.完成下列填空:
①天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在个平衡.
②一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式: . 当消耗标况下22.4升富氧空气时,有 mol电子转移.
③H2来自于天然气:CH4(g)+H2O(g)⇌3H2(g)+CO(g).如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是 . (选填编号)
a.υ正(H2):υ逆(CO)=3:1 b.气体密度不再改变
c.c(H2):c(CO)=3:1 d.气体的平均相对分子质量保持不变
(2)、Ⅱ氨水是实验室常用的弱碱.①在25℃时,将a mol/L氨水与0.01mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;amol/LNH4Cl与amol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序: .
②25℃时CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中(选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
③往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象: .
35. 甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质.上述物质转化关系如图所示(某些产物略去).
请回答下列问题:
(1)、若丁是一元强酸,甲→丁是工业生产丁的主要途径.①写出反应I的化学方程式:
②常温下,1mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: .
③在常温下,向VIL pH=11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是:(写一种即可).
(2)、若丁是二元弱酸,丙是温室气体.在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反
应:乙(g)+H2O(g)⇌丙(g)+H2(g),得到如下数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达平衡所需时间/min
乙
H2O
丙
1
650
4
2
1.6
5
2
900
2
1
0.4
3
3
900
2
1
0.4
1
①该反应的正反应为(填“吸热”或“放热”)反应.
②900℃时,上述反应按如下起始量分别加入该容器:
物质
乙
H2O
丙
H2
起始量/mol
0.8
1.0
0.6
0.8
则此时反应的v(正) v(逆)(填“>”、“<”或“=”).
③实验3跟实验2相比,改变的条件可能是 .