高考二轮复习知识点:离子浓度大小的比较5
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 取两份 的 溶液,一份滴加 的盐酸,另一份滴加 溶液,溶液的pH随加入酸(或碱)体积的变化如图。

下列说法不正确的是( )
A、由a点可知: 溶液中 的水解程度大于电离程度 B、 过程中: 逐渐减小 C、 过程中: D、令c点的 ,e点的 ,则2. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:3. 常温下,用 的盐酸分别滴定20.00mL浓度均为 三种一元弱酸的钠盐 溶液,滴定曲线如图所示。下列判断错误的是( ) A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:4. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。
A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:4. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。下列叙述错误的是( )
 A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数5. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )
A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数5. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )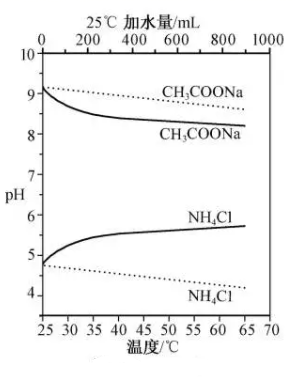 A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )6. 常温下,向1L浓度为0.1mol/LHA溶液中逐渐加入NaOH固体的过程中,主要成分的分布分数(HA或A-占含A微粒总量的百分数)随pH的变化如图所示。忽略过程中溶液体积的变化,下列说法错误的是( )
A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )6. 常温下,向1L浓度为0.1mol/LHA溶液中逐渐加入NaOH固体的过程中,主要成分的分布分数(HA或A-占含A微粒总量的百分数)随pH的变化如图所示。忽略过程中溶液体积的变化,下列说法错误的是( ) A、HA的电离常数的数量级为10-5 B、pH=5.6时,溶液中 C、加入NaOH固体的质量为2.0g时,溶液的pH>7 D、pH=7时,溶液中c(Na+)=c(A-)7. 常温下,用NaOH溶液滴定二元弱酸亚磷酸溶液,溶液中-和-lgc( )或-和-lgc( )的关系如图所示,下列说法错误的是( )
A、HA的电离常数的数量级为10-5 B、pH=5.6时,溶液中 C、加入NaOH固体的质量为2.0g时,溶液的pH>7 D、pH=7时,溶液中c(Na+)=c(A-)7. 常温下,用NaOH溶液滴定二元弱酸亚磷酸溶液,溶液中-和-lgc( )或-和-lgc( )的关系如图所示,下列说法错误的是( ) A、L2表示-和-lgc( )的关系 B、H3PO3的电离常数Ka1(H3PO3)的数量级为10-2 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c( )<c(H3PO3) D、pH=6.54时,c(Na+ )<3c()8. 室温下,通过实验探究溶液的性质并记录如下。下列说法错误的是( )
A、L2表示-和-lgc( )的关系 B、H3PO3的电离常数Ka1(H3PO3)的数量级为10-2 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c( )<c(H3PO3) D、pH=6.54时,c(Na+ )<3c()8. 室温下,通过实验探究溶液的性质并记录如下。下列说法错误的是( )实验
实验操作和现象
1
向溶液中滴加几滴酚酞试剂,溶液变红
2
向溶液中通入少量 , 产生淡黄色沉淀
3
向溶液中滴加过量溶液,产生黑色沉淀
A、实验1证明溶液中存在: B、实验1可推测出溶液中存在: C、实验2证明氧化性: D、实验3反应静置后的上层清液中存在:9. 常温下,用0.1 mol·L-1NaOH溶液滴定10 mL 0.1 mol·L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法正确的是( ) A、H2A是强酸 B、B点:c(H2A)>c(A2- ) C、C点:c(Na+)<c(HA- )+ 2c(A2-) D、水电离出来的c(OH- ):D点>C点>B点10. 柠檬酸(用表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中、、、的百分含量随的变化曲线如图所示。下列说法中错误的是( )
A、H2A是强酸 B、B点:c(H2A)>c(A2- ) C、C点:c(Na+)<c(HA- )+ 2c(A2-) D、水电离出来的c(OH- ):D点>C点>B点10. 柠檬酸(用表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中、、、的百分含量随的变化曲线如图所示。下列说法中错误的是( ) A、的第二步电离常数约为 B、溶液中,水解程度小于电离程度 C、时, D、时,11. 水溶液中存在多种平衡,下列说法正确的是( )A、稀醋酸溶液稀释时,溶液中所有离子的物质的量浓度均减小 B、水溶液中,pH=7时,溶液一定呈中性 C、物质的量浓度相等的和溶液等体积混合,则 D、用已知浓度的NaOH溶液滴定未知浓度的溶液,若选用甲基橙做指示剂,滴定过程中水的电离程度先增大后减小12. 谷氨酸[ HOOC(CH2)2CH(NH2)COOH,用H2R表示]是人体内的基本氨基酸之一,在水溶液中存在如下平衡:H2R HR-R2-。常温下,向一定浓度的H2R溶液中滴加NaOH溶液,混合溶液中lgx[x表示或]随pOH[pOH=- lgc(OH- )] 的变化如图所示。下列说法正确的是( )
A、的第二步电离常数约为 B、溶液中,水解程度小于电离程度 C、时, D、时,11. 水溶液中存在多种平衡,下列说法正确的是( )A、稀醋酸溶液稀释时,溶液中所有离子的物质的量浓度均减小 B、水溶液中,pH=7时,溶液一定呈中性 C、物质的量浓度相等的和溶液等体积混合,则 D、用已知浓度的NaOH溶液滴定未知浓度的溶液,若选用甲基橙做指示剂,滴定过程中水的电离程度先增大后减小12. 谷氨酸[ HOOC(CH2)2CH(NH2)COOH,用H2R表示]是人体内的基本氨基酸之一,在水溶液中存在如下平衡:H2R HR-R2-。常温下,向一定浓度的H2R溶液中滴加NaOH溶液,混合溶液中lgx[x表示或]随pOH[pOH=- lgc(OH- )] 的变化如图所示。下列说法正确的是( ) A、K1=1×10-9.7 B、pH=7时,c(HR-)>c(H2R)>c(R2-) C、曲线II表示pOH与lg的变化关系 D、M点时,c(H+ )+c(Na+ )=c(OH-)+3c(HR-)13. 三甲胺[N(CH3)3]是一种一元有机弱碱,可简写为MOH。常温下,向20mL0.5mol/LMOH溶液中逐滴加入浓度为0.25mol/L的HCl溶液,溶液中 , 、中和率(中和率=被中和的MOH的物质的量/反应前MOH的总物质的量)的变化如图所示。下列说法错误的是( )
A、K1=1×10-9.7 B、pH=7时,c(HR-)>c(H2R)>c(R2-) C、曲线II表示pOH与lg的变化关系 D、M点时,c(H+ )+c(Na+ )=c(OH-)+3c(HR-)13. 三甲胺[N(CH3)3]是一种一元有机弱碱,可简写为MOH。常温下,向20mL0.5mol/LMOH溶液中逐滴加入浓度为0.25mol/L的HCl溶液,溶液中 , 、中和率(中和率=被中和的MOH的物质的量/反应前MOH的总物质的量)的变化如图所示。下列说法错误的是( ) A、a点时, B、b点时, C、溶液中水的电离程度:c点>d点 D、三甲胺[N(CH3)3]的电离常数为14. 常温下,几种弱电解质的电离常数如下表所示:
A、a点时, B、b点时, C、溶液中水的电离程度:c点>d点 D、三甲胺[N(CH3)3]的电离常数为14. 常温下,几种弱电解质的电离常数如下表所示:下列说法正确的是( )
A、溶液呈中性,溶液中水的电离程度与纯水的电离程度相同 B、溶液中: C、等浓度的与混合溶液中: D、水溶液显碱性15. 室温下,向20mL浓度均为0.1的和混合液中逐滴加入0.1 NaOH溶液,溶液pH变化曲线如图。下列说法错误的是( ) A、a点: B、导电能力:b<c C、c点: D、由d点可得
A、a点: B、导电能力:b<c C、c点: D、由d点可得二、多选题
-
16. 25℃时,下列指定溶液中微粒的物质的量浓度关系正确的是( )A、0.1mol·L-1Na2S溶液中:c(OH-)= c(H2S) + c(HS-) B、0.1mol·L-1 CH3COONH4溶液中:c(NH4+)+ c(NH3·H2O)=c(CH3COO-) +c(CH3COOH) C、0.1mol·L-1pH=6的NaHSO3溶液中:c(Na+) >c(HSO ) >c(SO )>c(H2SO3) D、0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合所得溶液中:c(CO ) >c(HCO3-) >c(OH-) >c(H2CO3)17. 25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )A、0.1mol•L﹣lNaHC2O4溶液(pH=5.5):c(Na+)>c( HC2O4﹣)>c(H2C2O4)>c(C2O42﹣ ) B、0.1mol•L﹣1NaHS 溶液:C(OH﹣)+c(S2﹣)=c( H+)+c(H2S) C、0.1mol•L﹣1CH3COOH 溶液和 0.1mol•L﹣1CH3COONa 溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c( OH﹣) D、0.1mol•L﹣lNH4HSO4 溶液中滴加 0.1mol•L﹣1NaOH 溶液至中性:c(Na+ )>c(SO42﹣ )>c(NH4+ )>c(OH﹣)=c(H+)18. 下列有关物质浓度关系的描述中,正确的是( )A、25℃时,NaB溶液的pH=8,c(Na+)﹣c(B﹣)=9.9×10﹣7mol•L﹣1 B、25℃时,向0.1mol•L﹣1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42﹣)>c(OH﹣)=c(H+) C、0.1mol•L﹣1的NaHCO3溶液中:c(OH﹣)+2c(CO32﹣)=c(H+)+c(H2CO3) D、同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)19. 在两份相同的溶液中,分别滴入物质的量浓度相等的、溶液,其导电能力的变化曲线如图所示。下列说法错误的是( )
 A、①代表滴加溶液的变化曲线 B、b点,溶液中大量存在的离子是、 C、c点,两溶液中含有相同物质的量的 D、a点对应的溶液显中性,d点对应溶液显碱性20. 常温下,下列各溶液的叙述中正确的是( )A、pH=9的CH3COONa溶液和pH=5的NH4Cl溶液,两者中水的电离程度相同 B、pH<7的NaHSO3溶液中:c(Na+)>c(HSO)>c(H2SO3)>c(SO)>c(H+) C、向NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+) D、浓度相同的Na2CO3溶液与NaHCO3溶液等体积混合,混合后溶液中:c(OH-)-c(H+)=c(HCO)+3c(H2CO3)-c(CO)21. 室温下,用NaOH溶液滴定溶液,溶液中和[或和]的关系如图所示,下列说法正确的是(忽略混合溶液体积和温度的变化)( )
A、①代表滴加溶液的变化曲线 B、b点,溶液中大量存在的离子是、 C、c点,两溶液中含有相同物质的量的 D、a点对应的溶液显中性,d点对应溶液显碱性20. 常温下,下列各溶液的叙述中正确的是( )A、pH=9的CH3COONa溶液和pH=5的NH4Cl溶液,两者中水的电离程度相同 B、pH<7的NaHSO3溶液中:c(Na+)>c(HSO)>c(H2SO3)>c(SO)>c(H+) C、向NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+) D、浓度相同的Na2CO3溶液与NaHCO3溶液等体积混合,混合后溶液中:c(OH-)-c(H+)=c(HCO)+3c(H2CO3)-c(CO)21. 室温下,用NaOH溶液滴定溶液,溶液中和[或和]的关系如图所示,下列说法正确的是(忽略混合溶液体积和温度的变化)( ) A、原溶液中 B、当溶液中时,溶液的 C、当滴定至时,溶液中微粒之间的关系为 D、当滴定至恰好完全反应时,溶液中存在22. 已知常温下,向20mL0.1mol·L-1的HA溶液中,滴入0.1mol·L-1的NaOH溶液,所得滴定曲线如下图所示,下列说法错误的是( )
A、原溶液中 B、当溶液中时,溶液的 C、当滴定至时,溶液中微粒之间的关系为 D、当滴定至恰好完全反应时,溶液中存在22. 已知常温下,向20mL0.1mol·L-1的HA溶液中,滴入0.1mol·L-1的NaOH溶液,所得滴定曲线如下图所示,下列说法错误的是( ) A、若A点的pH=3,则HA为一元弱酸,其电离平衡常数的数量级为10-5 B、B点各微粒物质的量浓度的关系是:2c(H+)+c(A-)=2c(OH-)+c(HA) C、C点存在关系式:c(A-)=c(Na+) D、若D点的pH=8.4,则水电离出的c(H+)=10-8.4mol·L-123. 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
A、若A点的pH=3,则HA为一元弱酸,其电离平衡常数的数量级为10-5 B、B点各微粒物质的量浓度的关系是:2c(H+)+c(A-)=2c(OH-)+c(HA) C、C点存在关系式:c(A-)=c(Na+) D、若D点的pH=8.4,则水电离出的c(H+)=10-8.4mol·L-123. 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( ) A、b、c两点溶液的导电能力b>c B、用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb<Vc C、c点溶液中c(H+)=c(OH-)+c(CH3COOH) D、a、b、c三点溶液中水的电离程度a>c>b24. 室温下,向20 mL 0.10 mol·L-1的CH3COOH溶液中逐滴加入0.10 mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。若溶液混合引起的体积变化可忽略,下列指定溶液中微粒物质的量浓度关系正确的是( )
A、b、c两点溶液的导电能力b>c B、用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb<Vc C、c点溶液中c(H+)=c(OH-)+c(CH3COOH) D、a、b、c三点溶液中水的电离程度a>c>b24. 室温下,向20 mL 0.10 mol·L-1的CH3COOH溶液中逐滴加入0.10 mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。若溶液混合引起的体积变化可忽略,下列指定溶液中微粒物质的量浓度关系正确的是( ) A、b点溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) B、c、e两点溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) C、d点溶液中:c(Na+)+c(CH3COO-)+c(CH3COOH)=0.10 mol·L-1 D、f点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)25. 室温下,向10mL0.10mol·L-1的HA(Ka=1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。若溶液混合引起的体积变化可忽略,下列说法正确的是( )
A、b点溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) B、c、e两点溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) C、d点溶液中:c(Na+)+c(CH3COO-)+c(CH3COOH)=0.10 mol·L-1 D、f点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)25. 室温下,向10mL0.10mol·L-1的HA(Ka=1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。若溶液混合引起的体积变化可忽略,下列说法正确的是( ) A、a点时,c(Na+)-c(HA)=c(OH-)-c(H+) B、由a→b,溶液中n(A-)持续增大 C、b点时,c(Na+)=c(HA)+c(A-)+c(OH-) D、V=10mL时,c(HA)+c(A-)+c(Na+)=0.20mol·L-1
A、a点时,c(Na+)-c(HA)=c(OH-)-c(H+) B、由a→b,溶液中n(A-)持续增大 C、b点时,c(Na+)=c(HA)+c(A-)+c(OH-) D、V=10mL时,c(HA)+c(A-)+c(Na+)=0.20mol·L-1三、非选择题
-
26. 磷酸二氢钾(KH2PO4)是一种高效磷钾复合肥,以氟磷灰石[主要成分为Ca5(PO4)3F,还含有少量Fe3O4]为原料制备KH2PO4的一种工艺流程如图所示:
 (1)、酸浸前需将氟磷灰石粉碎成粉末,其目的是。(2)、“酸浸”时发生反应的化学方程式有Ca5(PO4)3F+5H2SO4=5CaSO4+3H3PO4+HF↑,该反应体现了硫酸的性和难挥发性,酸浸时(填“能”或“不能”)使用玻璃容器。(3)、“氧化”时发生反应的离子方程式为。(4)、利用平衡移动原理和相关化学用语解释加入CaCO3调节pH形成Fe(OH)3沉淀的原因:;室温下,当pH=3时,溶液中Fe3+开始沉淀,此时溶液中c(Fe3+)=mol•L-1 , 溶液中Fe3+完全沉淀的pH=。(已知室温下Fe(OH)3的Ksp=1×10-35 , 且加入碳酸钙过程中溶液体积变化忽略不计)(5)、常温下磷酸的电离平衡常数如表所示:
(1)、酸浸前需将氟磷灰石粉碎成粉末,其目的是。(2)、“酸浸”时发生反应的化学方程式有Ca5(PO4)3F+5H2SO4=5CaSO4+3H3PO4+HF↑,该反应体现了硫酸的性和难挥发性,酸浸时(填“能”或“不能”)使用玻璃容器。(3)、“氧化”时发生反应的离子方程式为。(4)、利用平衡移动原理和相关化学用语解释加入CaCO3调节pH形成Fe(OH)3沉淀的原因:;室温下,当pH=3时,溶液中Fe3+开始沉淀,此时溶液中c(Fe3+)=mol•L-1 , 溶液中Fe3+完全沉淀的pH=。(已知室温下Fe(OH)3的Ksp=1×10-35 , 且加入碳酸钙过程中溶液体积变化忽略不计)(5)、常温下磷酸的电离平衡常数如表所示:名称
Ka1
Ka2
Ka3
磷酸
5.2×10-3
8×10-8
6×10-13
则常温下KH2PO4水溶液显(填“酸”“碱”或“中”)性,下列有关KH2PO4水溶液中的微粒关系正确的是(填标号)。
A.c(H2PO)>c(H3PO4)>c(HPO)>c(PO)
B.c(K+)+c(H+)=c(H2PO)+2c(HPO)+3c(PO)
C.c(K+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO)
27. 完成下列填空(1)、氯化铝水溶液呈性,(填“酸”、“中”、“碱”)原因是:(用离子方程式表示)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(2)、硫化钠溶于水时发生水解,其水解的离子方程为: , 在配制硫化钠溶液时可以加入少量的以抑制其水解。(3)、将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”,下同)。(4)、pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 , 溶液中c(Na+)c(CH3COO-)。28. 回答下列问题:(1)、某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中,a点对应的酸为(填名称),该酸溶液稀释过程中,下列各量一定变小的是。(填序号)
a.c(H+) b.c(OH-) c. d.
(2)、在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1 , c(OH-)=10-bmol·L-1 , 已知a+b=12,则在该温度下,将100mL0.1mol·L-1的稀H2SO4与100mL0.4mol·L-1的NaOH溶液混合后,溶液的pH=。(3)、25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则ab(填“>”、“<”或“=”),此时溶液中c(CH3COO-)+c(CH3COOH)=mol·L-1(用字母表示)29.(1)、氯化铝水溶液呈性,(填“酸”、“中”、“碱”)原因是:(用离子方程式表示)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(2)、硫化钠溶于水时发生水解,其水解的离子方程为: , 在配制硫化钠溶液时可以加入少量的以抑制其水解。(3)、将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”,下同)。(4)、pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 , 溶液中c(Na+)c(CH3COO-)。30. 酸、碱、盐是中学化学学习的重要化合物,请依据其性质回答下列问题。(1)、常温下,小苏打溶液pH7(填“>”、“=”或“<”),其理由是(用离子方程式表示),溶液中(填“>”、“=”或“<”)。(2)、常温下,将体积均为、均为12的氨水和溶液分别加水稀释至1L,溶液较大的是 , 稀释后溶液的(填“>”、“=”或“<”)。(3)、相同温度下,浓度均为的下列溶液:①②③④ , 溶液中的浓度由大到小的顺序为(用序号表示)。(4)、已知与相似,水溶液具有弱碱性,其电离方程式为:。常温下,现用盐酸滴定溶液,溶液中由水电离出的的负对数[]与所加盐酸体积的关系如图所示(已知:)
①R、Q两点溶液pH关系是:RQ(填“>”、“=”或“<”),R、Q两点对应溶液中水的电离程度的关系:RQ(填“>”、“=”或“<”)。
②滴定过程中,若 , 则此时溶液中。
③N点离子浓度由大到小的顺序为。
31.(1)、I.根据表中数据(常温下),完成下列填空。物质
CH3COOH
NH3∙H2O
HCN
HClO
H2CO3
H2SO3
电离常数(Ka)
1.7×10−5
1.7×10−5
4.9×10−10
3×10−8
Ka1=4.3×10−7
Ka2=5.6×10−11
Ka1=1.5×10−2
Ka2=1.0×10−7
常温下,NaCN溶液呈(填“酸”、“碱”或“中”)性,其原因是(用离子方程式表示)。
(2)、常温下,浓度均为0.1 mol∙L−1的下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是(填序号)。(3)、常温下,向NaClO溶液中通入少量CO2 , 发生反应的离子方程式为。(4)、常温下,Na2SO3溶液中c(OH-)−c(H+)=c(HSO)+。(5)、II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg∙L−1。处理含镉废水可采用化学沉淀法。Ksp(CdCO3)=4.0×10−12 , Ksp(CdS)=8.0×10−27;回答下列问题:向某含镉废水中加入Na2S,当S2−浓度达到8.0×10−8 mol∙L−1时,废水中Cd2+的浓度为mol∙L−1 , 此时是否符合生活饮用水卫生标准?(填“是”或“否”)。
(6)、室温下,反应CdCO3(s)+S2−(aq)CdS(s)+CO(aq)达到平衡,该反应的平衡常数K=(结果保留两位有效数字)32. 利用“价类二维图”对元素及其化合物进行相关归纳整理,是一种常用的学习研究方法。硫及其化合物的“价类二维图”如图所示,回答下列问题: (1)、M的化学式为 , 除去中少量的杂质可选择的试剂有(填正确答案标号)。
(1)、M的化学式为 , 除去中少量的杂质可选择的试剂有(填正确答案标号)。A.饱和溶液 B.碱石灰 C.饱和溶液 D.酸性高锰酸钾溶液
(2)、工业上实现①过程生产常采用废铜料与稀硫酸在通入空气并加热的条件下反应制取,其反应的离子方程式为。(3)、的水溶液中各离子的浓度大小关系是 , 检验溶液是否变质的方法是。(4)、实验室欲制备 , 从氧化还原角度分析,下列合理的药品选择是____(填正确答案标号)。A、和 B、和 C、和S D、和(5)、已知:常温下的电离平衡常数 , , , 忽略第二步电离,则溶液的pH约为(保留1位小数)。33. 室温下,用滴定溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。 (1)、酸碱式滴定管在加溶液滴定前,需要的操作是和。(2)、配制上述NaOH标准溶液时,下列仪器中不必要用到的有。(用编号表示)
(1)、酸碱式滴定管在加溶液滴定前,需要的操作是和。(2)、配制上述NaOH标准溶液时,下列仪器中不必要用到的有。(用编号表示)①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(3)、当时,溶液中所有离子的浓度存在的关系是。(4)、已知 , 当加入的时,溶液中pH=。(5)、下列说法不正确的是____。A、NaOH与盐酸恰好完全反应时, B、选择甲基红指示反应终点,误差比甲基橙的大 C、当接近滴定终点时,极少量的碱就会引起溶液的pH突变 D、选择变色范围在pH突变范围内的指示剂,可减小实验误差 E、当用滴定溶液时,其突变范围比滴定溶液的突变范围大(6)、在化学分析中,以标准溶液滴定溶液中的时,采用为指示剂,利用和反应生成砖红色沉淀表示滴定终点。当溶液中的恰好完全沉淀时,溶液中的;。已知:①25℃时, ,
②当溶液中某种离子的浓度等于或小于时,可认为已完全沉淀。
34. 我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。(1)、镓的原子结构示意图为 , 镓元素在元素周期表中的位置是。 (2)、GaAs的熔点为1238℃且熔融状态不导电,据此判断它是(填“共价”或“离子”)化合物。(3)、镓与氨气在1100℃下反应生成氮化镓和氢气,该可逆反应每生成1molH2放出10.3kJ热量。该反应的热化学方程式是。(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)(4)、As与P同族且相邻。磷的最外层电子轨道表示式。预测As的氢化物分子的空间结构 , 其沸点比NH3的(填“高”或“低”),理由是。(5)、下列说法不正确的是。
, 镓元素在元素周期表中的位置是。 (2)、GaAs的熔点为1238℃且熔融状态不导电,据此判断它是(填“共价”或“离子”)化合物。(3)、镓与氨气在1100℃下反应生成氮化镓和氢气,该可逆反应每生成1molH2放出10.3kJ热量。该反应的热化学方程式是。(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)(4)、As与P同族且相邻。磷的最外层电子轨道表示式。预测As的氢化物分子的空间结构 , 其沸点比NH3的(填“高”或“低”),理由是。(5)、下列说法不正确的是。a.镓的金属性比铝的强 b.砷化镓具有半导体性质
c.As与H2在低温时可剧烈化合为AsH3 d.酸性:H2SO4>H3PO4>H3AsO4
亚砷酸(H3AsO3)可以用于治疗白血病。亚砷酸溶液中各种微粒物质的量分数与溶液pH关系如图所示。
 (6)、人体血液的pH在7.35—7.45之间,患者用药后人体中含As元素的主要微粒是。通常情况下,H2AsO电离程度水解程度(填“>、<、=”)。(7)、以酚酞作指示剂,将KOH溶液滴入亚砷酸溶液,滴定终点发生的离子反应是。交点b的溶液中:c(K+)2c(HAsO)+4c(AsO)(填“>、<、=”)。35. 二氧化硫是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。(1)、利用吸收的离子方程式为:
(6)、人体血液的pH在7.35—7.45之间,患者用药后人体中含As元素的主要微粒是。通常情况下,H2AsO电离程度水解程度(填“>、<、=”)。(7)、以酚酞作指示剂,将KOH溶液滴入亚砷酸溶液,滴定终点发生的离子反应是。交点b的溶液中:c(K+)2c(HAsO)+4c(AsO)(填“>、<、=”)。35. 二氧化硫是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。(1)、利用吸收的离子方程式为:+□ (在“□”里填入系数在“ ”上填入微粒符号),加入可以提高去除率,原因是。
(2)、工业上还常用氨水吸收法处理 , 可生成或。①显碱性,结合化学用语,用化学平衡原理解释其原因:。
②显酸性。用氨水吸收 , 当吸收液显中性时溶液中离子浓度关系正确的是(填字母)。
a.
b.
c.
(3)、某工厂烟气中主要含、 , 在较高温度经下图所示方法脱除并制得。
①在阴极放电的物质是。
②在阳极生成的电极反应式是。