高考二轮复习知识点:离子浓度大小的比较4
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是(如 分布分数: )( )
 A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、2. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中3. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、2. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中3. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
下列说法正确的的是( )
A、图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 B、当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO+H+=CO2↑+H2O C、根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 D、Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)4. 常温下用0.1000 mol∙L−1盐酸滴定25mL0.1000 mol∙L−1Na2CO3溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法正确的是 A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)5. 常温下,用0.1000mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000 mol·L-1 CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是
A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)5. 常温下,用0.1000mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000 mol·L-1 CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是 A、点①时:c(CN-)>c(Na+)> c(HCN) >c(OH-) B、点②时:c(CH3COO-)-c(CH3COOH)=2c(H+)+2c(OH-) C、c(CH3COOH)+c(CH3COO-)+c(Na+)的值:③点等于④点 D、恰好完全中和时,将两种溶液混合后:c(HCN)+c(CH3COOH)>c(OH-)-c(H+)6. 常温下,将溶液滴加到20mL二元弱酸溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述错误的是( )
A、点①时:c(CN-)>c(Na+)> c(HCN) >c(OH-) B、点②时:c(CH3COO-)-c(CH3COOH)=2c(H+)+2c(OH-) C、c(CH3COOH)+c(CH3COO-)+c(Na+)的值:③点等于④点 D、恰好完全中和时,将两种溶液混合后:c(HCN)+c(CH3COOH)>c(OH-)-c(H+)6. 常温下,将溶液滴加到20mL二元弱酸溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述错误的是( ) A、 B、b点时溶液中存在 C、c点时溶液中存在 D、溶液中水的电离程度:c>b>a7. 用溶液吸收一定量的气体,为测定反应后溶液的成分,用的溶液滴定待测液,先用酚酞作指示剂,消耗盐酸 , 再滴加甲基红为指示剂,消耗盐酸为 , 下列说法错误的是( )A、当时,溶液溶质为 B、当 , , 溶液中发生的反应为 C、当 , 时,待测液中, D、当 , 时,待测液中,的浓度为8. 图(Ⅰ)和图(Ⅱ)分别为二元酸和乙二胺()溶液中各组分的百分含量随溶液pH的变化曲线(25℃)。
A、 B、b点时溶液中存在 C、c点时溶液中存在 D、溶液中水的电离程度:c>b>a7. 用溶液吸收一定量的气体,为测定反应后溶液的成分,用的溶液滴定待测液,先用酚酞作指示剂,消耗盐酸 , 再滴加甲基红为指示剂,消耗盐酸为 , 下列说法错误的是( )A、当时,溶液溶质为 B、当 , , 溶液中发生的反应为 C、当 , 时,待测液中, D、当 , 时,待测液中,的浓度为8. 图(Ⅰ)和图(Ⅱ)分别为二元酸和乙二胺()溶液中各组分的百分含量随溶液pH的变化曲线(25℃)。
下列说法正确的是( )
A、根据图(Ⅰ),滴定分析时,可用酚酞作指示剂指示滴定终点 B、溶液显碱性 C、pH=4.02时, D、向溶液中通入一定量的HCl气体,则可能增大也可能减小9. 已知25℃时,的 的溶液用固体调整溶液的值,设体积不发生改变,下列说法正确的是( )A、溶液的电离度约为1.0% B、NaHS水溶液呈现碱性,温度升高溶液一定升高 C、当溶液的时,溶液中的 D、当溶液的时,溶液中的10. 室温下,通过下列实验探究NaHC2O4(Kh为NaHC2O4水解平衡常数、Ka1、Ka2分别为H2C2O4第一、二步电离平衡常数)溶液的性质。实验
实验操作和现象
1
用试纸测定0.1mol·L-1NaHC2O4溶液的pH,测得约为5.5
2
向含0.1molNaHC2O4稀溶液中加入0.05molBa(OH)2 , 产生沉淀BaC2O4
3
向0.1mol·L-1NaHC2O4溶液中通入过量HCl,无现象
4
向0.1mol·L-1NaHC2O4溶液中通入一定量NH3 , 测得溶液pH=7
下列有关说法正确的是( )
A、实验1可知该条件下:Kh>Ka2 B、实验2反应静置后的上层清液中:c(Na+)>c(C2O)>c(HC2O)>c(OH-) C、实验3得到的溶液中:c(Na+)>c(Cl-)>c(H2C2O4)>c(H+) D、实验4所得的溶液中:c(NH)+c(H2C2O4)=c(C2O)11. 室温下,将NaOH溶液滴加到H2X溶液中,混合溶液中离子浓度的变化与pH的关系如图所示。下列说法错误的是( ) A、H2X的Ka2数量级为10-8 B、当混合溶液pH=3时,c(HX- )= 10c(H2X) C、混合溶液呈中性时c(Na+)> 3c(HX- ) D、NaHX溶液中存在c(H2X)<c(OH- )+c(X2-)12. 25℃时 ,在锥形瓶中加入25.00mL 0.1000mol·L-1H2C2O4溶液,加入指示剂,然后用0.1000mol·L1NaOH 溶液滴定,得到如图所示溶液的pH随滴加NaOH溶液的体积的变化曲线。下列说法正确的是(已知:10-1.3=0.05)( )
A、H2X的Ka2数量级为10-8 B、当混合溶液pH=3时,c(HX- )= 10c(H2X) C、混合溶液呈中性时c(Na+)> 3c(HX- ) D、NaHX溶液中存在c(H2X)<c(OH- )+c(X2-)12. 25℃时 ,在锥形瓶中加入25.00mL 0.1000mol·L-1H2C2O4溶液,加入指示剂,然后用0.1000mol·L1NaOH 溶液滴定,得到如图所示溶液的pH随滴加NaOH溶液的体积的变化曲线。下列说法正确的是(已知:10-1.3=0.05)( ) A、滴定前,锥形瓶要用0.1000mol·L-1H2C2O4溶液润洗 B、Ka1(H2C2O4)= 10-1.6 C、图中c点溶液离子浓度大小为: c(Na+ )>c()>c( )>c(H2C2O4) D、a点溶液中: c(OH -)+c( )=c(H2C2O4)+c(H+)13. 赖氨酸[H2N(CH2)4CH(NH2)COOH,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+H2R+HRR-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。.已知δ(x)=。下列表述正确的是( )
A、滴定前,锥形瓶要用0.1000mol·L-1H2C2O4溶液润洗 B、Ka1(H2C2O4)= 10-1.6 C、图中c点溶液离子浓度大小为: c(Na+ )>c()>c( )>c(H2C2O4) D、a点溶液中: c(OH -)+c( )=c(H2C2O4)+c(H+)13. 赖氨酸[H2N(CH2)4CH(NH2)COOH,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+H2R+HRR-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。.已知δ(x)=。下列表述正确的是( ) A、已知CH3COOH的电离平衡常数Ka=1.75×10-5 , 则H2R+与CH3COO-不能大量共存 B、N点,向溶液中加入少量NaOH溶液发生反应的离子方程式为:H2R++OH-=H2O+HR C、M点,c(Na+)>c(Cl-)>c(H+)>c(OH-) D、P点,c(Cl-)+c(OH-)+c(HR)=c(H2R+)+2c(H3R2+)+c(H+)
A、已知CH3COOH的电离平衡常数Ka=1.75×10-5 , 则H2R+与CH3COO-不能大量共存 B、N点,向溶液中加入少量NaOH溶液发生反应的离子方程式为:H2R++OH-=H2O+HR C、M点,c(Na+)>c(Cl-)>c(H+)>c(OH-) D、P点,c(Cl-)+c(OH-)+c(HR)=c(H2R+)+2c(H3R2+)+c(H+)二、多选题
-
14. 赖氨酸[H3N+(CH2)4CH(NH2)COO- , 用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+ HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述正确的是( )
 A、 > B、M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) C、O点,pH= D、P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)15. 25℃时,向 的 溶液中滴加 的盐酸,溶液的 随加入的盐酸的体积 变化如图所示。下列有关说法正确的是( )
A、 > B、M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) C、O点,pH= D、P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)15. 25℃时,向 的 溶液中滴加 的盐酸,溶液的 随加入的盐酸的体积 变化如图所示。下列有关说法正确的是( )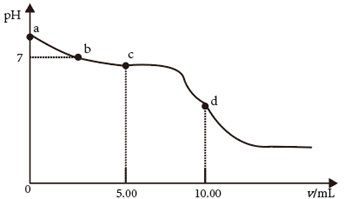 A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,16. 常温下,下列溶液中的微粒浓度关系正确的是( )A、0.1mol·L-1HCl溶液与0.2mol·L-1氨水等体积混合(pH>7):c(Cl-)>c(NH)>c(NH3·H2O)>c(OH-) B、向K2CO3和KHCO3的混合溶液中加入少量CaCl2 , 溶液中存在:< C、NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH)>c(SO)>c(OH-)=c(H+) D、已知H3PO3为二元酸,则0.4mol·L-1氨水与0.2mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO)+2c(H3PO3)+0.1mol·L-117. 叠氮酸(HN3)是一种弱酸。常温下,向20 mL 0.1 mol·L-1的HN3溶液中逐滴加入0.1 mol·L-1NaOH溶液。测得滴定过程电溶液的pH随V(NaOH)变化如图所示,下列说法正确的是( )
A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,16. 常温下,下列溶液中的微粒浓度关系正确的是( )A、0.1mol·L-1HCl溶液与0.2mol·L-1氨水等体积混合(pH>7):c(Cl-)>c(NH)>c(NH3·H2O)>c(OH-) B、向K2CO3和KHCO3的混合溶液中加入少量CaCl2 , 溶液中存在:< C、NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH)>c(SO)>c(OH-)=c(H+) D、已知H3PO3为二元酸,则0.4mol·L-1氨水与0.2mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO)+2c(H3PO3)+0.1mol·L-117. 叠氮酸(HN3)是一种弱酸。常温下,向20 mL 0.1 mol·L-1的HN3溶液中逐滴加入0.1 mol·L-1NaOH溶液。测得滴定过程电溶液的pH随V(NaOH)变化如图所示,下列说法正确的是( )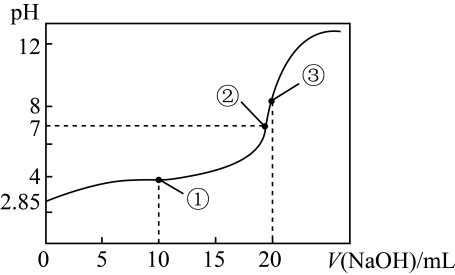 A、点①溶液中:c(HN3)+c(H+)<c(N)+c(OH-) B、点②溶液中:c(Na+)=c(N)+c(HN3) C、常温下,Ka(HN3)的数量级为10-4 D、点③溶液中:c(OH-)=c(H+)+c(HN3)18. NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸的 , )溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
A、点①溶液中:c(HN3)+c(H+)<c(N)+c(OH-) B、点②溶液中:c(Na+)=c(N)+c(HN3) C、常温下,Ka(HN3)的数量级为10-4 D、点③溶液中:c(OH-)=c(H+)+c(HN3)18. NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸的 , )溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是( )
A、混合溶液的导电能力与离子浓度和种类有关 B、a点溶液中: C、b点溶液中: D、c点溶液中:19. 室温下,向20mL 的HA溶液中逐滴加入NaOH溶液(忽略溶液体积变化),溶液中由水电离出的浓度的负对数与NaOH溶液体积关系如图所示。下列说法错误的是( ) A、b点溶液中 B、c点和e点溶液均呈中性 C、在滴加过程中,先减小后增大 D、室温下,的HA溶液中20. 常温下,用的盐酸滴定20.00mL浓度为的氨水[已知:常温下],测得滴定过程中溶液的电导率变化曲线如图所示。下列说法错误的是( )
A、b点溶液中 B、c点和e点溶液均呈中性 C、在滴加过程中,先减小后增大 D、室温下,的HA溶液中20. 常温下,用的盐酸滴定20.00mL浓度为的氨水[已知:常温下],测得滴定过程中溶液的电导率变化曲线如图所示。下列说法错误的是( ) A、a点溶液浓度约为 B、b点溶液: C、c点溶液 D、d点溶液21. 已知部分弱电解质的电离平衡常数如下表:
A、a点溶液浓度约为 B、b点溶液: C、c点溶液 D、d点溶液21. 已知部分弱电解质的电离平衡常数如下表:弱电解质
CH3COOH
H2CO3
HClO
NH3∙H2O
电离平衡常数
(25℃)
常温下,下列分析正确的是( )
A、pH相同的①CH3COONa②NaHCO3③NaClO溶液中的c(Na+):③>②>① B、0.1 mol∙L-1CH3COONH4溶液中:c(NH4+)=c(CH3COO-) C、中和等体积等浓度的醋酸和次氯酸,需要NaOH的物质的量相同 D、反应+ CH3COOH = CH3COO-+ H2CO3 , K=2.4×10-322. 25℃时,用HCl气体调节氨水的pH,溶液中微粒浓度的对数值()、反应物的物质的量之比与pH的关系如图。若忽略通入气体后溶液体积的变化,下列说法错误的是( ) A、所示溶液中: B、所示溶液中: C、所示溶液中: D、25℃时,的电离平衡常数为23. 常温时,向水溶液中逐滴滴加溶液,混合溶液中和的物质的量分数随变化的关系如图所示。下列说法正确的是( )
A、所示溶液中: B、所示溶液中: C、所示溶液中: D、25℃时,的电离平衡常数为23. 常温时,向水溶液中逐滴滴加溶液,混合溶液中和的物质的量分数随变化的关系如图所示。下列说法正确的是( ) A、的的数量级为 B、溶液呈碱性 C、的溶液中: D、的溶液中:24. 下列描述错误的是( )A、往溶液中加水,增大 B、在滴有酚酞的溶液中慢慢滴入溶液至过量,溶液的红色褪去 C、相同的①、②、③三种溶液中:①>②>③ D、在水电离出的的溶液中,一定不可能大量存在25. 马来酸(用H2B表示)是一种二元弱酸,25℃时,某混合溶液中c(H2B) +c(HB-) +c(B2-) = 0.1mol·L-1 , 测得H2B、HB-、B2-及OH-等离子的pC(pC=-lgc)随溶液pH的变化关系如图所示。下列说法正确的是( )
A、的的数量级为 B、溶液呈碱性 C、的溶液中: D、的溶液中:24. 下列描述错误的是( )A、往溶液中加水,增大 B、在滴有酚酞的溶液中慢慢滴入溶液至过量,溶液的红色褪去 C、相同的①、②、③三种溶液中:①>②>③ D、在水电离出的的溶液中,一定不可能大量存在25. 马来酸(用H2B表示)是一种二元弱酸,25℃时,某混合溶液中c(H2B) +c(HB-) +c(B2-) = 0.1mol·L-1 , 测得H2B、HB-、B2-及OH-等离子的pC(pC=-lgc)随溶液pH的变化关系如图所示。下列说法正确的是( )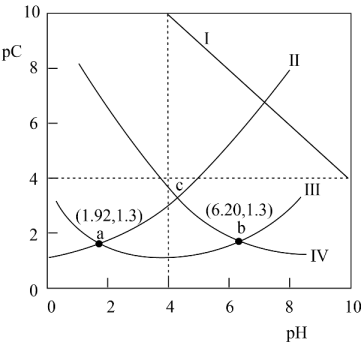 A、该温度下,马来酸的电离平衡常数Ka1 =10-1.92 B、当溶液中=2时,pH=3.15 C、pH=7时,溶液中c(B2-)>c(H2B) >c(HB- ) >c(OH - ) D、混合溶液中c(HB-) =
A、该温度下,马来酸的电离平衡常数Ka1 =10-1.92 B、当溶液中=2时,pH=3.15 C、pH=7时,溶液中c(B2-)>c(H2B) >c(HB- ) >c(OH - ) D、混合溶液中c(HB-) =三、非选择题
-
26. 硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。(1)、硒(34Se)在周期表中位于硫下方,画出其原子结构示意图。(2)、氧族元素单质均能与H2反应生成H2X,用原子结构解释原因。(3)、298K、1.01×10-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式。(4)、可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。

①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是。
③下列说法正确的是(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2 , 计算K2=。
27. 利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:n(SO32﹣):n(HSO3﹣)
91:9
1:1
1:91
pH
8.2
7.2
6.2
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
b.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c( Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
28. 氮及其化合物在生产、生活中有着重要的作用.请回答下列问题: (1)、图1是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:(2)、在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)⇌2NO2(g)△H如图2
(1)、图1是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:(2)、在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)⇌2NO2(g)△H如图2①在0﹣60s时段,反应速率v(N2O4)为 mol•L﹣1•s﹣1 .
②温度升高,混合气体的颜色变深,则△H0(填“>”或“<”).
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有(填字母).
a.向混合气体中通入N2O4 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
(3)、实验室可用NaOH溶液吸收NO2 , 反应2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L﹣1的CH3COONa溶液.①A、B两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为(已知HNO2的电离
常数Ka=7.1×10﹣4mol•L﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5mol•L﹣1).
②可使A、B两溶液的pH相等的方法是(填字母).
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)、铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平).0.6molCu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为 .29. 磷能形成多种含氧酸.(1)、次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2﹣、OH﹣两种阴离子.①写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式: , 该正盐溶液中各离子浓度由大到小的顺序为 .
②若25℃时,c(H3PO2)=1×10﹣2 , 则0.01mol•L﹣1的H3PO2溶液的pH=
(2)、亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1=1×10﹣2、K2=2.6×10﹣7 .①试从电离平衡移动的角度解释K1、K2数据的差异
②NaH2PO3溶液显性(填“酸”“碱”或“中”).
(3)、25℃时,HF的电离常数为K=3.6×10﹣4; H3PO4的电离常数为K1=7.5×10﹣3 , K2=6.2×10﹣8 , K3=4.4×10﹣13 . 足量NaF溶液和H3PO4溶液反应的离子方程式为(4)、相同温度下,等物质的量浓度的上述三种磷的含氧酸中.c(H+)由大到小的顺序为(用酸的分子式表示).30. 在1L0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为 .31. 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义 (1)、氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)、氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.①如图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: . (△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将m mol•L﹣1的氨水与n mol•L﹣1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4)c(Cl﹣)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式 .
(2)、海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.25℃下,向0.1mol•L﹣1的NaCl溶液中逐滴加入适量的0.1mol•L﹣1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 , 向反应后的浊液中,继续加入适量0.1mol•L﹣1的NaI溶液,振荡、静置,看到的现象是 , 产生该现象的原因是(用离子方程式表示) .(已知25℃时Ksp[AgCl]=1.0×10﹣10mol2•L﹣2 , Ksp[AgI]=1.5×10﹣16mol2•L﹣2)
32. 降低太气中CO2含量及有效开发利用CO2 , 是科学家研究的重要课题.(1)、将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol﹣1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
P1
P2
P3
T1
0.10
0.04
0.02
T2
0.20
0.16
0.05
T3
0.40
0.35
0.20
则P1P3 (填“>”“<”或“=”,下同).若T1、P1 , T3、P3时平衡常数分别为K1、K3 , 则K1K3 . T1、P1时H2的平衡转化率为 .
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是 .
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)、碳酸氢钾溶液加水稀释, (填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2 , 当溶液呈中性时,下列关系或说法正确的是: .a.c(K+)=2c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
b.c(HCO3﹣)>c(CO32﹣)
c.降低温度,c(H+)•c(OH﹣)不变
(3)、向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为 .33. 次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性.试回答下列问题:(1)、P的原子结构示意图为;(2)、NaH2PO2为(填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 .(3)、H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4:1,则该反应的氧化产物的化学式为 .34.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:

已知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
离子
以氢氧化物形式完全沉淀时所需pH
氢氧化物沉淀完全溶解时所需pH
Fe3+
3.2
Al3+
5.3
11.9
Mg2+
12.3
(1)、试剂①为 , 试剂②为;A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)、固体C的化学式是 , 溶液F中金属元素的存在形式为;(3)、写出固体A与试剂②反应的化学方程式:;F中通入过量CO2所发生的离子方程式为;(4)、加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为 .A、6 B、10 C、12 D、13(5)、25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10﹣10mol/L,则氢氧化镁的Ksp=;(6)、最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为 .35. 石油化工、煤化工等行业的废气中普遍含有硫化氢,的回收利用有重要意义。以下是处理的一些方法。完成下列填空:
(1)、Ⅰ.用氢氧化钠溶液吸收。硫化氢被完全吸收后,溶液里含硫的微粒可能为 , 25℃时若溶液 , 则溶液中(填“>”或“<”或“=”)。
(2)、Ⅱ.制取 , 其反应的能量示意如下图所示。
写出该总反应的热化学方程式。
(3)、Ⅲ.高温分解:能够判断上述反应到达平衡状态的是。(选填编号)
a.的浓度保持不变| b.气体的质量保持不变
c.恒容时,容器的压强保持不变 d.
(4)、在恒温恒压条件下,充入氩气,发现:越小,平衡转化率越大,请解释可能的原因。(5)、Ⅳ.将燃烧,产生的与剩余混合后反应,生成单质疏回收。①
②
②的平衡常数表达式为 , 某温度下,若只发生反应②,从反应开始到15s时,测得容器内的气体密度减小了 , 则内,平均反应速率。
(6)、在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为:、、 , 请计算开始时投料比。