高考二轮复习知识点:离子浓度大小的比较3
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 时,苯酚的 , 下列说法正确的是( )A、相同温度下,等的和溶液中, B、将浓度均为的和溶液加热,两种溶液的均变大 C、时,溶液与溶液混合,测得 , 则此时溶液中 D、时,的溶液中加少量固体,水的电离程度变小2. 时,向浓度均为的盐酸和醋酸的混合溶液中逐滴加入的溶液(醋酸的;用的溶液滴定等浓度的盐酸,滴定终点的突跃范围4.3~9.7)。下列说法不正确的是( )A、恰好中和时,溶液呈碱性 B、滴加溶液至的过程中,发生反应的离子方程式为: C、滴定过程中, D、时,3. 室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示(忽略沉淀对离子的吸附作用)。

若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , )。下列说法正确的是( )
A、a点:有白色沉淀生成 B、原溶液中 的浓度为 C、当 沉淀完全时,已经有部分 沉淀 D、b点:4. 常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中 , 当达到平衡时,下列叙述正确的是( )
A、溶液Ⅰ中 B、溶液Ⅱ中的的电离度为 C、溶液Ⅰ和Ⅱ中的不相等 D、溶液Ⅰ和Ⅱ中的之比为5. 已知25℃时二元酸H2A的Ka1=1.3×10-7 , Ka2=7.1×10-15。下列说法正确的是( )A、在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 B、向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% C、向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) D、取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+16. 25℃时,向溶液中滴加相同浓度盐酸,体系中粒子浓度的对数值、反应物的物质的量之比与pH的关系如图所示。下列说法错误的是 A、b点溶液显酸性,是因为存在水解平衡 B、m、n分别表示、变化曲线 C、25℃时,BOH的电离平衡常数为 D、a点对应的溶液中存在:7. 已知含磷废水中的磷以磷酸及其盐的形式存在。某温度下,磷酸的与溶液的的关系如下图,该温度下向初始的含磷废水中加入可以得到沉淀而实现废水除磷。下列叙述错误的是
A、b点溶液显酸性,是因为存在水解平衡 B、m、n分别表示、变化曲线 C、25℃时,BOH的电离平衡常数为 D、a点对应的溶液中存在:7. 已知含磷废水中的磷以磷酸及其盐的形式存在。某温度下,磷酸的与溶液的的关系如下图,该温度下向初始的含磷废水中加入可以得到沉淀而实现废水除磷。下列叙述错误的是 A、该温度下,磷酸的 B、若逐渐增大该废水的 , 溶液中将随之不断增大 C、的该废水中离子浓度存在关系: D、该废水除磷的离子反应有:8. 硒酸(H2SeO4)在水溶液中按下式发生一级和二级电离:; , , 室温下,在10mL0.1mol⋅L-1H2SeO4溶液中,滴加0.1mol⋅L-1NaOH溶液。下列说法正确的是A、可经过两步水解得到H2SeO4 B、滴加NaOH溶液10mL时,溶液中离子浓度: C、当滴加至中性时,溶液中有 D、当用去NaOH溶液体积20mL时,此时溶液中有9. 时,用溶液调节醋酸溶液的 , 实验测得溶液中、的分布系数与的关系如图所示。其中。下列说法正确的是
A、该温度下,磷酸的 B、若逐渐增大该废水的 , 溶液中将随之不断增大 C、的该废水中离子浓度存在关系: D、该废水除磷的离子反应有:8. 硒酸(H2SeO4)在水溶液中按下式发生一级和二级电离:; , , 室温下,在10mL0.1mol⋅L-1H2SeO4溶液中,滴加0.1mol⋅L-1NaOH溶液。下列说法正确的是A、可经过两步水解得到H2SeO4 B、滴加NaOH溶液10mL时,溶液中离子浓度: C、当滴加至中性时,溶液中有 D、当用去NaOH溶液体积20mL时,此时溶液中有9. 时,用溶液调节醋酸溶液的 , 实验测得溶液中、的分布系数与的关系如图所示。其中。下列说法正确的是 A、曲线1代表 B、 , 的电离常数 C、 D、溶液中始终存在10. 工业上可利用氨水吸收SO2和NO2 , 原理如下图所示。已知: 25℃时,NH3·H2O的Kb=l.7x10-5 , H2SO3的Ka1=1.3x10-2 , Ka2=6.2x10-8 , 下列说法正确的是
A、曲线1代表 B、 , 的电离常数 C、 D、溶液中始终存在10. 工业上可利用氨水吸收SO2和NO2 , 原理如下图所示。已知: 25℃时,NH3·H2O的Kb=l.7x10-5 , H2SO3的Ka1=1.3x10-2 , Ka2=6.2x10-8 , 下列说法正确的是 A、向氨水中通入SO2恰好生成NH4HSO3: c(H2SO3)> c(NH3·H2O)+c (SO) B、向氨水中通入SO2至pH=7; c( HSO)>c (NH)> c(H+)= c(OH-) C、反应NH3·H2O + H2SO3 =NH + HSO+ H2O的平衡常数K=2.21×107 D、NO2被NH4HSO3吸收的离子方程式: 2NO2+4SO= N2+ 4SO11. 常温下,乙二胺的水溶液中,、和的分布分数与pH的关系如图所示。已知:。
A、向氨水中通入SO2恰好生成NH4HSO3: c(H2SO3)> c(NH3·H2O)+c (SO) B、向氨水中通入SO2至pH=7; c( HSO)>c (NH)> c(H+)= c(OH-) C、反应NH3·H2O + H2SO3 =NH + HSO+ H2O的平衡常数K=2.21×107 D、NO2被NH4HSO3吸收的离子方程式: 2NO2+4SO= N2+ 4SO11. 常温下,乙二胺的水溶液中,、和的分布分数与pH的关系如图所示。已知:。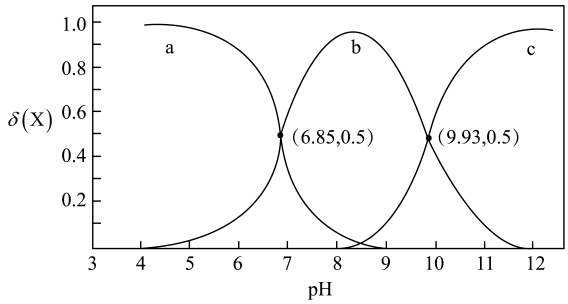
下列说法错误的是
A、溶液显酸性 B、曲线b可表示 C、的平衡常数 D、溶液中:12. 室温下,取溶液,逐滴加入溶液。已知: , 。下列说法正确的是A、溶液中有 B、当滴加至中性时,用去溶液的体积小于 C、当用去溶液时,此时溶液中有 D、当用去溶液时,此时溶液中有13. 常温下,向10.00mL0.1000mol·L-1NaHCO3溶液中滴加0.1000 mol·L-1的盐酸,溶液的pH随加入的盐酸体积V的变化如图所示,选项错误的是 A、a点溶液中,c(HCO)>c(H2CO3)>c(CO) B、b点溶液中,< C、c点溶液中,共含有7种微粒。 D、d点溶液中,0.100014. 25℃时, , 下列说法错误的是A、25℃时,电离程度: B、25℃时,浓度为NaHA的pH>7 C、25℃时,溶液中加入与等体积混合后: D、25℃时,pH相同的与NaB的溶液中水的电离程度相同15. 在25 ℃时,将1.0 L x mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述错误的是
A、a点溶液中,c(HCO)>c(H2CO3)>c(CO) B、b点溶液中,< C、c点溶液中,共含有7种微粒。 D、d点溶液中,0.100014. 25℃时, , 下列说法错误的是A、25℃时,电离程度: B、25℃时,浓度为NaHA的pH>7 C、25℃时,溶液中加入与等体积混合后: D、25℃时,pH相同的与NaB的溶液中水的电离程度相同15. 在25 ℃时,将1.0 L x mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述错误的是 A、水的电离程度:a>b>c B、a点对应的混合溶液中:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) C、b点对应的混合溶液中:c(CH3COOH)= mol·L-1 D、该温度下,CH3COOH的电离平衡常数均为Ka=
A、水的电离程度:a>b>c B、a点对应的混合溶液中:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) C、b点对应的混合溶液中:c(CH3COOH)= mol·L-1 D、该温度下,CH3COOH的电离平衡常数均为Ka=二、多选题
-
16. 下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )A、0.1mol•L﹣1某二元弱酸酸式盐NaHA溶液中:c(Na+)=c(A2﹣)+c(HA﹣)+c(H2A) B、向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42﹣)>c(NH4+)>c(H+)>c(OH﹣) C、0.1 mol•L﹣1的Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+c(H2CO3) D、25℃时,pH=9.4、浓度相同的HCN与NaCN的混合溶液中:c(Na+)>c(CN﹣)>c(HCN)>c(OH﹣)17. 下列溶液中微粒浓度关系一定正确的是( )A、室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl﹣)=c(NH4+) B、向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3﹣的水解,使c(HCO3﹣)增大 C、0.1 mol•L﹣1的(NH4)2SO4溶液中:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣) D、常温下,等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=1418. 25℃时,向20mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,正确的是( )
 A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) B、在B点:c(OH-)= c(H+),c(Na+)= c(CH3COO-) C、在C点:c(CH3COO-)>c(Na+)>c(H+)= c(OH-) D、在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)19. 25℃时,向的两种酸HX、HY中分别滴加溶液,测得两溶液pH随NaOH溶液体积变化的曲线如图所示。下列说法不正确的是( )
A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) B、在B点:c(OH-)= c(H+),c(Na+)= c(CH3COO-) C、在C点:c(CH3COO-)>c(Na+)>c(H+)= c(OH-) D、在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)19. 25℃时,向的两种酸HX、HY中分别滴加溶液,测得两溶液pH随NaOH溶液体积变化的曲线如图所示。下列说法不正确的是( )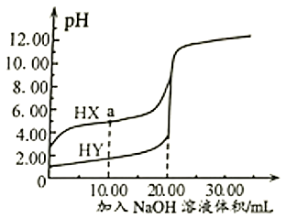 A、酸性: B、a点溶液中微粒浓度: C、滴加NaOH溶液至时,两溶液中 D、从开始滴加至溶液时,两溶液中的电离程度均逐渐增大20. 常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
A、酸性: B、a点溶液中微粒浓度: C、滴加NaOH溶液至时,两溶液中 D、从开始滴加至溶液时,两溶液中的电离程度均逐渐增大20. 常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:实验编号
c(HA)/mol·L-1
c(NaOH)/mol·L-1
反应后溶液pH
甲
0.1
0.1
pH=9
乙
c1
0.2
pH=7
下列判断错误的是( )
A、0.1mol·L-1的HA溶液中由水电离出的c(H+)=1×10-13mol·L-1 B、c1一定大于0.2mol·L-1 C、甲反应后的溶液中:c(Na+)<c(A-) D、乙反应后的溶液中:c(Na+)=c(A-)21. 室温下,在0.1mol·L-1三元弱酸H3A溶液中,微粒H3A、H2A-、HA2-、A3-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是( )
[已知:δ(X)=]
A、反应A3-+H2A-⇌2HA2-的平衡常数的值为105.2 B、将KOH溶液逐滴加入到H3A溶液中,反应H2A-+OH-=HA2-+H2O发生的pH范围是4.7~9.8 C、欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2 D、物质的量浓度均为0.1mol·L-1的KH2A、K2HA混合溶液中:c(K+)>c(HA2-)>c(H2A-)>c(H+)>c(A3-)>c(OH-)22. 对于0.1 mol·L-1 NH4Cl溶液,正确的是( )A、升高温度,溶液pH升高 B、通入少量HCl气体,c(NH4+)和c(Cl-)均增大 C、c(NH4+)+ c(OH-)=c(Cl-)+ c(H+) D、c(Cl-)> c(H+)> c(NH4+)> c(OH-)23. 25 ℃时,下列溶液中微粒的物质的量浓度关系正确的是( )A、0.1 mol•L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+) B、0.1 mol•L-1 CH3COONH4溶液中:c(NH4+)+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH) C、0.1 mol•L-1 NH4HCO3溶液中:c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) D、0.1 mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)24. H2C2O4为二元弱酸。常温下0.1mol·L-1 NaHC2O4溶液(pH约为4)中指定微粒的物质的量浓度关系错误的是( )A、c(Na+)= c(HC2O )+c(C2O )+c(H2C2O4) B、c(HC2O4-)>c(H2C2O4)>c(C2O ) C、c(Na+)+c(H+)=c(HC2O )+ c(C2O )+c(OH-) D、c(H2C2O4)+c(H+)=c(C2O )+c(OH-)25. 室温下,下列指定溶液中微粒的浓度关系正确的是( )A、0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3) B、0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) C、0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-) D、0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)三、非选择题
-
26. 锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3 , 含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)、为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤(选填①、②、③或⑤)。(2)、若步骤②中加入的氧化剂为H2O2 , 写出反应的离子方程式。
(3)、滤渣2中主要成分为(填化学式)。(4)、写出步骤④后产生滤渣3的反应的离子方程式。(5)、滤液3中含碳粒子的浓度大小顺序为。(6)、Ⅱ.BaS溶液的制备
写出“煅烧还原”反应的化学方程式。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:。
(7)、Ⅲ.制取锌钡白如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是。
27. NaBiO3可作为测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3 , 还含少量SiO2等杂质)来制备,工艺流程如下:
已知:NaBiO3难溶于水。
回答下列问题
(1)、溶液Ⅰ中主要成分为BiCl3、FeCl2 , 则滤渣Ⅰ的主要成分是(写化学式)。(2)、海绵铋与盐酸、H2O2反应的化学方程式是(3)、向溶液Ⅲ中加入NaOH和NaClO发生反应的离于方程式是 , 从反应后的混合体系中获得纯净NaBiO3 , 操作Ⅱ包括。(4)、一定温度下,向氨水中通入CO2 , 得到 (NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=(用离子浓度表示)。 (5)、取所得NaBiO3样品2.0g,加入稀硫酸和MnSO4溶液使其完全溶解,然后用新配制的0.5mol/LFeSO4溶液滴定生成的MnO4- , 滴定完成后消耗22.00mLFeSO4溶液。则该样晶中NaBiO3纯度为。28. 氮及其化合物与人类生产、生活密切相关。(1)、氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
(5)、取所得NaBiO3样品2.0g,加入稀硫酸和MnSO4溶液使其完全溶解,然后用新配制的0.5mol/LFeSO4溶液滴定生成的MnO4- , 滴定完成后消耗22.00mLFeSO4溶液。则该样晶中NaBiO3纯度为。28. 氮及其化合物与人类生产、生活密切相关。(1)、氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2 , 当消耗标准状况下3.36L CO时,放出的热量为kJ(用含有a和b的代数式表示)。
(2)、在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2 , 发生反应:2NO2(g) N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[ (NO2)]与反应时间(t)的关系如下表:
①0~20 min内,v(N2O4)=mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为。改变温度至T1时k1=k2 , 则T1373K(填“>”、“<”或“=”)。
(3)、连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7 , Ka2=10-12)①若V=100,则所得溶液中c(H2N2O2)c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因。
②若V=200,则所得溶液中离子浓度由大到小的顺序为。
29. I.人类能够有效利用氮气的主要途径是合成氨,生产化学肥料等。完成下列填空:
(1)、氮原子核外电子排布式为 , 其最外层有种运动状态不同的电子;氮气的电子式为;氨气分子的空间构型是。(2)、工业上常用醋酸亚铜氨溶液来吸收含有大量N2的高炉气体系中的CO,从而实现CO和N2的分离,反应的化学方程式如下:CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=;欲使K值变大,可采取的措施是。吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的适当处理措施有
(选填序号)。
a.适当升高温度
b.适当降低温度
c.增大压强
d.减小压强
(3)、消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,这样能使NH3的脱除率增大,试用平衡移动原理解释其原因。(4)、某研究小组用200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况)形成富液,碳酸钾溶液吸收CO2的离子反应方程式为 , 该富液中的溶质是(填化学式),各离子的浓度关系正确的是。a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3)
c.c(K+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
30. 某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.(1)、I.NH4+的测定采用蒸馏法,蒸馏装置如图所示。

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120mol•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
仪器M的名称为。
(2)、步骤③中,发生的氧化还原反应的化学方程式为。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是。(3)、步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将(填“偏大”“偏小”或“不变”)。(4)、II.SO42-含量的测定采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
步骤①中,判断BeCl 溶液已过量的实验操作和现象是。
(5)、步骤②中,采用冷水洗讓沉淀,其主要目的是。(6)、结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为。31. CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。(1)、用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。已知在常温常压下,甲醇、CO的燃烧热分别是726.5kJ·mol-1、110.5 kJ·mol-1。写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:;
(2)、CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g) +Cl2(g) COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:t/min
n(CO)/mol
n(Cl2)/mol
0
1.20
0.60
1
0.90
2
0.80
4
0.20
①反应0~2min末的平均速率v(COCl2)=mol/(L·min)。
②在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。X代表的物理量是;a0 (填“>”,“=”,“<”)。
 (3)、在催化剂作用下NO和CO转化为无毒气体:
(3)、在催化剂作用下NO和CO转化为无毒气体:2CO(g)+2NO(g) 2CO2 (g)+N2 (g)
ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是。

②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式。
(4)、用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是。32. 降低大气中CO2的含量及有效地开发利用CO2 , 已引起了全世界的普遍重视。(1)、CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1

某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时、改变压强和温度,平衡体系中CH3OCH3(g)的物质分数变化情况如图所示,则p1p2(填“>”“<”或“=”,下同)。若T1、P1 , T3、P3时平衡常数分别为K1、K3 , 则K1K3 , T1、P1时H2的平衡转化率为。
②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是(填序号)。
A. 反应物的浓度增大
B. 混合气体的密度减小
C. 正反应速率小于逆反应速率
D. 氢气的转化率减小
(2)、将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:通入1mol HCl时,溶液中所含溶质的化学式 , a点溶液中各离子浓度由大到小的关系式为。 (3)、CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1 , 则生成沉淀所需CaCl2溶液的最小浓度为mol·L-1.33. 硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。(1)、H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
(3)、CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1 , 则生成沉淀所需CaCl2溶液的最小浓度为mol·L-1.33. 硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。(1)、H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。①羰基硫的电子式为。
②下列能说明碳与硫两元素非金属性相对强弱的是(填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)、H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。(3)、H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)、H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2--2e-=S↓ (n-1)S+S2- Sn2-写出电解时阴极的电极反应式:。 (5)、一定温度下将NH4HS固体放入定容真空密闭容器中,可部分分解为硫化氢和氨气:NH4HS(s) H2S(g)+NH3(g)。
(5)、一定温度下将NH4HS固体放入定容真空密闭容器中,可部分分解为硫化氢和氨气:NH4HS(s) H2S(g)+NH3(g)。①可以判断上述分解反应已经达到化学平衡状态的是 (填字母代号)
A.v(H2S)=v(NH3)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②当上述反应达平衡时:p(NH3)×p(H2S)=a(Pa2),则平衡时容器中的总压为Pa( 用含a 的代数式表示).[p(NH3)、p(H2S)分别代表NH3、H2S的压强,Pa为压强的单位]
34. 硫是中学化学重要的非金属元素之一,请回答下列有关问题。已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol
2NO(g)+O2(g) 2NO2(g) △H=-113.0kJ/mol
(1)、反应NO2(g)+ SO2(g) SO3(g)+NO(g)的ΔH= kJ/mol 。(2)、一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时消耗1 molNO
(3)、S2Cl2和SCl2均为重要的工业化合物。已知:a.S2(l)+Cl2(g) S2Cl2(g) △H1
b.S2Cl2(g)+ Cl2(g) 2SCl2(g) △H2
—定压强下,向10 L密闭容器中充入1 molS2Cl2和1 mol Cl2 , 发生反应b。Cl2与SCl2的消耗速率(υ)与温度(T)的关系如图所示:

① A、B、C、D四点对应状态下,达到平衡状态的有(填字母),理由是。
②—定温度下,在恒容密闭容器中发生反应a和反应b,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率(填“增大”或“减小”或“不变”),理由是。
(4)、II.氮有不同价态的化合物,如氨、氮气、亚硝酸钠、乙二胺等。图(I)和图(II)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。

H3NCH2CH2NH3A溶液显(填“酸”或“碱”)性。
(5)、乙二胺在水溶液中发生第二步电离的方程式: , 其平衡常数Kb2= 。
(6)、向20 mL 0.1 mol/L的H2A溶液加入10 mL 0.1 mol/L H2NCH2CH2NH2溶液后,溶液中各离子浓度大小的关系为 。35. “废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。(1)、处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=.
(2)、已知973 K时,SO: 与NO2 反应生成SO,和NO,将混合气体经冷凝分离出的SO,可用于制备硫酸。①973 K时,测得:
NO2(g) NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g) SO3(g) K2=20;
则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为。
③恒压下,SO2的分压PSO2随温度的变化如图所示:

当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数(填“增大”或“减小”), 判断理由 是.
(3)、用纳米铁可去除污水中的NO3-。①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是;Ⅱ中0~20min,用NO3-表示的平均反应速率为mol·L-1·min-1。
反应时间/min
0
10
20
30
40
Ⅰ
c(NO3-)/10-4 mol/L
8
3.2
1.6
0.8
0.64
Ⅱ
c(NO3-)/10-4 mol/L (含少量Cu2+)
8
0.48
0.32
0.32
0.32
(4)、用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是。(已知常温下K1(H2SO3)=1.5×10-2 , K2(H2SO3)=1.02×10-7)A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]