高考二轮复习知识点:离子浓度大小的比较2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与投入量(用x表示)的关系如下图所示。下列说法正确的是( )
 A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,2. 某小组模拟成垢-除垢过程如图。
A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,2. 某小组模拟成垢-除垢过程如图。100mL0.1mol•L-1CaCl2水溶液……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A、经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-) B、经过步骤②,溶液中c(Na+)=4c(SO) C、经过步骤②,溶液中c(Cl-)=c(CO)+c(HCO)+c(H2CO3) D、经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)3. 某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。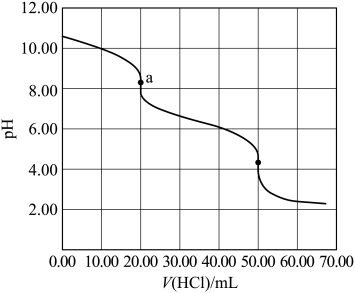
下列说法正确的是( )
A、该水样中c(CO)=0.01mol•L-1 B、a点处c(H2CO3)+c(H+)=c(OH-) C、当V(HCl)≤20.00mL时,溶液中c(HCO)基本保持不变 D、曲线上任意一点存在c(CO)+c(HCO)+c(H2CO3)=0.03mol•L-14. 下图是亚砷酸As(OH)3和酒石酸混合体系中部分物种的c-pH图(浓度:总As为 , 总T为)。下列说法错误的是( ) A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为5. 以酚酞为指示剂,用溶液滴定一元酸的溶液。溶液中,、分布系数( , 比如的分布系数:)随的变化关系如图所示,下列叙述错误的是
A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为5. 以酚酞为指示剂,用溶液滴定一元酸的溶液。溶液中,、分布系数( , 比如的分布系数:)随的变化关系如图所示,下列叙述错误的是 A、曲线①代表 , 曲线②代表 B、的数量级为 C、滴定过程中,溶液中不断减小 D、滴定终点时,6. 电位滴定法(potentiometric titration)是在滴定过程中通过测量电位变化以确定滴定终点的方法,当电极电位(ERC)产生了突跃,被测离子浓度产生突跃,进而确定滴定终点。向10mL 0.1 溶液(为二元弱酸)中逐滴滴加0.1二元酸溶液,第一个电位突跃时消耗a mL溶液,第二个电位突跃时消耗b mL溶液,根据消耗溶液体积,可判断和各级电离常数大小关系。下列说法错误的是A、若a=5mL、b=5mL,可能为强酸 B、若a=5mL、b=15mL,则 C、若a=5mL、b=15mL,第一个电位突跃时,溶液中: D、若a=10mL、b=10mL,则用0.1 溶液滴定10mL 0.1 溶液,只有一个电位突跃7. 相同温度和压强下,研究X2(g)分别在不同浓度的HX(aq)和NaX(aq)中的溶解情况,实验测得X2(g)的饱和浓度c(X2)与HX( aq)和NaX(aq)的浓度关系如图所示。
A、曲线①代表 , 曲线②代表 B、的数量级为 C、滴定过程中,溶液中不断减小 D、滴定终点时,6. 电位滴定法(potentiometric titration)是在滴定过程中通过测量电位变化以确定滴定终点的方法,当电极电位(ERC)产生了突跃,被测离子浓度产生突跃,进而确定滴定终点。向10mL 0.1 溶液(为二元弱酸)中逐滴滴加0.1二元酸溶液,第一个电位突跃时消耗a mL溶液,第二个电位突跃时消耗b mL溶液,根据消耗溶液体积,可判断和各级电离常数大小关系。下列说法错误的是A、若a=5mL、b=5mL,可能为强酸 B、若a=5mL、b=15mL,则 C、若a=5mL、b=15mL,第一个电位突跃时,溶液中: D、若a=10mL、b=10mL,则用0.1 溶液滴定10mL 0.1 溶液,只有一个电位突跃7. 相同温度和压强下,研究X2(g)分别在不同浓度的HX(aq)和NaX(aq)中的溶解情况,实验测得X2(g)的饱和浓度c(X2)与HX( aq)和NaX(aq)的浓度关系如图所示。
已知:X2(g)溶解过程发生如下反应:
①X2(aq) +X- (aq)(aq) K1=0.19
②X2(aq) +H2O(1)H+(aq) +X- (aq) + HXO( aq) K2=4.2×10-4
③HXO(aq) H+(aq) +XO- (aq) Ka=3.2×10-8
下列说法正确的是
A、a点溶液中存在:c(H+) >c(X-) >c(XO-) >c(HXO) >c() >c(OH-) B、b点溶液中存在:c(X-) +c() +c(XO- )>c(H+) +c(Na+) C、对比图中两条曲线可知X-对X2的溶解存在较大的抑制作用 D、NaX曲线中,随着X2溶解度的减小,溶液中增大8. 常温下,用溶液滴定和混合溶液,滴定过程中和分布系数及pH随溶液体积变化如图。已知: , 下列说法错误的是 A、 B、时, C、时,滴定过程中水的电离程度不断增大 D、可利用甲基紫(变色范围为)确定第一滴定终点9. 化学上常用AG表示溶液中的。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
A、 B、时, C、时,滴定过程中水的电离程度不断增大 D、可利用甲基紫(变色范围为)确定第一滴定终点9. 化学上常用AG表示溶液中的。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是 A、随着NaOH溶液的加入,减小 B、25℃时,HNO2的电离常数Ka的数量级为10-6 C、b点溶液中存在:2c(H+)-2c(OH-)=c()-c(HNO2) D、a、b、c、d、e五点的溶液中,水的电离程度最大的点是d10. 电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100mol•L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
A、随着NaOH溶液的加入,减小 B、25℃时,HNO2的电离常数Ka的数量级为10-6 C、b点溶液中存在:2c(H+)-2c(OH-)=c()-c(HNO2) D、a、b、c、d、e五点的溶液中,水的电离程度最大的点是d10. 电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100mol•L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( ) A、曲线②代表滴定CH3COOH溶液的曲线 B、在相同温度下,P点水电离程度大于M点 C、M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1 D、N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)11. 常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如图。下列说法正确的是
A、曲线②代表滴定CH3COOH溶液的曲线 B、在相同温度下,P点水电离程度大于M点 C、M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1 D、N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)11. 常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如图。下列说法正确的是 A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、滴定过程中可能出现:12. 亚磷酸常用作尼龙增白剂和合成药物中间体。25℃时,已知溶液中含磷微粒的浓度之和为 , 溶液中所有含磷微粒的的关系如图所示。已知:表示浓度的负对数。下列说法正确的是
A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、滴定过程中可能出现:12. 亚磷酸常用作尼龙增白剂和合成药物中间体。25℃时,已知溶液中含磷微粒的浓度之和为 , 溶液中所有含磷微粒的的关系如图所示。已知:表示浓度的负对数。下列说法正确的是 A、为三元弱酸 B、曲线①表示随的变化 C、的溶液中: D、反应的平衡常数13. 按如图1装置,常温下分别向25mL0.3mol•L-1Na2CO3溶液和25mL0.3mol•L-1NaHCO3溶液中逐滴滴加0.3mol•L-1的稀盐酸,测得压强随盐酸体积的变化曲线如图2所示,已知:碳酸Ka1=4.3×10-7;Ka2=5.6×10-11。下列说法正确的是
A、为三元弱酸 B、曲线①表示随的变化 C、的溶液中: D、反应的平衡常数13. 按如图1装置,常温下分别向25mL0.3mol•L-1Na2CO3溶液和25mL0.3mol•L-1NaHCO3溶液中逐滴滴加0.3mol•L-1的稀盐酸,测得压强随盐酸体积的变化曲线如图2所示,已知:碳酸Ka1=4.3×10-7;Ka2=5.6×10-11。下列说法正确的是 A、X为Na2CO3溶液的反应曲线 B、a点溶液中c(H+)的数量级为10-12 C、a到c点之间的离子浓度大小关系:c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+) D、水的电离程度:c<a<b14. 谷氨酸(
A、X为Na2CO3溶液的反应曲线 B、a点溶液中c(H+)的数量级为10-12 C、a到c点之间的离子浓度大小关系:c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+) D、水的电离程度:c<a<b14. 谷氨酸( , 用H2A表示)在生物体内的蛋白质代谢过程中占重要地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1mol•L-1HCl溶液滴定20.00mL0.1mol•L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lgc(OH-)],下列叙述正确的是
, 用H2A表示)在生物体内的蛋白质代谢过程中占重要地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1mol•L-1HCl溶液滴定20.00mL0.1mol•L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lgc(OH-)],下列叙述正确的是  A、曲线X表示pOH与-lg的关系 B、Na2A溶液中,c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-) C、溶液显中性时,c(H2A)>c(A2-) D、当V(HCl)=10mL时,c(HA-)+2c(H2A)+3c(H3A+)+c(H+)=c(OH-)+c(Cl-)
A、曲线X表示pOH与-lg的关系 B、Na2A溶液中,c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-) C、溶液显中性时,c(H2A)>c(A2-) D、当V(HCl)=10mL时,c(HA-)+2c(H2A)+3c(H3A+)+c(H+)=c(OH-)+c(Cl-)二、多选题
-
15. NaClO溶液具有添白能力,已知25℃时,。下列关于NaClO溶液说法正确的是( )A、0.01mol/L溶液中, B、长期露置在空气中,释放 , 漂白能力减弱 C、通入过量 , 反应的离子方程式为 D、25℃,的NaClO和HClO的混合溶液中,16. 常温下下列溶液中确关微粒的物质的量浓度关系正确的是( )A、等物质的量浓度的CuSO4和(NH4)2SO4的混合溶液 B、0.2 mol/L NaHCO3溶液和0.1 mol/LNaOH溶液等体积相混合: C、pH=2的盐酸与pH=12的氨水等体积混合 D、0.1 mol/LCH3COONa溶液中通入HCl气体,至pH=7(溶液体积变化忽略不计):17. t℃时,配制一组c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
 A、pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1 B、pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-) C、pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-) D、25℃时,反应H2CO3+CO32- 2HCO3-的平衡常数为1.0×10418. 下列有关物质浓度关系的描述中,正确的是( )A、0.1mol·L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) B、25℃时,NaHCO3溶液的pH=8,c(Na+) + c(HCO3-)=9.9×10-7mol·L-1 C、25℃时,向0.1mol·L-1NH4Cl溶液中滴加NaOH溶液至中性:c(Cl-)>c(NH4+)>c(Na+)>c(OH—)=c(H+) D、25℃时,pH相同的溶液中溶质的物质的量浓度:c(CH3COONa)<c(NaHCO3) <c(Na2CO3)19. 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
A、pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1 B、pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-) C、pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-) D、25℃时,反应H2CO3+CO32- 2HCO3-的平衡常数为1.0×10418. 下列有关物质浓度关系的描述中,正确的是( )A、0.1mol·L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) B、25℃时,NaHCO3溶液的pH=8,c(Na+) + c(HCO3-)=9.9×10-7mol·L-1 C、25℃时,向0.1mol·L-1NH4Cl溶液中滴加NaOH溶液至中性:c(Cl-)>c(NH4+)>c(Na+)>c(OH—)=c(H+) D、25℃时,pH相同的溶液中溶质的物质的量浓度:c(CH3COONa)<c(NaHCO3) <c(Na2CO3)19. 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( ) A、W点所示的溶液中:c(CO32﹣)=c(HCO3﹣)>c(OH﹣)>c(H+) B、pH=4的溶液中:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1mol•L﹣1 C、pH=8的溶液中:c(Na+)>c(HCO3﹣)>c(H2CO3)>c(CO32﹣) D、pH=11的溶液中:c(Na+)+c (H+)=c(OH﹣)+c(Cl﹣)+c(CO32﹣)+c(HCO3﹣)20. 25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )A、向浓度为0.1mol•L﹣1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) B、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO﹣)+c(H+)>c(Na+)+c(OH﹣) C、0.1 mol•L﹣1CH3COOH溶液和0.1 mol•L﹣1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣) D、0.1 mol•L﹣1 NH4HSO4溶液中滴加0.1 mol•L﹣1 NaOH溶液至中性:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)21. 下列有关溶液中粒子浓度的关系式正确的是( )A、25℃,0.1mol/L pH=4.5 的NaHC2O4溶液 c(HC2O )>c(C2O )>c(H2C2O4) B、向0.2mol/L的NaHCO3溶液中加入等体积的0.1mol/L的NaOH溶液c(H+)+c(Na+)=c(OH﹣)+c(CO )+c(HCO3﹣) C、常温下,氯化铵和氨水的混合溶液其pH=7,c(Cl﹣)=0.1mol/L c(Cl﹣)>c(NH4+)>c(OH﹣)=c(H+) D、浓度均为0.1mol/L的醋酸钠和醋酸的混合溶液中c(CH3COO﹣)﹣c(CH3COOH)=2[c(H+)﹣c(OH﹣)]22. 25℃时,H2SO3⇌HSO +H+的电离平衡常数Kh=1×10﹣2 , 下列说法不正确的是( )A、该温度下NaHSO3 的水解平衡常数Kh=1×10﹣2 B、若向NaHSO3 溶液中加入少量的I2 , 则溶液中 将减小 C、略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 D、NaHSO3溶液中:c(H+)<c(SO )+c(HSO )+c(OH﹣)23. 25℃时,下列溶液中离子浓度的等量关系正确的是( )A、0.1 mol/L氨水中:c(NH )+c(H+)=c(OH﹣) B、0.1 mol/L的NH4Cl溶液中:c(NH )=c(Cl﹣) C、pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH ) D、pH=3的盐酸和pH=11的氨水等体积混合后:c(OH﹣)=c(H+)24. 下列溶液中粒子的物质的量浓度关系一定正确的是( )A、常温下,pH=9的NaHA溶液:c(Na+)>c(HA﹣)>c(H2A) B、Na2CO3溶液:c(H+)﹣c(OH﹣)=c(HCO )+2c(CO )﹣c(Na+) C、向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO﹣)>c(OH﹣)>c(H+) D、浓度均为0.1mol•L﹣1的HF溶液与KF溶液等体积混合:c(F﹣)+c(HF)=0.2mol•L﹣125. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系比较正确的( )
A、W点所示的溶液中:c(CO32﹣)=c(HCO3﹣)>c(OH﹣)>c(H+) B、pH=4的溶液中:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1mol•L﹣1 C、pH=8的溶液中:c(Na+)>c(HCO3﹣)>c(H2CO3)>c(CO32﹣) D、pH=11的溶液中:c(Na+)+c (H+)=c(OH﹣)+c(Cl﹣)+c(CO32﹣)+c(HCO3﹣)20. 25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )A、向浓度为0.1mol•L﹣1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) B、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO﹣)+c(H+)>c(Na+)+c(OH﹣) C、0.1 mol•L﹣1CH3COOH溶液和0.1 mol•L﹣1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣) D、0.1 mol•L﹣1 NH4HSO4溶液中滴加0.1 mol•L﹣1 NaOH溶液至中性:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)21. 下列有关溶液中粒子浓度的关系式正确的是( )A、25℃,0.1mol/L pH=4.5 的NaHC2O4溶液 c(HC2O )>c(C2O )>c(H2C2O4) B、向0.2mol/L的NaHCO3溶液中加入等体积的0.1mol/L的NaOH溶液c(H+)+c(Na+)=c(OH﹣)+c(CO )+c(HCO3﹣) C、常温下,氯化铵和氨水的混合溶液其pH=7,c(Cl﹣)=0.1mol/L c(Cl﹣)>c(NH4+)>c(OH﹣)=c(H+) D、浓度均为0.1mol/L的醋酸钠和醋酸的混合溶液中c(CH3COO﹣)﹣c(CH3COOH)=2[c(H+)﹣c(OH﹣)]22. 25℃时,H2SO3⇌HSO +H+的电离平衡常数Kh=1×10﹣2 , 下列说法不正确的是( )A、该温度下NaHSO3 的水解平衡常数Kh=1×10﹣2 B、若向NaHSO3 溶液中加入少量的I2 , 则溶液中 将减小 C、略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 D、NaHSO3溶液中:c(H+)<c(SO )+c(HSO )+c(OH﹣)23. 25℃时,下列溶液中离子浓度的等量关系正确的是( )A、0.1 mol/L氨水中:c(NH )+c(H+)=c(OH﹣) B、0.1 mol/L的NH4Cl溶液中:c(NH )=c(Cl﹣) C、pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH ) D、pH=3的盐酸和pH=11的氨水等体积混合后:c(OH﹣)=c(H+)24. 下列溶液中粒子的物质的量浓度关系一定正确的是( )A、常温下,pH=9的NaHA溶液:c(Na+)>c(HA﹣)>c(H2A) B、Na2CO3溶液:c(H+)﹣c(OH﹣)=c(HCO )+2c(CO )﹣c(Na+) C、向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO﹣)>c(OH﹣)>c(H+) D、浓度均为0.1mol•L﹣1的HF溶液与KF溶液等体积混合:c(F﹣)+c(HF)=0.2mol•L﹣125. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系比较正确的( )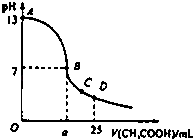 A、在A,B间任意一点,溶液中一定都有c(Na+)>cCH3COO﹣)>c(OH﹣)>c(H+) B、在B点,a>12.5,且有c(Na+)=c(CH3COO﹣)>c(OH﹣)=c(H+) C、在C点:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣) D、在D点:c(CH3COO﹣)+c(CH3COOH)=2 c(Na+)
A、在A,B间任意一点,溶液中一定都有c(Na+)>cCH3COO﹣)>c(OH﹣)>c(H+) B、在B点,a>12.5,且有c(Na+)=c(CH3COO﹣)>c(OH﹣)=c(H+) C、在C点:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣) D、在D点:c(CH3COO﹣)+c(CH3COOH)=2 c(Na+)三、非选择题
-
26. 研究SO2尾气的处理及回收利用具有重要意义。(1)、I.SO2尾气的处理
一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g) CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(2)、反应①②的平衡常数的对数lgK随温度的变化曲线如图,其中曲线I代表反应 (填“①”或“②”),从减少SO2排放的角度来考虑,本体系适宜的反应条件是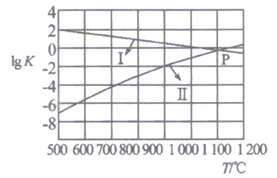
A.低温低压 B.低温高压 C.高温高压 D.高温低压
(3)、另一种方法是用氨水将SO2转化为(NH4)2SO3 , 再氧化为 (NH4)2SO4. , 用空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是。(NH4)2SO4溶液中离子浓度的大小关系为。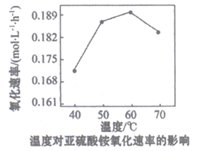 (4)、II.SO2的回收利用
(4)、II.SO2的回收利用SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
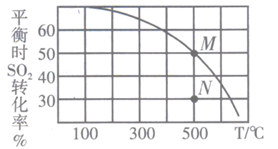
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
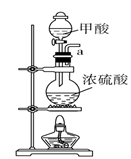
27. 甲酸(化学式HCOOH,分子式CH2O2 , 相对分子质量46),俗名蚁酸,是最简单的羧酸,无色而有刺激性气味的易挥发液体。熔点为8.6 ℃,沸点100.8℃,25℃电离常数Ka=1.8×10-4。某化学兴趣小组进行以下实验。(1)、Ⅰ.用甲酸和浓硫酸制取一氧化碳A.
 B.
B. 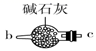 C.
C.  D.
D. 
请说出图B中盛装碱石灰的仪器名称。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是;实验时,不需加热也能产生CO,其原因是。
(2)、如需收集CO气体,连接上图中的装置,其连接顺序为:a→(按气流方向,用小写字母表示)。(3)、Ⅱ.对一氧化碳的化学性质进行探究资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。

打开k2 , F装置中发生反应的化学方程式为;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是 , H装置的作用是。
(4)、现需验证E装置中CO与NaOH固体发生了反应,某同学设计下列验证方案:取少许固体产物,配置成溶液,在常温下测该溶液的pH,若pH>7,证明CO与NaOH固体发生了反应。该方案是否可行,请简述你的观点和理由: , 。(5)、25℃甲酸钠(HCOONa)的水解平衡常数Kh的数量级为。若向100mL 0.1mol.L-1的HCOONa溶液中加入100mL0.2mol.L-1的HCl溶液,则混合后溶液中所有离子浓度由大到小排序为。28.(1)、I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:氮原子核外能量最高的电子所处的轨道是:。锂离子核外电子的轨道表示式是:。
(2)、已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因。(3)、II.研究者发明了利用锂循环合成氨的工艺,其流程如下: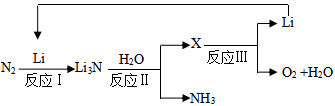
每合成1mol氨,转移电子mol;该过程最终得到的氧化产物是。
(4)、写出反应Ⅱ的化学反应方程式:。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:。(5)、由元素周期律能得到____________(填序号)。A、碱性:LiOH<NaOH B、与水反应的剧烈程度:Li<Na C、溶解度:LiOH<NaOH D、密度:Li<Na(6)、NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。29. 已知2SO2(g)+O2(g) 2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。 
完成下列填空:
(1)、T1(选填“>”“<”或“=”)T2 , 判断依据是;该反应为(选填“放”或“吸”)热反应,判断依据是。(2)、下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。投料比
①
②
③
④
SO2平衡转化率/%
97.1
96.8
95.8
90.0
②对应的投料比为。投料比为8:10时,平衡混合气体中SO3体积分数为。
(3)、在相同温度下:2NO(g)+O2(g) 2NO2(g) K1=a;NO2(g)+SO2(g) SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g) 2SO3(g) 的平衡常数K=(用a、b表示)。(4)、钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:
吸收池中发生反应的离子方程式是;NaHSO3溶液呈弱酸性,NaHSO3溶液中离子浓度由大到小排序为。
30. 氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:合成氨工业中:N2(g) + 3H2(g) 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃
200
300
400
K
K1
K2
0.5
(1)、试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)(2)、400℃时,反应2NH3(g) N2(g) + 3H2(g)的化学平衡常数的值为。当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) υ(N2)(逆)(填写“>”、“=”或“<”)
(3)、在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是。a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)、化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施: , 。(5)、0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是 , 在该溶液中加入少量明矾固体,溶液中NH4+的浓度(填“增大”、“减小”或“不变”),其原因是。 (6)、如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 。31. A、X、Y、B、C、D、E、M是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;X的基态原子次外层有2个电子,最外层有3个未成对电子;Y原子的2p轨道上有1个电子的自旋方向与其它电子相反;B的价层电子排布式为ns1 , C和Y形成的化合物是引起酸雨的主要大气污染物,常温下,D的单质是一种黄绿色的气体;E的+3价离子的3d轨道为半充满状态,M与E元素位于同一周期,且为ⅠB族元素。(1)、B、Y、C分别形成的简单离子的半径由大到小顺序为(填离子符号)(2)、元素D基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号)。(3)、M与D形成的一种化合物的立方晶胞如图所示。
(6)、如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 。31. A、X、Y、B、C、D、E、M是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;X的基态原子次外层有2个电子,最外层有3个未成对电子;Y原子的2p轨道上有1个电子的自旋方向与其它电子相反;B的价层电子排布式为ns1 , C和Y形成的化合物是引起酸雨的主要大气污染物,常温下,D的单质是一种黄绿色的气体;E的+3价离子的3d轨道为半充满状态,M与E元素位于同一周期,且为ⅠB族元素。(1)、B、Y、C分别形成的简单离子的半径由大到小顺序为(填离子符号)(2)、元素D基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号)。(3)、M与D形成的一种化合物的立方晶胞如图所示。①该化合物的化学式为

②此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为 , 其中配位体为分子(填“极性”或“非极性”),
(4)、基态C原子电子占据最高能级的电子云轮廓图为形。将A2C通入ED3溶液中反应的离子方程式为(5)、用200mL1mol·L-1的BYA溶液吸收4.48L(标准状况)CY2所得溶液的pH<7,溶液中离子浓度由大到小的顺序为。(6)、工业上用电化学法治理酸性废液中XY3−的原理如图,阴极的电极反应式为。 32. 随着电动自行车市场保有量的不断增加,废弃的铅酸蓄电池已变成不容忽视的一种环境污染源,处理不当会加大对大气、水和土壤的污染。用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理废旧铅酸蓄电池的流程如下:
32. 随着电动自行车市场保有量的不断增加,废弃的铅酸蓄电池已变成不容忽视的一种环境污染源,处理不当会加大对大气、水和土壤的污染。用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理废旧铅酸蓄电池的流程如下:
已知:Ksp(PbSO4)=1.6×10-8和Ksp(PbCO3)=7.4×10-14
回答下列问题:
(1)、废旧电池预处理时需要将电池放电完全,这样做的目的是。(2)、写出铅膏脱硫时的离子方程式。(3)、传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是。(4)、某同学查阅资料发现:儿童从空气中吸入的铅量是成人吸入量的1.6~1.7倍。为了探讨这个现象,展开了相关探究,他通过取样分析,得到了以下实验数据:离地面高度
0.8
1.0
1.2
1.4
1.6
1.8
2.0
铅的浓度(μg/cm3)
1.10
0.98
0.91
0.72
0.66
0.54
0.50
①该同学探究的课题名称为。
②分析以上实验数据,可以得出的结论是。
③造成此结果的原因可能是。
(5)、在走访调查中,小明同学收集了某铅酸蓄电池处理厂排出的废水样品,为了判断废水中含铅的浓度是否符合排放标准,他设计了如下方案并进行了实验:
上述实验中如果缺少操作M,所测得结果会 (填“偏大”、“偏小”、或“无影响”)。
33.(1)、汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式。
(2)、若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1 , 反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近;
②a、b、c三点CO的转化率从大到小的顺序为;a、c、d三点的平衡常数从大到小的顺序为。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为。
(3)、若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为(填化学式);A电极的电极反应式为;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为。(4)、已知:25℃时,H2C2O4的电离常数Ka1=5.9×10-2 , Ka2=6.4×10-5 , 则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为 , 若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈(填“酸性”“碱性”或“中性”)。34. 乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:(1)、在恒温、恒容密闭容器中发生反应:H2C2O4(s) H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体密度不再变化 D、混合气体平均摩尔质量保持不变(2)、草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示: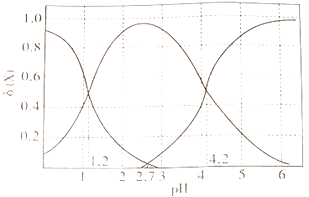
①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为(填标号)。
A.强酸性
B.弱酸性
C.中性
D.碱性
②25℃时,反应C2O42-+H2C2O4- 2HC2O4-的平衡常数的对数值1gK=。
(3)、向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)10 mL(填“>”“=”或“<”)。(4)、草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是; 该过程中发生反应的离子方程式为;滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为。35. 某浅绿色晶体X[x(NH4)SO4·yFeSO4·xH2O]在分析化学中常用作还原剂。为确定其组成。某小组同学进行如下实验:I.NH4+含量的测定
采用蒸馏法,蒸馏装置如图所示.

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入圆底烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,加热蒸馏;
④用0.120mo l•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶.
(1)、仪器M的名称为。(2)、步骤③中,发生的氧化还原反应的化学方程式为。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”。“处理”的操作方法是。(3)、步骤④中,若振荡时锥形瓶中有液体溅出,则所侧得的n(NH4+)的值将(填“偏大”、“偏小”或“不变”).(4)、Ⅱ.SO42-的测定采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X于烧杯中,加水溶解,边搅拌边加入过量的 BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重.得沉淀质量69.90g.
步骤①中,判断 BaCl2溶液已过量的实验操作和现象是。
(5)、步骤②中,采用冷水洗涤沉淀,其主要目的是 .(6)、综合实验I、Ⅱ,通过计算得出晶体X的化学式为 , 实验Ⅰ的步骤①中,溶液中离子浓度由大到小的顺序为。