高考二轮复习知识点:难溶电解质的溶解平衡及沉淀转化的本质4
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 工业上以为原料生产 , 对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是( )
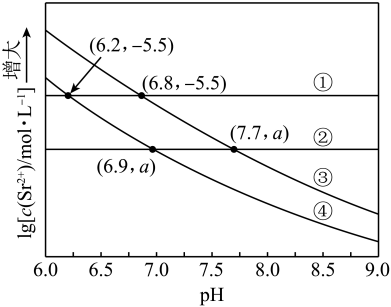 A、反应的平衡常数 B、 C、曲线④代表含的溶液的变化曲线 D、对含且和初始浓度均为的混合溶液,时才发生沉淀转化2. 室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示(忽略沉淀对离子的吸附作用)。
A、反应的平衡常数 B、 C、曲线④代表含的溶液的变化曲线 D、对含且和初始浓度均为的混合溶液,时才发生沉淀转化2. 室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示(忽略沉淀对离子的吸附作用)。

若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , )。下列说法正确的是( )
A、a点:有白色沉淀生成 B、原溶液中 的浓度为 C、当 沉淀完全时,已经有部分 沉淀 D、b点:3. 常温下,向10mL0.1mol·L-1 NaX溶液和10mL0.1mol·L-1Na2Y溶液分别滴加0.1mol·L-1AgNO3溶液。滴加过程中pM[pM= -lgc (X )或-lgc (Y2-)]与所加溶液体积之间的关系如图所示(提示:不考虑NaX和Na2Y水解,AgX和Ag2Y均为难溶物)。下列说法正确的是( ) A、曲线I是向Na2Y溶液中滴加AgNO3溶液 B、若将c(NaX)改为0.2mol·L-1 ,则m点可平移至n点 C、m、p、w点所在溶液中c(Ag+):m>w>p D、Ag2Y(s) + 2X-(aq) 2AgX(s)+Y2-(aq)的平衡常数为107.64. 某温度下,CuS和的溶解曲线如图所示,其中 , , 为或 , 下列说法错误的是( )
A、曲线I是向Na2Y溶液中滴加AgNO3溶液 B、若将c(NaX)改为0.2mol·L-1 ,则m点可平移至n点 C、m、p、w点所在溶液中c(Ag+):m>w>p D、Ag2Y(s) + 2X-(aq) 2AgX(s)+Y2-(aq)的平衡常数为107.64. 某温度下,CuS和的溶解曲线如图所示,其中 , , 为或 , 下列说法错误的是( ) A、曲线Ⅰ是CuS的溶解曲线 B、 C、M点的坐标为(23,13) D、此温度下的饱和溶液:5. 已知:AgA、都是难溶盐。室温下,向体积均为10mL、浓度均为的NaA溶液、溶液中分别滴加的溶液,溶液中pX与溶液体积的关系如图所示[已知:或]。下列推断错误的是( )
A、曲线Ⅰ是CuS的溶解曲线 B、 C、M点的坐标为(23,13) D、此温度下的饱和溶液:5. 已知:AgA、都是难溶盐。室温下,向体积均为10mL、浓度均为的NaA溶液、溶液中分别滴加的溶液,溶液中pX与溶液体积的关系如图所示[已知:或]。下列推断错误的是( )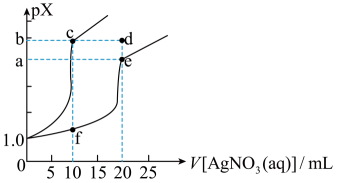 A、室温下, B、对应溶液中: C、室温下,在等量的水中,AgA溶解的物质的量更少 D、若变为 , 则c点向e点移动6. 常温下,某研究小组用数字传感器探究AgSCN的沉淀溶解平衡(AgSCN是白色沉淀)。实验测得悬浊液中溶解的SCN-浓度变化如图所示,其中a点表示AgSCN溶于KNO3溶液形成的悬浊液。下列说法错误的是( )
A、室温下, B、对应溶液中: C、室温下,在等量的水中,AgA溶解的物质的量更少 D、若变为 , 则c点向e点移动6. 常温下,某研究小组用数字传感器探究AgSCN的沉淀溶解平衡(AgSCN是白色沉淀)。实验测得悬浊液中溶解的SCN-浓度变化如图所示,其中a点表示AgSCN溶于KNO3溶液形成的悬浊液。下列说法错误的是( )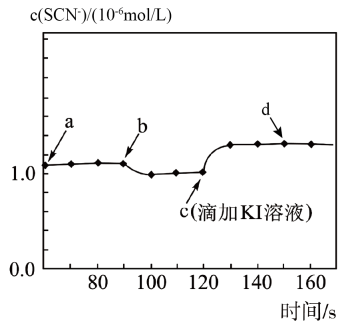 A、图中b点可能是加少量水稀释了 B、图中c点后有黄色沉淀生成 C、图中d点c(Ag+)<c(SCN-) D、由图可知:Ksp(AgI)<Ksp(AgSCN)7. 已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10mL、浓度均为0.1mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=—lgc(A—)或—lgc(B2—)]。下列推断错误的是( )
A、图中b点可能是加少量水稀释了 B、图中c点后有黄色沉淀生成 C、图中d点c(Ag+)<c(SCN-) D、由图可知:Ksp(AgI)<Ksp(AgSCN)7. 已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10mL、浓度均为0.1mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=—lgc(A—)或—lgc(B2—)]。下列推断错误的是( ) A、室温下,Ksp(Ag2B)=4×10-3a B、对应溶液中c(Ag+):e>f C、室温下,溶解度:S(AgA)<S(Ag2B) D、若c(AgNO3)变为0.05mol·L-1 , 则c点向e点移动8. 下列实验操作、现象和所得到的结论均正确的是( )
A、室温下,Ksp(Ag2B)=4×10-3a B、对应溶液中c(Ag+):e>f C、室温下,溶解度:S(AgA)<S(Ag2B) D、若c(AgNO3)变为0.05mol·L-1 , 则c点向e点移动8. 下列实验操作、现象和所得到的结论均正确的是( )选项
实验操作和现象
结论
A
向某无色溶液中通入过量的CO2气体,有白色沉淀产生
该溶液中一定含有SiO
B
向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
C
在MgSO4溶液中加入一小块Na,金属Na溶解,并生成固体
该固体为Mg
D
将浓硫酸滴到蔗糖表面固体变黑膨胀
浓硫酸只表现脱水性
A、A B、B C、C D、D9. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向新制的硫酸亚铁溶液中滴加邻二氮菲(
 )溶液,溶液变为橙红色
)溶液,溶液变为橙红色邻二氮菲能与亚铁离子形成配合物
B
向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解
Ag2O是两性氧化物
C
溴乙烷与NaOH的乙醇溶液混合、加热,将产生的气体通入盛有酸性KMnO4溶液的洗气瓶中,溶液褪色
反应生成了乙烯
D
向BaSO4固体中加入饱和Na2CO3溶液,过滤,沉淀洗净后加入足量稀盐酸,沉淀部分溶解,且产生气泡
A、A B、B C、C D、D10. 25℃时,三种金属氢氧化物的溶解度(纵坐标以溶解金属质量/mg·L-1表示)与溶液中pH的关系如图所示。下列说法错误的是( ) A、Cu(OH)2的溶度积比Zn(OH)2的小 B、Ksp[Cu(OH)2]=×10-17 C、反应2AgOH+Cu2+=2Ag+ +Cu(OH)2的平衡常数K= D、将Zn(OH)2加入pH=10的溶液中,可能发生Zn(OH)2+2OH-= ZnO+2H2O11. 下列方案设计、现象、解释或结论有错误的是( )
A、Cu(OH)2的溶度积比Zn(OH)2的小 B、Ksp[Cu(OH)2]=×10-17 C、反应2AgOH+Cu2+=2Ag+ +Cu(OH)2的平衡常数K= D、将Zn(OH)2加入pH=10的溶液中,可能发生Zn(OH)2+2OH-= ZnO+2H2O11. 下列方案设计、现象、解释或结论有错误的是( )选项
实验操作
实验现象
解释或结论
A
摘下几根火柴头浸于水中,一定时间后取适量溶液于试管中,加溶液、稀硝酸和溶液。
出现白色沉淀
火柴头含有氯元素
B
向的溶液中加入几滴溶液,制得新制然后加入适量牙膏
绛蓝色溶液
牙膏中存在甘油
C
将石蜡油与碎瓷片混合加强热,产生的气体通入酸性重铬酸钾钾溶液中
酸性重铬酸钾溶液褪色
石蜡油加强热产生的气体是不饱和烃
D
取溶液于试管中,滴加溶液,待不再出现白色沉淀后,再滴加溶液
白色沉淀转化为黄色沉淀
溶解度大于
A、A B、B C、C D、D12. 25℃时,在c(HR)+c(R-)=0.1mol·L-1的溶液中-lgc(R-)与-lgc(OH-)、难溶盐MR饱和溶液中-lgc(R-)与-lgc(M+)的关系如图所示(忽略离子浓度调节过程中溶液体积变化)。下列说法正确的是( ) A、曲线L1表示-lgc(R-)与-lgc(OH-)的关系 B、25℃时,Ksp(MR)的数量级为10-20 C、pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<<c(R-) D、加水稀释,两种溶液中的所有离子浓度均减小
A、曲线L1表示-lgc(R-)与-lgc(OH-)的关系 B、25℃时,Ksp(MR)的数量级为10-20 C、pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<<c(R-) D、加水稀释,两种溶液中的所有离子浓度均减小二、多选题
-
13. 某元素M的氢氧化物在水中的溶解反应为:、 , 25℃,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是( )
 A、曲线①代表与pH的关系 B、的约为 C、向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在 D、向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在14. 下列根据实验操作和现象所得出的结论正确的是( )
A、曲线①代表与pH的关系 B、的约为 C、向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在 D、向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在14. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
实验结论
A
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2 min后,试管里出现凝胶
酸性:盐酸>硅酸
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
向5 mL 0.1 mol·L-1KI溶液中加入0.1 mol·L-1的FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下层溶液滴加5滴KSCN溶液,出现血红色
反应2Fe3++2I-=2Fe2++I2是有一定限度的
D
在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D15. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是( ) A、Ksp(Ag2CrO4)的数值为10-9.92 B、a点表示的是Ag2CrO4的不饱和溶液 C、沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好 D、Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO4²-(aq)的平衡常数为1012.0816. (多选)在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10﹣13 , 下列说法错误的是( )
A、Ksp(Ag2CrO4)的数值为10-9.92 B、a点表示的是Ag2CrO4的不饱和溶液 C、沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好 D、Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO4²-(aq)的平衡常数为1012.0816. (多选)在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10﹣13 , 下列说法错误的是( ) A、t℃时,Ag2CrO4的Ksp为1×10﹣8 B、在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C、一定温度下Y点和Z点时Ag2CrO4的Ksp相等 D、在t℃时,Ag2CrO4(s)+2Br﹣(aq)⇌2AgBr(s)+CrO42﹣(aq)平衡常数K=4.0×101017. 某温度下,硫酸钡与水组成的混合物中,存在下列过程:BaSO4(s)⇌Ba2++SO ,向其中加入少量硫酸钠固体,下列说法错误的是( )A、BaSO4的电离程度减小 B、BaSO4溶解的量减小 C、c(Ba2+)与c(SO42﹣)的乘积增大 D、溶液的导电能力增强18. (多选)下列说法中正确的是( )A、相同温度下,同浓度的溶液的pH:CH3COONa>Na2CO3>NaHCO3>NaClO B、同温同浓度的三种溶液:①(NH4)2SO4②(NH4)2CO3③(NH4)2FeSO4 c (NH4+)大小:②>①>③ C、室温时pH=8的NaOH溶液与pH=8的氨水等体积混合pH等于8 D、向1mL0.1mol/L AgNO3溶液中滴加3~5滴0.1mol/L NaCl溶液,产生白色沉淀,再滴入KI溶液,沉淀变成黄色,由此推出:Ksp(AgI)<Ksp(AgCl)19. (多选)把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )A、溶液中Ca2+数目减少 B、溶液中c(Ca2+)增大 C、溶液pH值不变 D、溶液pH值增大20. 下列叙述正确的是( )A、c(NH )相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) B、向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 C、0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2溶液混合后,溶液的pH=1 D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32﹣)+c(OH﹣)21. 黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁和铝的硅酸盐,以及 、 等。采用以下工艺流程可由黏土钒矿制备 。
A、t℃时,Ag2CrO4的Ksp为1×10﹣8 B、在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C、一定温度下Y点和Z点时Ag2CrO4的Ksp相等 D、在t℃时,Ag2CrO4(s)+2Br﹣(aq)⇌2AgBr(s)+CrO42﹣(aq)平衡常数K=4.0×101017. 某温度下,硫酸钡与水组成的混合物中,存在下列过程:BaSO4(s)⇌Ba2++SO ,向其中加入少量硫酸钠固体,下列说法错误的是( )A、BaSO4的电离程度减小 B、BaSO4溶解的量减小 C、c(Ba2+)与c(SO42﹣)的乘积增大 D、溶液的导电能力增强18. (多选)下列说法中正确的是( )A、相同温度下,同浓度的溶液的pH:CH3COONa>Na2CO3>NaHCO3>NaClO B、同温同浓度的三种溶液:①(NH4)2SO4②(NH4)2CO3③(NH4)2FeSO4 c (NH4+)大小:②>①>③ C、室温时pH=8的NaOH溶液与pH=8的氨水等体积混合pH等于8 D、向1mL0.1mol/L AgNO3溶液中滴加3~5滴0.1mol/L NaCl溶液,产生白色沉淀,再滴入KI溶液,沉淀变成黄色,由此推出:Ksp(AgI)<Ksp(AgCl)19. (多选)把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )A、溶液中Ca2+数目减少 B、溶液中c(Ca2+)增大 C、溶液pH值不变 D、溶液pH值增大20. 下列叙述正确的是( )A、c(NH )相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) B、向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 C、0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2溶液混合后,溶液的pH=1 D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32﹣)+c(OH﹣)21. 黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁和铝的硅酸盐,以及 、 等。采用以下工艺流程可由黏土钒矿制备 。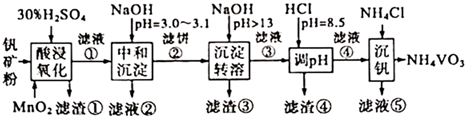
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀pH
1.9
7.0
8.9
3.0
8.1
完全沉淀pH
3.2
9.0
10.9
4.7
10.1
下列说法错误的是( )
A、“酸浸氧化”中,只有 、 两种离子被氧化 B、随滤液②可除去的金属离子只有 、 和 C、“沉淀转溶”得到滤渣③的主要成分是 D、“调 ”的目的是为了除去铝元素22. 已知:常温下, 。某温度下,饱和溶液中 与 、 的关系如图所示。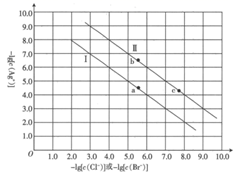
下列说法正确的是( )
A、曲线Ⅱ代表 的沉淀溶解平衡曲线 B、常温下, 的 C、常温下,当 时,饱和溶液中 D、加入 固体可使溶液由 点沿直线变为 点23. 常温下,向10mL一定浓度的硝酸银溶液中,逐滴加入0.1mol·L-1的氨水,反应过程中-1gc(Ag+)或-1gc[Ag(NH3) ]与加入氨水体积的关系如图,下列说法错误的是( ) A、原硝酸银溶液的浓度是0.1 mol·L-1 B、反应生成氢氧化银的Ksp(AgOH)的数量级为10-8 C、溶液b点NH4+的浓度小于溶液C点NH的浓度 D、溶液m点c(NO )>c(Ag+)+C[Ag(NH3) ]+c(NH )
A、原硝酸银溶液的浓度是0.1 mol·L-1 B、反应生成氢氧化银的Ksp(AgOH)的数量级为10-8 C、溶液b点NH4+的浓度小于溶液C点NH的浓度 D、溶液m点c(NO )>c(Ag+)+C[Ag(NH3) ]+c(NH )三、非选择题
-
24. 白云石的主要化学成分为 , 还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
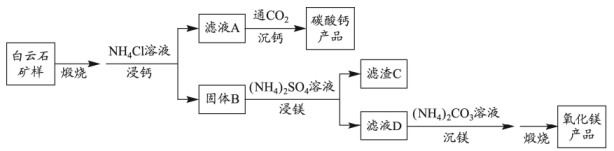
已知:
物质
(1)、白云石矿样煅烧完全分解的化学方程式为。(2)、用量对碳酸钙产品的影响如下表所示。氧化物()浸出率/%
产品中纯度/%
产品中Mg杂质含量/%
(以计)
计算值
实测值
2.1∶1
98.4
1.1
99.1
99.7
——
2.2∶1
98.8
1.5
98.7
99.5
0.06
2.4∶1
99.1
6.0
95.2
97.6
2.20
备注:ⅰ、浸出率=(浸出的质量/煅烧得到的质量)(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
(3)、“浸镁”过程中,取固体B与一定浓度的溶液混合,充分反应后的浸出率低于60%。加热蒸馏,的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是。(4)、滤渣C中含有的物质是。(5)、该流程中可循环利用的物质是。25. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
26. 某废催化剂(主要含有WO3、V2O5、V2O4、V2O3、少量杂质Fe2O3、SiO2等)是能源行业产生的难处理多金属危险废物,其回收利用已成为当前研究的热点和重点。一种处理流程如下: (1)、已知草酸晶体(H2C2O4·2H2O)的溶解度随温度的变化如图所示。草酸酸浸时控制温度为90℃,理由是 , 实验室中宜选用的加热方式为(“水浴加热”或“油浴加热”)。
(1)、已知草酸晶体(H2C2O4·2H2O)的溶解度随温度的变化如图所示。草酸酸浸时控制温度为90℃,理由是 , 实验室中宜选用的加热方式为(“水浴加热”或“油浴加热”)。 (2)、已知“浸取液”的主要成分 、 、 和过量的H2C2O4 , 滤渣的主要成分是;Fe2O3与H2C2O4的反应的离子方程式为。(3)、“浓缩液”经过两步氧化实现金属元素的分离。 在溶液中存在平衡 WO2(C2O4)+ ,WO2(C2O4) + ,当溶液中的草酸氧化分解率到达67%时, 开始水解生成 。
(2)、已知“浸取液”的主要成分 、 、 和过量的H2C2O4 , 滤渣的主要成分是;Fe2O3与H2C2O4的反应的离子方程式为。(3)、“浓缩液”经过两步氧化实现金属元素的分离。 在溶液中存在平衡 WO2(C2O4)+ ,WO2(C2O4) + ,当溶液中的草酸氧化分解率到达67%时, 开始水解生成 。①写出 水解的离子方程式;
②已知 离子在溶液中也存在类似 的电离平衡,下列有关 氧化 离子生成V2O5·H2O的说法错误的是(填标号)。
A.加入 促使 离子的电离平衡正向移动
B.该过程涉及了2个以上的化学平衡
C.VO2+离子水解生成V2O5·H2O
(4)、已知 K1;FeC2O4 Fe2++ K2 , 当“滤液1”中 时, 的浓度为mol/L。(已知 )27. 铈可用作优良的环保材料,现以氟碳铈矿(CeFCO3 , 含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示:
已知:①滤渣I主要成分是难溶于水的Ce(BF4)3;
②常温下,K[Fe(OH)3]=8×10-38 , K[Ce(OH)3]=1×10-22 , lg 2=0.3;
③溶液中离子浓度≤1.0×10-5mol·L-1时视为沉淀完全。
回答下列问题:
(1)、粉碎“焙烧”时,氧化数据如表所示:空气氧化法
氧化温度/℃
氧化率/%
氧化时间/h
暴露空气中
450~500
80
14
对流空气氧化炉中
450~500
98
6
在对流空气氧化炉中可大大缩短氧化时间的原因是。
(2)、用盐酸和H3BO3提取Ce元素时,体现盐酸的性质有“滤渣I”用饱和KCl溶液溶解时发生复分解反应,则“滤渣II”主要成分为(填化学式)。(3)、常温下,“滤液I”中c(Ce3+)=0.1mol·L-1 , 用氨水调pH的范围是。(4)、写出“焙烧”过程中反应的化学方程式:若Ce2(CO3)3经充分焙烧质量减少5.8t,则获得CeO2的质量为t。(5)、用过量铝粉还原CeO2即可得Ce,反应的化学方程式为;铝粉必须过量的原因是。28. 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪(ScCl3)是一种可溶于水的灰白色固体,是制备钪的重要原料。工业上利用固体废料“赤泥”(含有Fe2O3、SiO2、Sc2O3、TiO2等)制取ScCl3 , 请结合流程回答以下问题:
已知:①TiO2难溶于盐酸。
②Ksp[Sc(OH)3]=1.0×10-30 , Ksp[Fe(OH)3]=1.0×10-38
(1)、滤渣1的主要成分是(填化学式)。(2)、“酸浸”时温度过高,酸浸速率反而减慢,其原因是。(3)、常温下,“调pH”时,溶液中c(Sc3+)=0.001mol·L-1 , 为除去杂质离子,应控制的pH范围是(当溶液中某离子浓度c≤1.0 10-5mol·L-1时,可认为该离子沉淀完全)。(4)、已知Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3+6H+ , 此反应的平衡常数K=(用含a、b、c的代数式表示)。(5)、“加热氯化”过程中排出的气体主要有(填化学式)。(6)、传统制备ScCl3的方法是先得到ScCl3·6H2O沉淀,再高温脱水得ScCl3 , 但通常含有ScOCl杂质,原因是。(7)、草酸钪晶体[Sc2(C2O4)3·6H2O]在空气中加热, 随温度的变化情况如下图所示。250℃时,晶体的主要成分是(填化学式),550~850℃,反应的化学方程式为。(已知Sc2(C2O4)3·6H2O的摩尔质量为462g·mol-1) 29. 锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。回答下列问题:
29. 锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。回答下列问题:
已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:


 +HCOOH(1)、已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为。(2)、“还原酸浸”过程中主要反应的离子方程式为。(3)、实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是 , 为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为。(4)、整个流程中可循环利用的物质是。获得MnSO4∙H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是。(5)、加入Na2CO3溶液的目的是将PbSO4转化为PbCO3 , Na2CO3溶液的最小浓度为mol·L–1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由。[已知:20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2 , Ksp(PbCO3)=7.4×10-14mol2·L-2 , 1.262≈1.6]30. 高纯硫酸锰是合成镍钴锰三元正极材料的原料,工业上可由菱锰矿(主要成分MnCO3 , 还含有Fe、Mg、Ca、Na、K等元素)制备,工艺流程如图所示。回答下列问题:
+HCOOH(1)、已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为。(2)、“还原酸浸”过程中主要反应的离子方程式为。(3)、实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是 , 为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为。(4)、整个流程中可循环利用的物质是。获得MnSO4∙H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是。(5)、加入Na2CO3溶液的目的是将PbSO4转化为PbCO3 , Na2CO3溶液的最小浓度为mol·L–1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由。[已知:20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2 , Ksp(PbCO3)=7.4×10-14mol2·L-2 , 1.262≈1.6]30. 高纯硫酸锰是合成镍钴锰三元正极材料的原料,工业上可由菱锰矿(主要成分MnCO3 , 还含有Fe、Mg、Ca、Na、K等元素)制备,工艺流程如图所示。回答下列问题: (1)、写出提高溶浸速率的两种可行措施。(2)、写出得到粗品MnCO3的离子方程式。(3)、由粗品MnCO3得到较纯MnCO3需要用纯水洗涤2-3次,洗涤粗品MnCO3的目的是。(4)、常加入的绿色氧化剂x是 , 调节pH,制得无铁硫酸锰粗液,此时溶液的pH至少为[当Fe3+浓度小于1×10-5mol/L时,可以认为Fe3+沉淀完全,Ksp(Fe(OH)3=1.0×10-38]。(5)、深度除杂步骤主要利用沉淀转化除去Ca2+和Mg2+ , 需适当增大溶液pH,其原因是。滤渣2的主要成分是。(6)、三元层状材料LiNi2/3Co(1-x)/6Mn(1+x)/6O2是一类稳定性高的锂电池正极材料。若已知材料中Co和Mn的化合价分别是+3和+4价,当x=0.4时,材料中Ni2+与Ni3+的数目比为。31. 锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如下。回答下列问题:
(1)、写出提高溶浸速率的两种可行措施。(2)、写出得到粗品MnCO3的离子方程式。(3)、由粗品MnCO3得到较纯MnCO3需要用纯水洗涤2-3次,洗涤粗品MnCO3的目的是。(4)、常加入的绿色氧化剂x是 , 调节pH,制得无铁硫酸锰粗液,此时溶液的pH至少为[当Fe3+浓度小于1×10-5mol/L时,可以认为Fe3+沉淀完全,Ksp(Fe(OH)3=1.0×10-38]。(5)、深度除杂步骤主要利用沉淀转化除去Ca2+和Mg2+ , 需适当增大溶液pH,其原因是。滤渣2的主要成分是。(6)、三元层状材料LiNi2/3Co(1-x)/6Mn(1+x)/6O2是一类稳定性高的锂电池正极材料。若已知材料中Co和Mn的化合价分别是+3和+4价,当x=0.4时,材料中Ni2+与Ni3+的数目比为。31. 锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如下。回答下列问题:
已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:


 +HCOOH(1)、请写出Mn原子基态价层电子排布式。(2)、已知Pb2Mn8O16中 Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为。(3)、“还原酸浸”过程中主要反应的离子方程式为。(4)、实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为。(5)、整个流程中可循环利用的物质是。获得MnSO4·H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是。(6)、加入Na2CO3溶液的目的是将PbSO4转化为PbCO3 , Na2CO3溶液的最小浓度为mol/L(保留两位小数)。判断沉淀转化能否彻底进行并说明理由。[已知: 20℃时Ksp (PbSO4)=1.6×10-8mol2·L-2 , Ksp (PbCO3)=7.4×10-14mo12·L-2 , 1.262≈1.6]32. 金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能。赤泥是铝土矿加工过程中产生的废料,含有丰富的钪元素,另含有Fe2O3、SiO2、Al2O3等氧化物。一种从赤泥中提取氧化钪的工艺流程如图所示(P2O4是一种磷酸酯萃取剂)。
+HCOOH(1)、请写出Mn原子基态价层电子排布式。(2)、已知Pb2Mn8O16中 Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为。(3)、“还原酸浸”过程中主要反应的离子方程式为。(4)、实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为。(5)、整个流程中可循环利用的物质是。获得MnSO4·H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是。(6)、加入Na2CO3溶液的目的是将PbSO4转化为PbCO3 , Na2CO3溶液的最小浓度为mol/L(保留两位小数)。判断沉淀转化能否彻底进行并说明理由。[已知: 20℃时Ksp (PbSO4)=1.6×10-8mol2·L-2 , Ksp (PbCO3)=7.4×10-14mo12·L-2 , 1.262≈1.6]32. 金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能。赤泥是铝土矿加工过程中产生的废料,含有丰富的钪元素,另含有Fe2O3、SiO2、Al2O3等氧化物。一种从赤泥中提取氧化钪的工艺流程如图所示(P2O4是一种磷酸酯萃取剂)。
回答下列问题:
(1)、写出赤泥经盐酸处理后所得“浸渣”与强碱溶液反应的离子方程式。(2)、赤泥“酸浸”时温度过高,酸浸速率反而下降,其原因是。(3)、P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为、;萃取后“盐酸洗涤”的目的是。P2O4浓度对萃取率的影响如表:试验编号
P2O4浓度/%
分相情况
钪萃取率/%
铁萃取率/%
1-1
1
分相快
90.76
15.82
1-2
2
分相容易
91.53
19.23
1-3
3
分相容易
92.98
13.56
1-4
4
有第三相
90.69
30.12
1-5
5
轻微乳化
91.74
39.79
料液温度对分离系数的影响如图:
 (4)、反萃取时,Sc3+完全沉淀(浓度为1.0×10-6mol·L-1)时,反萃液的pH为。(已知:Ksp[Sc(OH)3]=8.00×10-31 , lg2=0.30,结果保留小数点后两位)(5)、为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=。(6)、草酸钪晶体灼烧分解反应方程式为 , 其固体副产物主要为。33. 镓及其化合物在国防技术、航空航天技术等领域扮演着重要的角色。一种利用湿法提锌的浸出渣(主要含一定量和的化合物)为原料制备高纯镓的流程如图所示:
(4)、反萃取时,Sc3+完全沉淀(浓度为1.0×10-6mol·L-1)时,反萃液的pH为。(已知:Ksp[Sc(OH)3]=8.00×10-31 , lg2=0.30,结果保留小数点后两位)(5)、为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=。(6)、草酸钪晶体灼烧分解反应方程式为 , 其固体副产物主要为。33. 镓及其化合物在国防技术、航空航天技术等领域扮演着重要的角色。一种利用湿法提锌的浸出渣(主要含一定量和的化合物)为原料制备高纯镓的流程如图所示:
已知:①溶液中的会对电解溶液造成影响
②与可以发生反应
③本流程温度下,;;
请回答下列问题:
(1)、滤渣1的主要成分为(填化学式)。(2)、“氧化”过程中发生反应的离子方程式为。(3)、“调沉淀除杂”过程需加入聚丙烯酰胺絮凝剂并加热的目的是。(4)、溶液中的各种形态粒子的物质的量分数随溶液变化的关系如图所示,用“调沉淀除杂”的理论范围为。(溶液中剩余离子浓度小于时沉淀完全) (5)、试剂a的作用是。(6)、流程中可以循环利用的物质是(填化学式)。(7)、、、可用于制取第三代半导体材料,熔点如表所示,分析其变化原因:。
(5)、试剂a的作用是。(6)、流程中可以循环利用的物质是(填化学式)。(7)、、、可用于制取第三代半导体材料,熔点如表所示,分析其变化原因:。物质
熔点
34. 某学习小组在实验室进行了有关碘化铅(PbI2)的实验探究。回答下列问题:(1)、I.制备PbI2的悬浊液KI溶液和Pb(NO3)2溶液反应,会产生金黄色的PbI2沉淀,形成美丽的“黄金雨”。
①KI溶液在空气中久置会变质,其原因是。
②生成PbI2的化学方程式为。充分反应后,经系列操作得到纯净的PbI2固体,向其中加入蒸馏水,得到PbI2悬浊液。
(2)、II.探究浓度对PbI2沉淀溶解平衡的影响【查阅资料】ⅰ.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;
ii.26.5℃时,PbI2饱和溶液的电导率为368μS•cm-1。
稀释对PbI2溶解平衡的影响
26.5℃时,向PbI2悬浊液中加入一定体积的蒸馏水,通过图甲所示装置测定电导率,并得到电导率随时间变化的曲线(图乙)。

①实验装置中仪器X的名称为。
②由电导率变化曲线可知:实验中通过仪器X加入蒸馏水的方式是(填标号)。
A.连续逐滴加入 B.分三次快速放入 C.一次性快速放入
③曲线图中,段(用字母表示,任写一段)表示PbI2固体的溶解达到平衡状态:c→d段溶液的电导率逐渐增大的原因是导致了溶液中离子浓度不断增大。
(3)、c(KI)对PbI2沉淀溶解平衡的影响26.5℃时,将PbI2悬浊液静置后,取200mL上层清液[c(I-)=2.5×10-3mol·L-1]于烧杯中,另取蒸馏水于相同规格的烧杯中进行对比实验,再分别向其中加入1mol·L-1KI溶液。实验数据记录如表:
KI溶液累计加入量/mL
电导率/(μS•cm-1)
PbI2饱和溶液
蒸馏水
0
368
4
0.50
A1
B1
1.00
A2
B2
①上述实验过程中,增大PbI2饱和溶液中I-的浓度,可观察到的实验现象是。
②利用蒸馏水进行对比实验时,所取蒸馏水的体积为mL。
③表格数据A2-A1B2-B1(填“大于”“小于”或“等于”),说明增大KI的浓度,PbI2沉淀溶解平衡向生成沉淀的方向移动。
35. 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含Ni、Fe、P,还含有少量Fe、Cu、Zn的磷化物)为原料生产硫酸镍晶体(NiSO4•6H2O)的工艺流程如图:
已知:电解时,选用2mol·L-1硫酸溶液为电解液。
回答下列问题:
(1)、先将高磷镍铁制成电极板,“电解”时,该电极板作极;阴极产物主要为 , 此外,溶液中的Cu2+有部分在阴极放电。(2)、“除铁磷”时,溶液中Fe2+先被氧化为Fe3+ , 该过程发生反应的离子方程式为;再加入Na2CO3调pH=2,并将溶液加热至50℃,形成铁、磷共沉淀。(3)、“滤渣2”的主要成分为ZnS和(填化学式)。(4)、“沉镍”时,为确保镍沉淀完全,理论上应调节溶液pH≥(已知:25℃时,Ksp[Ni(OH)2]=2×10-15;lg2=0.3;当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。(5)、“母液”中的溶质主要有、(填化学式)。(6)、硫代硫酸镍(NiS2O3)在冶金工业中有广泛应用。向上述流程制得的NiSO4溶液中加入BaS2O3固体,充分反应后,过滤得到NiS2O3溶液;再向该溶液加入无水乙醇,析出NiS2O3晶体(已知:25℃时,Ksp(BaSO4)=1.0×10-10、Ksp(BaS2O3)=1.6×10-5)。①生成NiS2O3的化学方程式为;该反应可以进行得较完全,结合相关数据说明理由:。
②加入无水乙醇有利于NiS2O3晶体析出,其原因是。