高考二轮复习知识点:难溶电解质的溶解平衡及沉淀转化的本质2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
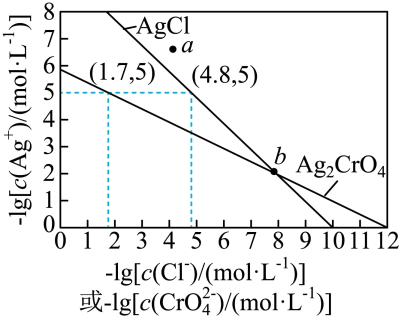
下列说法正确的是
A、a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀 B、b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4) C、Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9 D、向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀2. 向饱和溶液(有足量固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。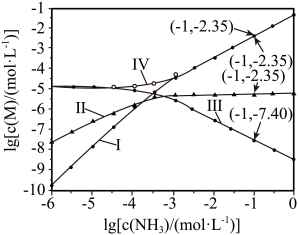
下列说法错误的是
A、曲线I可视为溶解度随浓度变化曲线 B、的溶度积常数 C、反应的平衡常数K的值为 D、时,溶液中3. 下列说法正确的是A、FeS溶于稀硫酸,而CuS不溶于稀硫酸,则 B、向盐酸中加入氨水至中性,溶液中 C、0.01 溶液: D、向丙烯醛中加入溴水,溴水褪色,证明丙烯醛中含有碳碳双键4. 由实验操作和现象,可得出相应正确结论的是( )实验操作
现象
结论
A.
向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的悬浊液
无砖红色沉淀
蔗糖未发生水解
B.
向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中
溶液变浑浊
酸性:碳酸>苯酚
C.
检验铁锈中是否含有二价铁
将铁锈溶于浓盐酸,滴入溶液,紫色褪去
铁锈中含有二价铁
D.
向溶液中滴入2滴溶液,再滴入2滴溶液
先产生白色沉淀,滴入溶液后白色沉淀逐渐变为蓝色
A、A B、B C、C D、D5. 25℃时,在c(HR)+c(R-)=0.1mol·L-1的溶液中-lgc(R-)与-lgc(OH-)、难溶盐MR饱和溶液中-lgc(R-)与-lgc(M+)的关系如图所示(忽略离子浓度调节过程中溶液体积的变化)。下列说法错误的是 A、曲线L2表示-lgc(R-)与-lgc(OH-)的关系 B、25℃时,Ksp(MR)的数量级为10-20 C、加水稀释,两种溶液中的离子浓度不一定都减小 D、pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<c(R-)6. 氯化亚铜(CuCl)是一种难溶于水的白色固体,常温下,CuCl(s)Cu+(aq)+Cl-(aq) Ksp=1.2×10-6。在氯离子浓度较大的体系中,氯化亚铜发生溶解,生成两种配合物离子:CuCl(s)+Cl-(aq)=(aq) K1=0.36;(aq)+Cl-(aq)(aq) K2。用盐酸溶解时,溶液中含铜粒子分布分数(δ)与c(Cl-)的关系如图所示。下列说法错误的是
A、曲线L2表示-lgc(R-)与-lgc(OH-)的关系 B、25℃时,Ksp(MR)的数量级为10-20 C、加水稀释,两种溶液中的离子浓度不一定都减小 D、pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<c(R-)6. 氯化亚铜(CuCl)是一种难溶于水的白色固体,常温下,CuCl(s)Cu+(aq)+Cl-(aq) Ksp=1.2×10-6。在氯离子浓度较大的体系中,氯化亚铜发生溶解,生成两种配合物离子:CuCl(s)+Cl-(aq)=(aq) K1=0.36;(aq)+Cl-(aq)(aq) K2。用盐酸溶解时,溶液中含铜粒子分布分数(δ)与c(Cl-)的关系如图所示。下列说法错误的是 A、常温下,反应的平衡常数K1>K2 B、图中交点处溶液中:c(H+)-c(OH-)>2c(Cl-) C、Cu+(aq)+2Cl-(aq)(aq)的平衡常数K=3.0×105 D、常温下,若溶液中几乎不含Cu+ , 则c(Cl-)至少大于0.12mol·L-17. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知Ksp(ZnS)>Ksp(CuS)。下列说法错误的是
A、常温下,反应的平衡常数K1>K2 B、图中交点处溶液中:c(H+)-c(OH-)>2c(Cl-) C、Cu+(aq)+2Cl-(aq)(aq)的平衡常数K=3.0×105 D、常温下,若溶液中几乎不含Cu+ , 则c(Cl-)至少大于0.12mol·L-17. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知Ksp(ZnS)>Ksp(CuS)。下列说法错误的是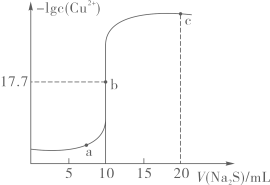 A、a、b两点CuS的溶度积Ksp相等 B、常温下,CuS的溶度积Ksp的数量级为10-36 C、c点溶液中:c(Cl-)>c(Na+)>c(S2-)>c(OH-)>c(H+) D、闪锌矿(ZnS)遇到硫酸铜溶液可转变为铜蓝(CuS)8. 下列实验操作、现象均正确且能得出相应结论的是
A、a、b两点CuS的溶度积Ksp相等 B、常温下,CuS的溶度积Ksp的数量级为10-36 C、c点溶液中:c(Cl-)>c(Na+)>c(S2-)>c(OH-)>c(H+) D、闪锌矿(ZnS)遇到硫酸铜溶液可转变为铜蓝(CuS)8. 下列实验操作、现象均正确且能得出相应结论的是实验操作
实验现象
结论
A
将Fe3O4粉末溶于盐酸,再向其中加入少量酸性KMnO4溶液
KMnO4溶液褪色
Fe3O4中含有Fe(II)
B
向淀粉溶液中加入稀硫酸,水浴加热后,再加入少量新制氢氧化铜,加热
产生砖红色沉淀
淀粉的水解产物中有葡萄糖
C
NaHCO3溶液与NaAlO2溶液混合
产生白色沉淀
结合H+的能力:<
D
向10mL0.1mol·L-1AgNO3溶液中先加入5mL0.1mol·L-1KCl溶液,再加入5mL1mol·L-1KI溶液
先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A、A B、B C、C D、D9. 298K时,BaSO4与BaCO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
已知101.4=25
A、298K时,BaSO4的溶解度小于BaCO3的溶解度 B、U点坐标为(4,4.8) C、作为分散质BaSO4 , W点v(沉淀)<v(溶解) D、对于沉淀溶解平衡BaSO4(s)+CO(aq)BaCO3(s)+SO(aq),其平衡常数K=0.0410. 化学是一门以实验为基础的学科,下列有关实验的说法错误的是选项
实验
实验说明或者方案设计
A
测定中和反应的反应热
中和滴定的同时,使用温度传感器采集锥形瓶内溶液温度,测得中和反应的反应热数值可能偏低
B
比较Mg和Al的金属性强弱
将MgCl2溶液和AlCl3溶液分别与足量NaOH溶液反应
C
实验室制备氢氧化铁胶体
 图标提示全部需要
图标提示全部需要D
室温下,将AgCl和AgBr的饱和溶液等体积混合
已知Ksp(AgCl)=1.8×10-10 , Ksp(AgBr)=5.0×10-13 , 推测可能看到出现淡黄色沉淀
A、A B、B C、C D、D11. 工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),其主要的生产流程如下:
已知: K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定,难溶于醇等有机溶剂。下列说法错误的是:( )
A、反应②为3NaClO+2Fe( NO3)3+10NaOH= 2Na2FeO4↓+3NaCl+6NaNO4+5H2O B、由反应③可知,此温度下Kap(K2FeO4)>Kap(Na2FeO4) C、“提纯”步骤的洗涤剂可以选用CH3COOK溶液、异丙醇 D、K2FeO4可用于水的消毒12. 常温下,分别向浓度均为的NaX溶液、溶液滴加溶液,pM与溶液体积的关系如图所示[ , 代表、],下列说法正确的是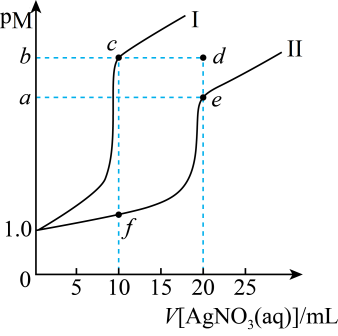 A、曲线Ⅱ表示的关系图 B、常温下,饱和溶液的物质的量浓度: C、若变为 , 则c点向e点移动 D、d点是的饱和溶液
A、曲线Ⅱ表示的关系图 B、常温下,饱和溶液的物质的量浓度: C、若变为 , 则c点向e点移动 D、d点是的饱和溶液二、多选题
-
13. AgCl()和(砖红色)都是难溶电解质,以对pCl和作图的沉淀平衡曲线如图所示。下列说法正确的是
 A、阴影区域AgCl和都沉淀 B、 C、向含有AgCl(s)的1.0 KCl溶液中加入 , 白色固体逐渐变为砖红色 D、用硝酸银标准液滴定溶液中的 , 作指示剂的浓度在0.01左右时滴定误差较小14. 常温下,难溶盐的饱和溶液中随的变化关系如图所示。下列叙述正确的是(忽略第二步水解)( )
A、阴影区域AgCl和都沉淀 B、 C、向含有AgCl(s)的1.0 KCl溶液中加入 , 白色固体逐渐变为砖红色 D、用硝酸银标准液滴定溶液中的 , 作指示剂的浓度在0.01左右时滴定误差较小14. 常温下,难溶盐的饱和溶液中随的变化关系如图所示。下列叙述正确的是(忽略第二步水解)( ) A、 B、常温下的 C、a点溶液: D、溶液时,15. 时,用溶液分别滴定三种溶液,[p表示负对数,M表示]随变化关系如图所示,已知 , 一般认为当溶液中离子浓度时,该离子沉淀完全。下列有关分析正确的是 ( )
A、 B、常温下的 C、a点溶液: D、溶液时,15. 时,用溶液分别滴定三种溶液,[p表示负对数,M表示]随变化关系如图所示,已知 , 一般认为当溶液中离子浓度时,该离子沉淀完全。下列有关分析正确的是 ( ) A、②代表滴定溶液的变化关系 B、滴定溶液至a点时,溶液中 C、滴定溶液至时,溶液中: D、如果完全除去工业废水中的 , 需要调节溶液的16. 常温下,用溶液分别滴定浓度均为的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是( )
A、②代表滴定溶液的变化关系 B、滴定溶液至a点时,溶液中 C、滴定溶液至时,溶液中: D、如果完全除去工业废水中的 , 需要调节溶液的16. 常温下,用溶液分别滴定浓度均为的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是( )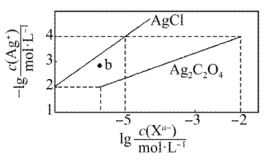 A、b点表示的饱和溶液 B、数量级为 C、的平衡常数为 D、向的混合液中滴入溶液时,先生成沉淀17. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
A、b点表示的饱和溶液 B、数量级为 C、的平衡常数为 D、向的混合液中滴入溶液时,先生成沉淀17. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
向某溶液中先滴加稀硝酸,再滴加溶液,出现白色沉淀
该溶液中一定含有
B
向溶液中滴加少量溶液,再滴加几滴淀粉溶液,溶液变蓝色
的氧化性比的强
C
向、的混合溶液中滴加少量溶液,有黑色沉淀生成
D
用试纸测得的溶液与的溶液的分别为3、5
酸性:
A、A B、B C、C D、D18. 已知相同温度下, , 升高温度,两者溶解度均增大。某温度下,饱和溶液中、与的关系如图所示。
下列说法错误的是( )
A、该温度下的的数量级为 B、该温度下,两溶液的 C、降低温度,曲线②可能向左下方平移为曲线③ D、根据曲线数据可以求得,的数值是5.519. 下列实验操作、现象和结论均正确的是( )选项
操作
现象
结论
A
两块相同的未经打磨的铝片,相同温度下分别投入5.0mL等浓度的溶液和溶液中
前者无明显现象,后者剧烈反应
能加速破坏铝片表面的氧化膜
B
向溶液中加入足量NaCl后再加入少量NaI溶液
白色沉淀转化为淡黄色沉淀
C
取少量溶液于试管中,先加入KSCN溶液,再滴加过量酸性高锰酸钾溶液
溶液变红色
溶液中含Fe2+
D
向铜与浓硫酸反应后的溶液中加入适量水稀释
溶液呈蓝色
溶液中存在
A、A B、B C、C D、D20. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。下列叙述正确的是( ) A、Ksp(Ag2C2O4)等于10-6 B、n点表示Ag2C2O4的不饱和溶液 C、向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 D、Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数为10821. 中国人从月球“挖”来“嫦娥石”,“嫦娥石”如图所示。它的主要成分是磷酸盐。(磷灰石)是磷酸盐之一。磷灰石在水中存在平衡: , 常温下,磷灰石的溶度积。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
A、Ksp(Ag2C2O4)等于10-6 B、n点表示Ag2C2O4的不饱和溶液 C、向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 D、Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数为10821. 中国人从月球“挖”来“嫦娥石”,“嫦娥石”如图所示。它的主要成分是磷酸盐。(磷灰石)是磷酸盐之一。磷灰石在水中存在平衡: , 常温下,磷灰石的溶度积。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
下列有关W的叙述错误的是( )
A、加入少量盐酸,减小 B、加入少量蒸馏水,减小 C、W中 D、对W加热,磷灰石的溶解度和都会增大22. 下列实验操作对应的实验结论错误的是( )编号
实验操作
实验结论
A
室温下,用pH试纸测定浓度均为的KCl溶液和溶液的pH,pH都等于7
两溶液中水的电离程度相同
B
向饱和溶液中通入适量 , 将所得气体一次通入品红溶液和澄清石灰水,品红不褪色,石灰水变浑浊
酸性:
C
将溶液滴入酸性溶液中,溶液紫红色褪去
具有还原性
D
相同温度下,向浓度均为的、的混合溶液中逐滴加入氨水,先出现蓝色沉淀
A、A B、B C、C D、D三、非选择题
-
23. 是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
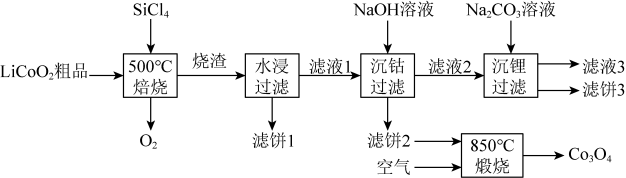
回答下列问题:
(1)、Co位于元素周期表第周期,第族。(2)、烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因。(3)、鉴别洗净的“滤饼3”和固体常用方法的名称是。(4)、已知 , 若“沉钴过滤”的pH控制为10.0,则溶液中浓度为。“850℃煅烧”时的化学方程式为。(5)、导致比易水解的因素有(填标号)。a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
24. LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3 , 含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下: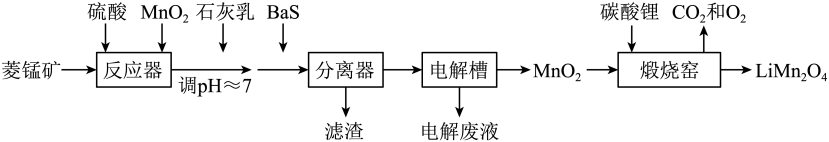
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)、硫酸溶矿主要反应的化学方程式为。为提高溶矿速率,可采取的措施(举1例)。(2)、加入少量MnO2的作用是。不宜使用H2O2替代MnO2 , 原因是。(3)、溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是。(4)、加入少量BaS溶液除去Ni2+ , 生成的沉淀有。(5)、在电解槽中,发生电解反应的离子方程式为。随着电解反应进行,为保持电解液成分稳定,应不断。电解废液可在反应器中循环利用。(6)、缎烧窑中,生成LiMn2O4反应的化学方程式是。25. 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)、煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为(填化学式)。(2)、水浸渣中主要有和。(3)、“沉淀”步骤调到弱碱性,主要除去的杂质是。(4)、“除硅磷”步骤中,使硅、磷分别以和的形式沉淀,该步需要控制溶液的以达到最好的除杂效果,若时,会导致;时,会导致。(5)、“分离钒”步骤中,将溶液调到1.8左右得到沉淀,在时,溶解为或在碱性条件下,溶解为或 , 上述性质说明具有_______(填标号)。A、酸性 B、碱性 C、两性(6)、“还原”步骤中加入焦亚硫酸钠()溶液,反应的离子方程式为。26. [Co( NH3)6]Cl3(三氯六氨合钴)是一种重要的化工产品,实验室制备过程如下:①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2 , 当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
(1)、[ Co( NH3)6]Cl3中Co的化合价是 , 该配合物中心离子的核外电子排布式为。(2)、“加热”应控温在60℃进行,控温方式可采取 , 温度不宜过高的原因是。(3)、溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[ Co(NH3)6]Cl3的化学方程式是。(4)、加入浓盐酸的作用是。(5)、沉淀滴定法测定产品中Cl-的质量分数:i.准确称取mg的产品,配制成100mL溶液,移取20mL于锥形瓶中;.
ii.滴加几滴K2CrO4溶液为指示剂,用c mol· L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl 1.3×10-6mol · L-1 , Ag2CrO4(砖红色)6.5×10-5mol ·L-1
①ii中,滴定至终点的现象是。
②制备的晶体中Cl-的质量分数是(列计算式即可)。
27. 从一种阳极泥(主要成分为Cu、Ag、Pt、Au、Ag2Se、Cu2S)中回收重金属的工艺流程如图所示:
已知:在碱性条件下很稳定。回答下列问题:
(1)、Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为。(2)、“滤渣I”的主要成分是(填化学式);加快“酸浸氧化”速率的措施有(填写一条即可)。(3)、萃取与反萃取的原理为:2RH+Cu2+R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是(填名称);该流程中的“反萃取剂”最好选用(填标号)。A.乙醇|B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)、已知:Ag++2[Ag(S2O3)2]3− K=2.80×1013AgCl(s)Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为;
②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:。
(5)、请从环保角度对该工艺流程提出合理的优化建议:(写出一条即可)。28. 电解金属锰阳极渣(主要成分 , 杂质为、、元素的化合物)和黄铁矿为原料可制备 , 其流程如图所示:
已知:、 , 回答下列问题:
(1)、锰原子价层电子的轨道表示式为 , 它处于周期表的区,中的化合价为。(2)、“酸浸”时,所用的稀酸X是。(3)、“酸浸”过程中,、的质量浓度、浸出率与时间的关系如图1所示。
内,浸出元素的主要离子方程式为。
(4)、若“净化”过程中的浓度为 , 则此时的浓度为。(5)、是一种两性氧化物,用软锰矿(主要成分为 , 含少量铁的氧化物)和可制备高纯。保持投料量不变,随与投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图2所示。当时,产率减小的原因是。 (6)、碳酸锰在空气中加热可以生成相应的氧化物,称取碳酸锰(摩尔质量)加热,固体物质的质量随温度的变化如图3所示。
(6)、碳酸锰在空气中加热可以生成相应的氧化物,称取碳酸锰(摩尔质量)加热,固体物质的质量随温度的变化如图3所示。
527.4℃时,生成相应固体物质的化学方程式为。
29. 化学实验是研究物质及其变化的基本方法。(1)、某无色透明溶液中可能大量存在、、中的几种离子。①不做任何实验就可以肯定原溶液中不存在的离子是。
②取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是。
③取②的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是。
④原溶液可能大量存在的阴离子是下列A~D中的(填标号)。
A. B. C. D.
(2)、某小组同学对比和的性质,并进行了如下实验:①写出水解的离子方程式。
②向相同体积、相同浓度的和溶液中分别滴加的盐酸,溶液pH变化如下图所示。

a.图 (填“甲”或“乙”)是的滴定曲线。
b.A′~B′的离子方程式为。写出A′溶液中各离子浓度由大到小的顺序。
c.A、B、C三点溶液中,水的电离程度由大到小的顺序为。
③向的和溶液中分别滴加少量溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
i.的溶液中, ,
ii.25℃时, ,
写出向溶液中滴加少量溶液发生的离子反应方程式。
30. 工业上利用石煤矿粉(主要含及少量、)为原料生产 , 工艺流程如下:
已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为、、;
②不同pH下,V(V)在溶液中的主要存在形式见下表:
pH
4~6
6~8
8~10
10~12
主要离子
③25℃时,。
回答下列问题:
(1)、“焙烧”时,发生反应的化学方程式为。(2)、滤液Ⅰ的成分为(填化学式);先“转沉”后“转化”的目的是。(3)、“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到操作单元中循环使用。(4)、“沉钒”中析出晶体时,需要加入过量 , 其原因是①。②;25℃时,测得“转化”后,滤液中 mol·L , 为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中至少mol·L。(5)、“煅烧”时,制得产品。但反应体系中,若不及时分离气体Ⅱ,部分会转化成 , 反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为。31. 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):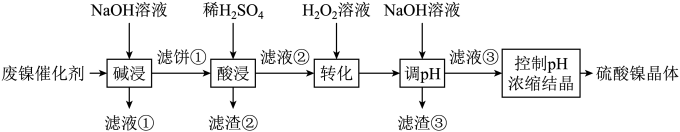
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时(c=0.01mol·L−1)的pH
7.2
3.7
2.2
7.5
沉淀完全时(c=1.0×10−5mol·L−1)的pH
8.7
4.7
3.2
9.0
回答下列问题:
(1)、为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式。(2)、“滤液②”中含有的金属离子是。(3)、“转化”中可替代H2O2的物质是。若工艺流程改为先“调pH”后“转化”,即如图所示,“滤液③”中可能含有的杂质离子为。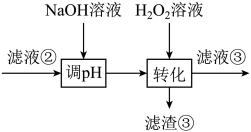 (4)、如果“转化”后的溶液中Ni2+浓度为1.0mol·L−1 , 则“调pH”应控制的pH范围是。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式。(6)、将分离出硫酸镍晶体后的母液收集、循环使用,其意义是。32. 某炉渣主要成分有、、、MgO、CaO以及少量的。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
(4)、如果“转化”后的溶液中Ni2+浓度为1.0mol·L−1 , 则“调pH”应控制的pH范围是。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式。(6)、将分离出硫酸镍晶体后的母液收集、循环使用,其意义是。32. 某炉渣主要成分有、、、MgO、CaO以及少量的。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
已知:“焙烧”中,、几乎不发生反应,、MgO、CaO、转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全()的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、产生的“尾气”是。(2)、在“分步沉淀”时先加氨水调节pH=5,此时过滤所得滤渣主要成分是;再向滤液中加入氨水调pH=11.4,此时“母液①”中的浓度为。(3)、“水浸渣”的主要成分为、和;“酸溶”时,转化为进入溶液,则发生反应的化学方程式为。(4)、“酸溶”后,将溶液适当稀释并加热,“水解”生成沉淀,该反应的离子方程式是。33. Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3 , 还含有少量FeCO3、CoO、Al2O3、SiO2等)为原料制备Mn2O3的工艺流程如图。
已知:①25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Co(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
1.09×10-15
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液:“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
回答下列问题:
(1)、MnOOH中Mn的化合价为价。(2)、为提高“酸浸”的效率,可以采取的措施为。(写一种)(3)、向“沉淀池I”中加入MnO2 , MnO2的作用是;“滤渣2”的主要成分是(填化学式)。(4)、MnSO4转化为MnOOH的离子方程式为。(5)、在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中Al3+完全沉淀,则理论上pH的最小值为(当溶液中某离子浓度c≦1.0×10-5mol·L-l时,可认为该离子沉淀完全)。34. 氯化亚钴在国防工业、仪器制造、畜牧业等领域中发挥着重要的作用。利用钴废料(主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO、碳及有机物等)制取CoCl2·6H2O粗品的工艺流程如下:已知:①浸出液中含有的阳离子有H+、Co2+、 Fe2+、 Mn2+、 Ca2+、Mg2+、Al3+等。
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:

沉淀物
Fe(OH)3
Al(OH)3
Co(OH)2
Fe(OH)2
Mn(OH)2
Mg(OH)2
完全沉淀的pH
3.7
5.2
9.2
9.6
9.8
10.9
(1)、钴废料预先进行高温煅烧处理,其目的是。(2)、“浸出”时,Co2O3发生反应的离子方程式是。(3)、如果取消“氧化”操作,粗品中可能增加的杂质是 (填化学式) ,若“氧化”时加入过量的NaClO3 , 可能产生有害气体,产生该气体反应的离子方程式为。(4)、“滤渣1”的成分为。(5)、“除杂2”可将Ca2+、Mg2+转化为沉淀过滤除去,若所得滤液中c(Mg2+)=7.0 ×10 -6mol/L,则c(Ca2+)= mol·L-1。[已知Ksp(MgF2)=7.35×10 -11、Ksp(CaF2)= 1.05×10 -10](6)、萃取剂对金属离子的萃取率与pH的关系如图所示。加入萃取剂的主要目的是 , 使用萃取剂时最适宜的pH范围是 ( 填字母序号)。
A.1.0-1.5 B.3.0-3.5 C.5.0-5.5 D.6.0-6.5
35. 2022年3月,我国科研团队准确测定了嫦娥五号带回的月壤样品中40多种元素的含量。研究人员曾在月壤中发现了辉钼矿(主要成分为MoS2 , 含有少量杂质),可用于制备钼酸钠晶体(Na2MoO4·2H2O),生产工艺如图。回答下列问题:
回答下列问题:
(1)、焙烧时,采用逆流(空气从炉底进入,辉钼矿经粉碎后从炉顶进入)焙烧的目的是。某些生产工艺在焙烧时加入CaCO3会更环保,其原因是(用化学方程式表示)。(2)、碱性条件下,也可将辉钼矿加入NaClO溶液中制得钼酸钠和硫酸盐,该反应的离子方程式为。(3)、为得到高纯度的钼酸钠晶体,常需加入BaCl2固体除去Na2MoO4溶液中的SO。若溶液中c(MoO)=0.40mol·L-1 , c(SO)=0.05mol·L-1 , 假设钼元素无损失,SO的最大去除率为%。[忽略溶液体积变化,已知:25℃,Ksp(BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。(4)、钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是(填字母)。
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是。若缓蚀剂为钼酸钠一月桂酰肌氨酸(总浓度为300mg·L-1),缓蚀效果最好时,钼酸钠(M=206g·mol-1)的物质的量浓度为mol·L-1(保留2位有效数字)。