高考二轮复习知识点:难溶电解质的溶解平衡及沉淀转化的本质1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
已知:图中曲线表示体系中各含碳粒子的物质的量分数与的关系。
图中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合注:起始 , 不同下由图得到。
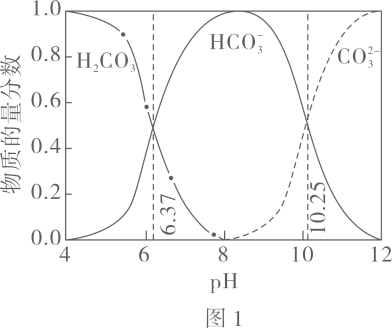
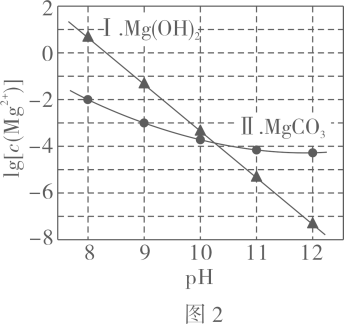
下列说法不正确的是( )
A、由图 , B、由图 , 初始状态 , 无沉淀生成 C、由图 , 初始状态 , 平衡后溶液中存在 D、由图和图 , 初始状态、 , 发生反应:2. 处理某铜冶金污水(含)的部分流程如下: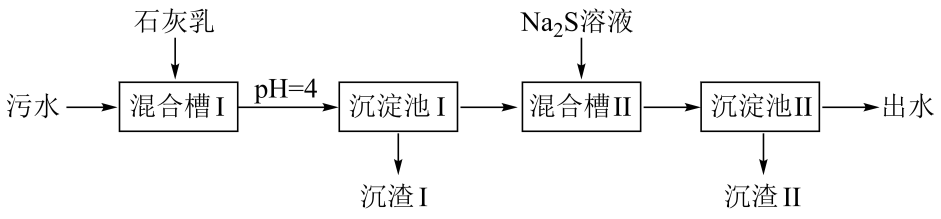
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
物质
开始沉淀
1.9
4.2
6.2
3.5
完全沉淀
3.2
6.7
8.2
4.6
②。
下列说法错误的是
A、“沉渣Ⅰ”中含有和 B、溶液呈碱性,其主要原因是 C、“沉淀池Ⅱ”中,当和完全沉淀时,溶液中 D、“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水3. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Li、Na、K的金属性随其核外电子层数增多而增强4. 室温下,用过量溶液浸泡粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。(当溶液中剩余的离子浓度小于时,化学上通常认为生成沉淀的反应已经完全进行了。已知: , ),下列说法正确的是A、浸泡后未完全转化为 B、溶液中存在: C、反应正向进行,需满足 D、过滤后所得清液中一定存在:且5. 下列实验操作和现象可得出相应正确结论的是选项
实验操作
现象
结论
A
向淀粉溶液中加入稀硫酸,加热,一段时间后,冷却,加入NaOH溶液调至碱性,再加入新制的 , 加热
出现砖红色沉淀
淀粉已完全水解
B
加淀粉KBr溶液中通入足量氯气,再滴加淀粉KI溶液
溶液先变为橙色,后变为蓝色
氧化性:
C
向等浓度的NaCl和溶液中滴加少量溶液
出现白色沉淀(铬酸银为深红色沉淀)
D
向溶液中滴加溶液,再加入少量铜粉
开始时无明显变化,加入铜粉后产生蓝色沉淀
氧化性:
A、A B、B C、C D、D6. 在T° C时,Ag2CrO4 (橘红色)及CdCO3和Cd (OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是
 A、T° C时,Ag2CrO4的Ksp为1.0×10-9 B、T℃时,Y点和Z点时Ag2CrO4的Ksp不相等 C、曲线I是CdCO3的沉淀溶解平衡曲线 D、T℃,在CdCO3(s) +2OH- (aq)Cd(OH)2(s)+(aq)平衡体系中,平衡常数K=1027. 常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知 , (酸根离子)(酸根离子)。下列说法错误的是
A、T° C时,Ag2CrO4的Ksp为1.0×10-9 B、T℃时,Y点和Z点时Ag2CrO4的Ksp不相等 C、曲线I是CdCO3的沉淀溶解平衡曲线 D、T℃,在CdCO3(s) +2OH- (aq)Cd(OH)2(s)+(aq)平衡体系中,平衡常数K=1027. 常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知 , (酸根离子)(酸根离子)。下列说法错误的是 A、曲线Ⅱ为沉淀溶解曲线 B、加入适量的氯化钙固体,可使溶液由c点变到a点 C、b点对应的硫酸钙溶液不饱和 D、向碳酸钙饱和溶液中通入气体,溶液中不变8. 分析化学中以为指示剂,用标准溶液滴定溶液中的 , 测定。
A、曲线Ⅱ为沉淀溶解曲线 B、加入适量的氯化钙固体,可使溶液由c点变到a点 C、b点对应的硫酸钙溶液不饱和 D、向碳酸钙饱和溶液中通入气体,溶液中不变8. 分析化学中以为指示剂,用标准溶液滴定溶液中的 , 测定。已知:i.溶液中存在平衡:
ii.25℃时,(砖红色),(白色)
下列分析错误的是
A、实验中先产生白色沉淀,滴定终点时产生砖红色沉淀 B、产生白色沉淀时,存在 C、当产生砖红色沉淀时,如果 , 已沉淀完全 D、滴定时应控制溶液pH在合适范围内,若pH过低,会导致测定结果偏低9. 工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L1Na2CO3溶液和1.0mol·L1 Na2CO3溶液,含 SrSO4(s)的0.1 mol·L1 Na2SO4溶液和1.0mol·L1 Na2SO4溶液,在一定pH范围内,四种溶液中lgc(Sr2+)随pH的变化关系如图所示。
下列说法错误的是
A、a=-6.5 B、pH相同时,溶液中c( )越大,c(Sr2+ )越小 C、曲线③对应含SrCO3(s)的0.1 mol·L1Na2CO3溶液 D、在Na2SO4和Na2CO3初始浓度均为1.0 mol·L1的混合溶液中,pH≥7.7时才能实现SrSO4(s)转化为SrCO3(s)10. 一种吸收SO2再经氧化得到硫酸盐的过程如图所示。室温下,用0.1mol·L-1NaOH溶液吸收SO2 , 通入SO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物总的浓度c总=c(H2SO3) +c()+c()。室温下,H2SO3的电离常数分别为Ka1 =1.4×10-2、Ka2=6.0×10-8;Ksp (BaSO4)=1×10-10。
下列说法中错误的是
A、SO2是由极性键构成的极性分子 B、“吸收”过程中,溶液中c总=0.1 mol·L-1时溶液呈酸性 C、“吸收”后得到的溶液pH=5,则“氧化”时主要反应的离子方程式为2+O2=2+2H+ D、将“氧化”所得溶液用0.1 mol·L-1的NaOH溶液调节至pH=7,再与0.1 mol·L-1的BaCl2溶液等体积混合,最终溶液中c( )=2×10-9 mol· L-111. 二元有机酸的电离常数、。难溶于水,常温下,将溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中与的关系如图所示。下列说法错误的是
已知:HY是一元强酸,易溶于水。
A、溶液显碱性 B、溶度积 C、b点: D、若溶于HY溶液中得到点溶液,则12. 25℃时,-1gc(X)与pH的关系如图所示,X代表Zn2+或Fe2+或 , 下列说法正确的是
已知:常温下,Fe(OH)2的Ksp=-8.1×10-16;强碱性溶液中Zn元素主要以的形式存在。
A、曲线②代表-lgc(Zn2+)与pH的关系 B、常温下,Zn(OH)2的Ksp的数量级为10-18 C、向等浓度的ZnCl2和FeCl2的混合溶液中滴入NaOH溶液,Zn2+先沉淀 D、向c[]=0.1mol·L-1的溶液中加入等体积0.1mol·L-1的HCl后,体系中Zn元素只以Zn(OH)2的形式存在13. 分离废水中的和 , 对节约资源和环境保护有着重要意义,已知:当溶液中离子浓度小于时,该离子沉淀完全。25℃时,的电离常数 , , 有关物质的如下表:物质
物质下列说法正确的是
A、溶液与废水混合,生成的沉淀成分为、 B、25℃时,反应达到平衡,则溶液中 C、25℃时,用溶液调节废水的pH至8.0,能沉淀完全 D、将溶液逐滴加入浓度均为的和混合溶液中,当完全沉淀生成时,二、多选题
-
14. 天然溶洞的形成与岩石中的CaCO3和空气中CO2溶于天然水体形成的含碳物种的浓度有密切关系。常温下,某溶洞水体中pM随pH的变化关系如图所示。
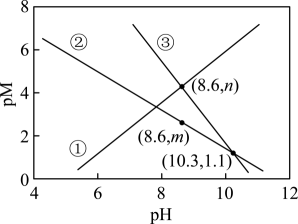
[已知:; , M为或]下列说法正确的是
A、曲线③代表与pH的关系 B、的数量级为10-4 C、 D、pH由4到8的过程中增大的比快15. 工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4晶体的工艺流程如图所示:
已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)PbCl(aq) △H>0;Ksp(PbSO4)=1×10-8 , Ksp(PbCl2)=1.25×10-5。下列说法错误的是
A、“浸取”的主要离子反应:MnO2+PbS+4H++4Cl-=PbCl2+S+MnCl2+2H2O B、“沉降”时加入冰水,是为了减缓反应速率,防止反应过快 C、“滤液a”经过处理后可以返回到浸取工序循环使用 D、PbCl2经“沉淀转化”后得到PbSO4 , 若用1LH2SO4溶液转化5mol的PbCl2(忽略溶液体积变化),则H2SO4溶液的最初物质的量浓度不得低于5.08mol•L-116. 地壳中各种物质存在各种转化,如金属铜的硫化物经生物氧化会转化为 , 流经或等含硫矿石又可以转化为 , [已知 , ]。下列说法不正确的是( ) A、工业上可用处理含有、等金属硫化物的废水 B、当溶液中有和共存时,溶液中 C、基态的价电子排布式为 D、的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个17. 常温下,的沉淀溶解平衡曲线如下图所示,下列说法正确的是
A、工业上可用处理含有、等金属硫化物的废水 B、当溶液中有和共存时,溶液中 C、基态的价电子排布式为 D、的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个17. 常温下,的沉淀溶解平衡曲线如下图所示,下列说法正确的是 A、 B、Y点表示的不饱和溶液 C、向X点中加入溶液,当达到新平衡时,可能处于Z点 D、在溶液中的溶解度大于在水中的溶解度18. 下列由实验操作及现象所得结论正确的是( )
A、 B、Y点表示的不饱和溶液 C、向X点中加入溶液,当达到新平衡时,可能处于Z点 D、在溶液中的溶解度大于在水中的溶解度18. 下列由实验操作及现象所得结论正确的是( )选项
实验操作及现象
实验结论
A
向麦芽糖溶液中加入稀硫酸并加热,再调节pH呈碱性,加入银氨溶液,水浴加热,有银镜产生
证明麦芽糖发生了水解
B
向2份等体积等浓度的稀硫酸中分别加入少量等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解
证明
C
某溶液中加盐酸,产生使澄清石灰水变浑浊的无色无味气体
原溶液中一定存在
D
向碘水中加入等体积 , 振荡后静置,上层接近无色,下层显紫红色
在中的溶解度大于在水中的溶解度
A、A B、B C、C D、D19. 化学与生活、生产密切相关,下列说法错误的是( )A、可乐打开时产生气泡,是因为压强减小促使CO2逸出 B、去除锅炉水垢中的CaSO4 , 用饱和Na2CO3溶液浸泡预处理 C、误食可溶性钡盐造成中毒,可以服用Na2CO3溶液来解毒 D、工业合成氨,常采用铁触媒、减小氨气的浓度来提高反应速率20. 根据下列实验及现象不能推出相应结论的是( )选项
实验操作
现象
结论
A
取少量浓硝酸加热分解,将产物先通入浓硫酸,后用集气瓶收集气体
将带火星的木条放置瓶内,木条复燃
说明支持燃烧
B
向溶液中滴几滴新制氯水,再加适量苯,振荡
溶液分层,下层呈浅绿色,上层呈紫红色
证明还原性:
C
室温,取少量铜和浓硫酸反应后的溶液,加入到盛水的烧杯中稀释
溶液
证明有硫酸剩余
D
向溶液中先滴加少量NaCl溶液,然后再滴加溶液
先产生白色沉淀,后生成黑色沉淀
溶解度:
A、A B、B C、C D、D21. 常温时,三种金属硫化物在水中的沉淀溶解平衡曲线如图所示,已知。下列说法正确的是( ) A、加热可使b点移动到a点 B、常温下,的数量级为 C、常温下,三种物质中CuS的溶解度最小 D、若要除去溶液中混有的少战 , 则可加入固体22. 已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A、加热可使b点移动到a点 B、常温下,的数量级为 C、常温下,三种物质中CuS的溶解度最小 D、若要除去溶液中混有的少战 , 则可加入固体22. 已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )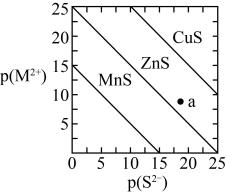 A、a点有ZnS沉淀生成 B、可用MnS除去MnCl2溶液中混有的少量ZnCl2 C、向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)减小 D、CuS和MnS共存的悬浊液中,=10-2023. 旧铅酸蓄电池会导致铅污染,RSR工艺回收铅的流程如图所示。
A、a点有ZnS沉淀生成 B、可用MnS除去MnCl2溶液中混有的少量ZnCl2 C、向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)减小 D、CuS和MnS共存的悬浊液中,=10-2023. 旧铅酸蓄电池会导致铅污染,RSR工艺回收铅的流程如图所示。
已知:a.铅膏的主要成分是和 , 是强酸;
b. , 。
下列有关说法正确的是( )
A、铅酸蓄电池放电时,负极质量减小 B、气体N为 , 步骤④的反应原理是利用强酸制取弱酸 C、反应的 D、步骤⑤中在阳极析出三、非选择题
-
24. 以银锰精矿主要含、、和氧化锰矿主要含为原料联合提取银和锰的一种流程示意图如下。
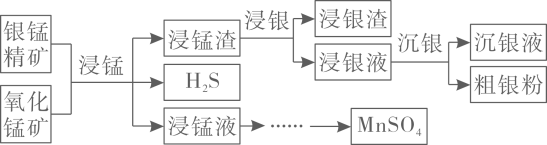
已知:酸性条件下,的氧化性强于。
(1)、“浸锰”过程是在溶液中使矿石中的锰元素浸出,同时去除 , 有利于后续银的浸出;矿石中的银以的形式残留于浸锰渣中。“浸锰”过程中,发生反应 , 则可推断:填“”或“”。
在溶液中,银锰精矿中的和氧化锰矿中的发生反应,则浸锰液中主要的金属阳离子有。
(2)、“浸银”时,使用过量和的混合液作为浸出剂,将中的银以形式浸出。将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中的作用:。
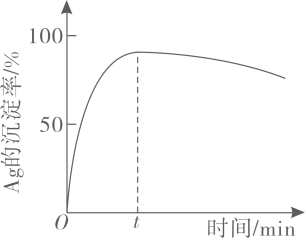
(3)、“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有。
一定温度下,的沉淀率随反应时间的变化如图所示。解释分钟后的沉淀率逐渐减小的原因:。
 (4)、结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。25. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
(4)、结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。25. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
已知:
物质
回答下列问题:
(1)、用硫酸浸取镍钴矿时,提高浸取速率的方法为(答出一条即可)。(2)、“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为。(3)、“氧化”中,用石灰乳调节 , 被氧化为 , 该反应的离子方程式为(的电离第一步完全,第二步微弱);滤渣的成分为、(填化学式)。(4)、“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是。 (5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。26. 我国铂族金属储量占世界储量0.58%,而消费总量占世界消费总量的27%,因此从汽车废弃催化剂中回收铂族金属对可持续发展有重大意义。废弃催化剂中含有Pt,还含有少量的Fe2O3、MgO、Al2O3、 SiO2。一种从汽车废弃催化剂中回收铂的流程如下:
(5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。26. 我国铂族金属储量占世界储量0.58%,而消费总量占世界消费总量的27%,因此从汽车废弃催化剂中回收铂族金属对可持续发展有重大意义。废弃催化剂中含有Pt,还含有少量的Fe2O3、MgO、Al2O3、 SiO2。一种从汽车废弃催化剂中回收铂的流程如下:
已知:①长期使用的催化剂,表面会覆盖积碳和有机物;
②Pt溶于王水生成NO和氯铂酸,该酸的阴离子具有正八面体结构,其中铂为正四价;
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子
Al3+
Mg2+
Fe3+
开始沉淀的pH
3.5
9.5
2.2
沉淀完全(c=1.0× 10-5mol/L)的pH
4.7
11.1
3.2
回答下列问题:
(1)、粉碎废弃催化剂后,需进行预处理操作A,请写出操作A的名称;(2)、为了提高酸浸效率,温度不宜过高的原因:;(3)、酸浸工序中,铂发生的反应的化学方程式为 , 有同学提议,将王水换成盐酸和过氧化氢的混合溶液,请分析优缺点: ;(4)、通过调节滤液的pH以回收其他金属,依次析出的金属离子为 , 当Al3+开始沉淀时,溶液中的Fe3+浓度为mol/L;(5)、铂的浸出率与不同加热方式、浸出时间及不同固液比的关系如下图所示:
由图可知,Pt 浸出的最佳条件为;
(6)、金属捕集法可使Pt取代铜原子进入铜晶格形成铜铂合金,图是一种电催化材料(铜铂合金)的晶胞,该合金的化学式为 , 该合金的密度为ρg/cm3 , 两个最近的铜原子之间的距离为pm(写出计算式,不用简化)。 27. 广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备的工艺如下:
27. 广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备的工艺如下:
已知:
I.“焙烧”后,固体中主要含有、、、;“酸浸”后钒以形式存在,“中和还原”后钒以形式存在。
Ⅱ.有机溶剂对四价钒具有高选择性,且萃取而不萃取。
Ⅲ.该工艺条件下,溶液中金属离子(浓度均为)开始沉淀和完全沉淀的如下表所示:
金属离子
开始沉淀
1.9
7.0
11.9
8.1
完全沉淀
3.2
9.0
13.9
10.1
回答下列问题:
(1)、基态钒原子的价层电子排布式为。(2)、“中和还原”时,参与反应的离子方程式为 , 该工序的低于7.0,试计算出。(3)、指出各元素的第一电离能由大到小的顺序 , 的空间结构为形。(4)、钒的浸出率与焙烧温度、硫酸加入量的关系如图1、2所示。指出适宜的工艺条件为。 (5)、“氧化”时,每消耗 , 可得到。(6)、单质V晶胞属于体心立方晶胞,晶胞参数为 , 两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为pm。
(5)、“氧化”时,每消耗 , 可得到。(6)、单质V晶胞属于体心立方晶胞,晶胞参数为 , 两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为pm。 28. 废旧磷酸铁锂电池的正极材料中含有LiFePO4、Al、导电剂(乙炔墨、碳纳米管)等。工业上利用废旧磷酸铁锂电池的正极材料制备Li2CO3的工艺流程如下:
28. 废旧磷酸铁锂电池的正极材料中含有LiFePO4、Al、导电剂(乙炔墨、碳纳米管)等。工业上利用废旧磷酸铁锂电池的正极材料制备Li2CO3的工艺流程如下:
已知:①LiFePO4不溶于碱,可溶于稀酸。
②常温下,Ksp(FePO4)=1.3×10-22 , Ksp[Fe(OH)3]=4.0 × 10-38。
③Li2CO3在水中溶解度:
温度/℃
0
20
40
60
80
100
溶解度/g
1.54
1.33
1.17
1.01
0.85
0.72
回答下列问题:
(1)、将电池粉粹前应先放电,放电的目的是。(2)、“滤液A”中的溶质主要是。(3)、“酸浸”时,加入H2O2溶液的目的是(用离子方程式表示)。盐酸用量不宜太多,结合后续操作分析,原因是。。(4)、“沉铁沉磷”时,当溶液pH从1.0增大到2.5时,沉铁沉磷率会逐渐增大,但pH超过2.5以后,沉磷率又逐渐减小。从平衡移动的角度解释沉磷率减小的原因是。(5)、“提纯”时,可用热水洗涤Li2CO3粗品,理由是。(6)、制取的Li2CO3、FePO4与足量的炭黑混合,隔绝空气高温灼烧得到LiFePO4 , 反应的化学方程式是。29. 以电解铝废渣(主要含AlF3、NaF、LiF、CaO)为原料,制备电池级碳酸锂的工艺流程如下:
已知: AlF3、LiF难溶于水,LiOH溶于水,Li2CO3微溶于水,Ksp(Li2CO3) 2.5×10-2、Ksp( CaCO3) = 2.8×10-9。回答下列问题:
(1)、①电解氧化铝生成铝的化学方程式为 , 无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是。②已知AlCl3可形成共价分子, AlF3为离子晶体,从电负性的角度解释其原因:。
(2)、“气体1”是 ( 填化学式,下同),“滤渣1”的主要成分是。(3)、已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式。(4)、“苛化”中存在如下反应:Li2CO3(s)+Ca2+(aq)⇌2Li+(aq)+ CaCO3(s)。通过计算解释生石灰能使Li2CO3完全转化的原因:。(5)、Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是;若其晶胞参数为apm,则该合金的晶体密度为g·cm-3 (列出计算式,阿伏加德罗常数用NA表示)。 30. 实验室以含锰废液为原料可以制取 , 部分实验过程如下:
30. 实验室以含锰废液为原料可以制取 , 部分实验过程如下:
已知室温下,部分难溶电解质的溶度积常数如下表:
难溶电解质
(1)、经检测,含锰废液中 mol·L、 mol·L、 mol·L , 还含及少量、。“氧化”阶段,用量为理论用量的1.1倍。①“氧化”1 L该废液,需要加入的物质的量为。
②检验已经完全被氧化的方法是。
(2)、“除杂I”加入调节溶液。该过程中发生反应的离子方程式为。(3)、“除杂Ⅱ”中反应之一为。结合反应的平衡常数解释用能除去的原因:。(4)、已知和的溶解度如图所示。请补充完整由粗溶液制取晶体的实验方案:取实验所得粗溶液, , 得到晶体。(可选用的试剂:1 mol·L 溶液,1 mol·L 溶液,1 mol·L盐酸) (5)、如图为不同温度下硫酸锰焙烧2小时后残留固体的X-射线衍射图。由固体制取活性的方案为:将固体置于可控温度的反应管中, , 将冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1 , 1 mol·L-1 NaOH溶液)
(5)、如图为不同温度下硫酸锰焙烧2小时后残留固体的X-射线衍射图。由固体制取活性的方案为:将固体置于可控温度的反应管中, , 将冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1 , 1 mol·L-1 NaOH溶液) 31. 以粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料制备电极材料LiFePO4的实验流程如图:
31. 以粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料制备电极材料LiFePO4的实验流程如图: (1)、“焙烧”过程中AlCl3最终转化为Al2O3和(填化学式)。(2)、“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12 , 欲使c(Mg2+)≤5.5×10-6mol•L-1 , “除杂”需要调节溶液的pH不低于。(3)、离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为。
(1)、“焙烧”过程中AlCl3最终转化为Al2O3和(填化学式)。(2)、“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12 , 欲使c(Mg2+)≤5.5×10-6mol•L-1 , “除杂”需要调节溶液的pH不低于。(3)、离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为。 (4)、已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有。
(4)、已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有。 (5)、“合成”在高温下进行,其化学方程式为。(6)、LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有个。
(5)、“合成”在高温下进行,其化学方程式为。(6)、LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有个。 32. 某工厂利用如下流程处理废旧电池正极材料(主要成分为LiCoO₂、LiMn₂O₄、LiNiO₂、LiFePO₄等),制备三元锂电池正极材料LiNi1/3Mn1/3Co1/3O2。
32. 某工厂利用如下流程处理废旧电池正极材料(主要成分为LiCoO₂、LiMn₂O₄、LiNiO₂、LiFePO₄等),制备三元锂电池正极材料LiNi1/3Mn1/3Co1/3O2。
回答下列问题:
(1)、为提高原料利用率,在“酸浸”步骤可采取的措施有(至少写两条)。(2)、“酸浸”中H₂O₂既表现还原性,又表现氧化性,则酸浸后的滤液中含有的金属阳离子有Ni²⁺、Mn²⁺、Co²⁺和 , “酸浸”中LiCoO₂发生反应的离子方程式为。(3)、“酸浸”中控制溶液的温度未发生较大变化,但双氧水消耗量仍超过理论用量,其可能原因是。(4)、“调pH”的目的是 , 部分离子浓度及对应氢氧化物的Ksp , 如下表,则“调pH”时pH不应超过。离子
浓度(mol·L⁻¹)
氢氧化物Ksp
Ni²⁺
1.00
1.00×10-15.2
Co²⁺
1.00
1.00×10-14.2
Mn²⁺
1.40
1.00×10-12.7
(5)、若“调pH”过程中,Ni²⁺、Mn²⁺、Co²⁺浓度不变,则“调浓度”过程需要向溶液中添加的X为(填标号)。a.NiSO₄ b.CoSO₄ c.MnSO₄ d.H₂SO₄
(6)、Ni1/3Mn1/3Co1/3(OH)2与Li₂CO₃焙烧生成LiNi1/3Mn1/3Co1/3O2的反应中,另一种反应物是。33. 某小组探究不同阴离子与的结合倾向并分析相关转化。资料:i.和均为白色,难溶于水。
ii.与、能生成、
iii.与结合倾向。
(1)、探究、与的结合倾向
实验
滴管
试管
现象
I
10滴0.1mol/L溶液
等浓度的NaI和溶液
黄色沉淀
II
等浓度的NaI和溶液
黄色沉淀
①由实验I推测:与结合倾向(填“>”或“<”)。
②取两等份AgBr浊液,分别滴加等浓度、等体积的和溶液,前者无明显现象,后者浊液变澄清,澄清溶液中+1价银的存在形式(填化学式)。推测:与结合倾向。
(2)、查阅资料证实了,上述推测。的转化

实验
滴管
试管
现象
III
0.1mol/L溶液
0.1mol/L溶液
白色沉淀,振荡后消失
IV
0.1mol/L溶液
0.1mol/L溶液
白色沉淀,逐渐变为灰色,最终为黑色沉淀
①写出实验III中白色沉淀消失的离子方程式。
②查阅资料:实验IV中黑色沉淀是 , 中S元素的化合价分别为和+6.写出实验IV中白色沉淀变为黑色的化学方程式并分析原因。
③溶液可用作定影液。向溶液溶解AgBr之后的废定影液中,加入(填试剂和操作),可使定影液再生。
(3)、的转化
分析试管1出现银镜的原因。
(4)、资料显示:S原子与结合比O原子更稳定。与结构相似,但与结合倾向: , 试从微粒空间结构角度解释原因。34. 工业上以制备抗癌药物“顺铂”[Pt(NH3)2Cl2]的废渣——含铂的碘化银为主要原料回收银粉和海绵铂的工艺流程如下:
已知:①N2H4是一种强还原剂,在碱性条件下可将多数金属离子还原成单质。
②Ksp(AgCl)=1.8×10-10 , NaCl在浓硫酸中难溶,Ag2SO4在不同浓度硫酸中的溶解量如下:
硫酸浓度/(mol•L-1)
18
15
12
9
6
0
硫酸银溶解量/(g•L-1)
209.00
78.94
31.20
11.14
8.74
4.68
回答下列问题:
(1)、“顺铂”分子中Pt的化合价为。(2)、“氧化浸出”中,应选用上表所列mol·L-1H2SO4 , 发生反应的化学方程式为。(3)、“稀释”在陶瓷反应釜中进行,具体操作为;“沉银”过程中反应Ag2SO4(s)+2Cl-(aq)⇌2AgCl(s)+(aq)的化学平衡常数为mol-1·L。(4)、“还原浸出”制银粉过程中有N2产生,发生反应的离子反应方程式为;该工艺经物理处理,可再生循环利用的物质有(填化学式)。35. 氧化锌是一种有独特物理化学性能的功能材料,广泛地应用于塑料、合成橡胶、电池、药膏、阻燃剂等产品的制作中。此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。工业上利用锌焙砂(主要成分为ZnO,含As2O3及铅、铜、镉的氧化物)生产高纯度氧化锌的工业流程如图所示:
已知: As2O3微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)、Zn2+的简化电子排布式为。(2)、操作X过程中,需用到的玻璃仪器有、烧杯。(3)、“浸出”过程(NH4)2SO4和NH3·H2O按1:2参加反应生成了[ Zn(NH3)4]2+ , 发生的离子反应方程式为。(4)、“除砷”过程中,先加入过量的(NH4)2S2O8 , 然后再加入FeSO4·H2O,该过程中 (NH4)2S2O8过量的原因是。(5)、已知三种硫化物的Ksp如表。当溶液中某离子物质的量浓度≤10-5mol · L-1时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol·L-1时,Pb2+是否完全沉淀(填 “是”或“否”),理由是(请列式计算说明)。物质
CdS
CuS
PbS
Ksp
8.0× 10-27
6.3×10-36
8.0× 10-28
(6)、流程中可循环利用的含氮物质有 (填物质化学式)。(7)、已知“蒸氨”后锌元素以Zn(NH3)2SO4存在,写出CO2“沉锌”的化学方程式。