高考二轮复习知识点:盐类水解的应用1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列过程与水解反应无关的是( )A、热的纯碱溶液去除油脂 B、重油在高温、高压和催化剂作用下转化为小分子烃 C、蛋白质在酶的作用下转化为氨基酸 D、向沸水中滴入饱和溶液制备胶体2. 一种分解氯化铵实现产物分离的物质转化关系如下,其中代表或中的一种。下列说法正确的是( )
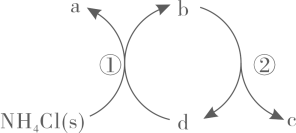 A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热3. 利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热3. 利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。已知:图中曲线表示体系中各含碳粒子的物质的量分数与的关系。
图中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合注:起始 , 不同下由图得到。
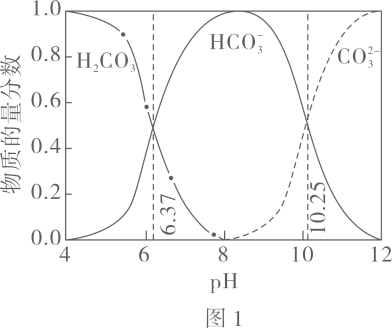
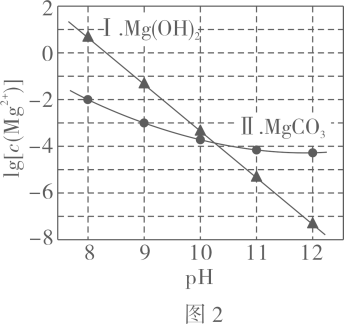
下列说法不正确的是( )
A、由图 , B、由图 , 初始状态 , 无沉淀生成 C、由图 , 初始状态 , 平衡后溶液中存在 D、由图和图 , 初始状态、 , 发生反应:4. 甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法错误的是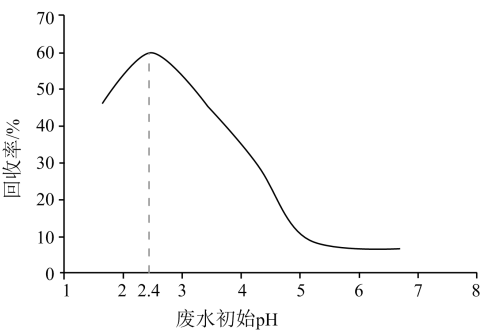 A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在5. 将去掉氧化膜的铝片放入足量Na2CO3溶液中,铝片表面产生气泡,充分反应后得到无色溶液M。下列分析错误的是( )A、产生的气体中有H2 B、反应与水解有关 C、Al(OH)3向酸式电离方向移动 D、M中含大量:Na+、Al3+、6. 室温下用0.1 mol∙L-1 Na2SO3溶液吸收SO2的一种脱硫工艺流程如下图所示。已知H2SO3电离平衡常数分别为Ka1=1.54×10-2 , Ka2=1.02×10-7 , H2CO3电离平衡常数分别为Ka1=4.30×10-7、Ka2=5.61×10-11 , 忽略通入SO2所引起的溶液体积变化和H2O挥发。
A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在5. 将去掉氧化膜的铝片放入足量Na2CO3溶液中,铝片表面产生气泡,充分反应后得到无色溶液M。下列分析错误的是( )A、产生的气体中有H2 B、反应与水解有关 C、Al(OH)3向酸式电离方向移动 D、M中含大量:Na+、Al3+、6. 室温下用0.1 mol∙L-1 Na2SO3溶液吸收SO2的一种脱硫工艺流程如下图所示。已知H2SO3电离平衡常数分别为Ka1=1.54×10-2 , Ka2=1.02×10-7 , H2CO3电离平衡常数分别为Ka1=4.30×10-7、Ka2=5.61×10-11 , 忽略通入SO2所引起的溶液体积变化和H2O挥发。
下列说法正确的是
A、0.1 mol∙L-1 Na2SO3溶液中: B、NaHSO3溶液中: C、“沉淀”时发生主要反应的离子方程式: D、“沉淀”分离后的滤液中:7. 氨基酸在水溶液中可通过得到或失去发生如下反应:
常温下,的甘氨酸()溶液中各微粒浓度对数值与pH的关系如图所示:

下列说法正确的是( )
A、曲线③为的浓度与pH的关系图 B、 , C、平衡常数的数量级为 D、C点溶液中满足:8. 室温下,向100 mL 0.1 mol·L-1 Na2SO3(aq)中分别加(通)入不同试剂,现象见下表:试剂
现象
1
酚酞
溶液变红,加水稀释,红色变浅
2
少量SO2
用pH试纸测得溶液pH≈8
3
少量Cl2
无明显现象
下列说法错误的是( )
A、Na2SO3(aq)中存在:c(OH-)=c(H+)+2c(H2SO3)+c(HSO3-) B、实验1中随着水的不断加入,溶液中的值逐渐增大 C、实验2反应后溶液中存在:c(Na+)>c(HSO3-)+2c(SO32-) D、实验3反应后溶液中存在:c(H+)=c(Cl-)9. 时,下列说法正确的是( )A、的某酸溶液中一定存在: B、的氨水溶液稀释10倍后 C、相同的溶液、溶液、溶液,其浓度大小关系: D、常温下,溶液中,由水电离产生的浓度为10. 下列物质的水溶液呈碱性且属于盐是( )A、苯甲酸钠 B、 C、HCl D、11. 下列“类比”不合理的是( )A、丙醛能与发生加成反应,丙酮也可以与发生加成反应 B、乙烯中所有原子都在同一平面上,则2,3-二甲基-2-丁烯中所有碳也在同一平面上 C、往NaOH溶液通少量 , 生成 , 则往苯酚钠溶液中通入少量 , 也生成 D、溶液在空气中蒸干得到固体,则溶液在空气中蒸干也得到固体12. 常温下,用0.1000的盐酸滴定20.00mL 溶液,溶液中、、的分布分数随pH变化曲线及滴定曲线如图。下列说法正确的是( )
已知:
A、 B、的的值为 C、若将完全转变为 , 仅需用酚酞做指示剂 D、图中c点,13. 水溶液呈酸性的盐是( )A、 B、 C、NaH D、NaClO14. 某二元酸(H2A)在水中的电离方程式为:H2A=H++HA- , HA-H++A2- , 下列说法错误的是( )A、在0.1 mol/L的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5 mol/L B、25℃时,若测得0.1 mol/L的NaHA溶液pOH=a,升高温度,测得同浓度的NaHA溶液pOH=b,则b一定大于a C、25℃时,将同浓度的NaHA和Na2A溶液等体积混合,其pH一定小于7 D、0.1 mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)二、多选题
-
15. 25℃时,向一定浓度的溶液中逐滴加入HCl,以X表示或。已知 , 混合溶液pX与pH的关系如图所示。下列说法错误的是
 A、曲线I表示与pH的关系 B、第一步电离常数的数量级为 C、时, D、时,16. 某温度下,改变0.10mol/L溶液的pH时,各种含铬元素粒子及浓度变化如图所示。下列有关说法正确的是( )
A、曲线I表示与pH的关系 B、第一步电离常数的数量级为 C、时, D、时,16. 某温度下,改变0.10mol/L溶液的pH时,各种含铬元素粒子及浓度变化如图所示。下列有关说法正确的是( ) A、 B、 C、E点溶液中存在: D、反应的平衡常数17. 常温下,向NaOH溶液中逐滴滴入亚磷酸(),各含磷微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与pOH的关系如图所示。已知 , 反应中只能生成和两种盐。下列说法正确的是( )
A、 B、 C、E点溶液中存在: D、反应的平衡常数17. 常温下,向NaOH溶液中逐滴滴入亚磷酸(),各含磷微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与pOH的关系如图所示。已知 , 反应中只能生成和两种盐。下列说法正确的是( ) A、曲线a代表 B、的电离平衡常数 C、溶液中 D、pOH=7时,18. 25℃时,某酸(结构简式为
A、曲线a代表 B、的电离平衡常数 C、溶液中 D、pOH=7时,18. 25℃时,某酸(结构简式为 )溶液中含元素X物种的浓度之和为 ,溶液中各含元素X物种的pX随pOH变化关系如图所示。图中 , ;x、y两点的坐标: ; 、 分别表示 的一级、二级电离常数。下列说法错误的是( )
)溶液中含元素X物种的浓度之和为 ,溶液中各含元素X物种的pX随pOH变化关系如图所示。图中 , ;x、y两点的坐标: ; 、 分别表示 的一级、二级电离常数。下列说法错误的是( )  A、 溶液显碱性,是因为 的水解程度大于电离程度 B、 溶液中, C、该体系中, D、z点时,19. 25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是( )
A、 溶液显碱性,是因为 的水解程度大于电离程度 B、 溶液中, C、该体系中, D、z点时,19. 25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是( ) A、25℃时,Ksp(BaCO3)>Ksp(BaSO4) B、BaSO4在水中的Ksp大于其在BaCl2溶液中的Ksp C、加入1.3molNa2CO3 , 即可使BaSO4全部转化为BaCO3 D、当BaSO4恰好全部转化为BaCO3时,c(CO )>c(Ba2+)>c(SO )>c(OH-)20. 常温常压下,有关下列各溶液的描述中正确的是A、等浓度的溶液和溶液,的水解程度一样 B、一定浓度的氨水加水稀释,的比值和的比值均增大 C、浓度均为的、混合溶液中: , 且 D、的醋酸钠溶液与盐酸溶液混合后溶液显酸性,溶液中微粒的浓度关系为:21. 25℃时,向0.10溶液中逐渐加入固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)随溶液pH变化的关系如图所示,下列说法正确的是 ( )
A、25℃时,Ksp(BaCO3)>Ksp(BaSO4) B、BaSO4在水中的Ksp大于其在BaCl2溶液中的Ksp C、加入1.3molNa2CO3 , 即可使BaSO4全部转化为BaCO3 D、当BaSO4恰好全部转化为BaCO3时,c(CO )>c(Ba2+)>c(SO )>c(OH-)20. 常温常压下,有关下列各溶液的描述中正确的是A、等浓度的溶液和溶液,的水解程度一样 B、一定浓度的氨水加水稀释,的比值和的比值均增大 C、浓度均为的、混合溶液中: , 且 D、的醋酸钠溶液与盐酸溶液混合后溶液显酸性,溶液中微粒的浓度关系为:21. 25℃时,向0.10溶液中逐渐加入固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)随溶液pH变化的关系如图所示,下列说法正确的是 ( ) A、曲线上任意一点均存在: B、时,溶液中的 C、由图可知,为二元弱酸,如果将物质的量浓度均为0.20的和溶液等体积混合,所得溶液的 D、已知25℃时,的。若把少量加入溶液中,发生的离子反应可表示为:22. 某研究小组为了探究溶液的性质,设计了下列实验,并记录实验现象。
A、曲线上任意一点均存在: B、时,溶液中的 C、由图可知,为二元弱酸,如果将物质的量浓度均为0.20的和溶液等体积混合,所得溶液的 D、已知25℃时,的。若把少量加入溶液中,发生的离子反应可表示为:22. 某研究小组为了探究溶液的性质,设计了下列实验,并记录实验现象。实验装置
实验序号
滴管试剂
试管试剂
实验现象

①
溶液
饱和溶液
产生白色沉淀
②
溶液
光照管壁有气泡产生
③
酸性溶液和溶液
溶液变红
④
的溶液
产生白色沉淀
以下判断错误的是( )
A、实验①:产生的白色沉淀为 B、实验②:产生的气体为 C、实验③:还原性强弱顺序 D、实验④:与的水解相互促进23. 时,用溶液滴定溶液的滴定曲线如图所示(曲线上的数字为)。已知:二元弱酸;时, , 的 , 。下列说法正确的是( ) A、a点消耗溶液体积为 B、b点: C、时,溶液显酸性 D、d点溶液中离子浓度大小关系为24. 常温下,将NaOH溶液滴加到某二元弱酸溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是( )
A、a点消耗溶液体积为 B、b点: C、时,溶液显酸性 D、d点溶液中离子浓度大小关系为24. 常温下,将NaOH溶液滴加到某二元弱酸溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是( ) A、NaHX溶液中 B、当时, C、水的电离程度:上的点大于上的点 D、a点溶液中的数量级为
A、NaHX溶液中 B、当时, C、水的电离程度:上的点大于上的点 D、a点溶液中的数量级为三、非选择题
-
25. 钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:。
具体步骤如下:
Ⅰ.称取 , 用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)、步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是。加快NH4Cl溶解的操作有。
(2)、步骤Ⅱ中,将温度降至10℃以下以避免、;可选用降低溶液温度。(3)、指出下列过滤操作中不规范之处:。 (4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。26. Mg与水反应时,Mg表面会覆盖致密的导致反应较缓慢。某兴趣小组为了验证部分离子对Mg与水反应的影响,进行了如下实验。
(4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。26. Mg与水反应时,Mg表面会覆盖致密的导致反应较缓慢。某兴趣小组为了验证部分离子对Mg与水反应的影响,进行了如下实验。I.验证和对Mg与水反应的促进作用
实验序号
a
b
c
d
0.1 mol·L盐溶液
NaCl
30 min内产生气体的体积/mL
1.5
0.7
<0.1
1.4
气体的主要成分
30 min时镁条表面情况
大量固体附着(固体可溶于盐酸)
(1)、某同学认为根据上表能够说明对Mg与水的反应起促进作用,他的理由是。(2)、实验b、d镁条表面附着固体中还检验出碱式碳酸镁 , 写出Mg与溶液反应生成该固体的离子方程式:。(3)、综合实验a~d可以得出结论:和都能与作用而加快Mg与水的反应,(补充两点)。(4)、II.室温下,探究对Mg与水反应的影响该小组用Mg与NaCl溶液反应,实验发现当浓度过低或过高时,反应速率没有变化,当浓度为2 mol·L时,Mg与水反应较快,产生大量的气泡,同时生成白色固体,最终溶液pH约为10.98。
经检验该白色固体含有碱式氯化镁。碱式氯化镁受热(>100℃)易分解生成氧化镁和两种气体,写出其分解的化学方程式:。实验室检验镁条表面生成的白色固体含有碱式氯化镁的操作是。
(5)、常温下,饱和溶液的 , 试从化学平衡角度分析实验得到最终溶液的pH大于该值的原因:(已知 , )。27. 铜盐主要用于杀毒和驱虫。实验室采用滴定法测定硫酸铜样品中铜的含量。实验步骤如下:I.铜盐的溶解:准确称取硫酸铜样品0.5g于碘量瓶中,加入1mol/L溶液和30mL使之溶解。
II.滴定:向上述碘量瓶中加入5mL20%KI溶液,立即用0.1mol/L标准溶液滴定至浅黄色。然后加入1mL淀粉溶液,继续滴定溶液呈浅蓝色。再加入5mL10%KSCN溶液,摇匀后溶液蓝色转深,再继续滴定到终点,消耗标准溶液的体积为。回答下列问题:
(1)、利用浓硫酸配制250mL1mol/L溶液需要的玻璃仪器有烧杯、玻璃棒、250mL容量瓶、。下列关于容量瓶的操作,正确的是。A.
 B.
B. 
C.
 D.
D.  (2)、溶解硫酸铜加入硫酸的目的是;不能将硫酸换为盐酸的理由是。(3)、已知滴定过程加入5mL20%KI溶液,有白色沉淀(CuI)生成,发生的离子反应方程式为。(4)、已知 , CuI容易吸附 , 加入KSCN溶液的目的是将CuI转化为CuSCN沉淀并释放吸附的 , 如不加KSCN溶液,则测量结果(填“偏大”、“偏小”或“不变”)。(5)、滴定终点的现象是;已知 , 则硫酸铜样品中铜的含量为%。28. 硫的化合物在工业中用途广泛。是一种重要的溶剂。工业上可以利用硫黄()与为原料制备 , 时受热分解成气态 , 发生反应。
(2)、溶解硫酸铜加入硫酸的目的是;不能将硫酸换为盐酸的理由是。(3)、已知滴定过程加入5mL20%KI溶液,有白色沉淀(CuI)生成,发生的离子反应方程式为。(4)、已知 , CuI容易吸附 , 加入KSCN溶液的目的是将CuI转化为CuSCN沉淀并释放吸附的 , 如不加KSCN溶液,则测量结果(填“偏大”、“偏小”或“不变”)。(5)、滴定终点的现象是;已知 , 则硫酸铜样品中铜的含量为%。28. 硫的化合物在工业中用途广泛。是一种重要的溶剂。工业上可以利用硫黄()与为原料制备 , 时受热分解成气态 , 发生反应。完成下列填空:
(1)、和互称为;硫原子最外层未成对电子中运动状态不相同的方面是。(2)、反应所涉及的各物质中,属于极性分子的电子式为。列举一个能比较硫元素与碳元素非金属性相对强弱的实验事实:。常温下,用的溶液处理工业尾气中的 , 吸收过程中的使用率()与溶液的关系如图所示(溶液体积与温度均保持不变)。 (3)、a点时,溶液中。已知到b点时吸收了标准状况下尾气,则尾气中的体积分数为(尾气中其他成分不反应)。(4)、当的使用率达到时,溶液为4.4,分析原因:。(5)、用硫酸酸化的 , 溶液处理气体,会析出铬钾矾晶体。写出相关反应的化学方程式。29. 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。(1)、Ⅰ.完成下列填空:
(3)、a点时,溶液中。已知到b点时吸收了标准状况下尾气,则尾气中的体积分数为(尾气中其他成分不反应)。(4)、当的使用率达到时,溶液为4.4,分析原因:。(5)、用硫酸酸化的 , 溶液处理气体,会析出铬钾矾晶体。写出相关反应的化学方程式。29. 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。(1)、Ⅰ.完成下列填空:锗元素原子核外能量最高的电子有个,它们运动所形成的电子云形状为形。
(2)、氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了和(填化学式)两种离子。(3)、Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH(填“大于”“小于”或“等于”)后者。
(4)、写出三水锡酸钠露置在空气中发生反应的化学方程式。(5)、Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、、。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
Pb(NO3)2溶液中,2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有(填微粒符号)。
(6)、科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)D2Pb(s)+2H+。则脱铅时最合适的pH约为(选填编号)。a.4~5 b.6~7 c.8~10 d.12~14
30. 某小组验证“”(反应A)存在限度,并探究外加试剂对该平衡的影响。(1)、从正反应方向探究实验。取溶液,加入溶液(),溶液呈棕黄色,不再发生变化。①通过检测出 , 证实反应A存在限度。
②加入 , 振荡,平衡向移动。
③除反应A外,还发生(写方程式),促进与的反应。
(2)、从逆反应方向探究实验:向碘水(含淀粉)中加入酸性溶液,无明显变化。未检出。①甲同学认为加入溶液可增大与的反应程度。甲同学依据的原理是。
②验证:加入溶液,产生沉淀a,溶液蓝色褪去。能检出。
(3)、乙同学认为碘水中含有 , 加入溶液也可能产生沉淀。做对照实验:直接向碘水(含淀粉)中加入溶液。产生沉淀,溶液蓝色褪去。查阅资料:
实验验证:

已知:、(微溶)
①Ⅲ中溶液的作用是。
②Ⅳ中溶液的作用是(用离子方程式表示)。
检验、比较沉淀a、b的成分,可明确的作用。
(4)、问题思考:向与碘水的混合液中加入溶液,可能发生如下反应:i.与在的促进下发生的氧化还原反应
ii.与在促进下发生的反应
iii.与的反应
确认是否发生反应iii,设计实验:将反应后混合物过滤,。
供选择试剂:稀、溶液、溶液
已知:、溶于溶液;难溶于稀
31. 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图: 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)、铋精矿在浸取时会先进行粉碎,目的是。(2)、加压氧化氨浸过程中,已知 CuS2发生如下反应: , 生成 , FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式。(3)、操作Ⅰ为:。(4)、根据流程分析,盐酸羟胺在反应中起到什么作用:。(5)、流程中生成 BiOCl 的离子方程式:。(6)、滤液 3 中含有的金属阳离子有:。32. 化学社团小组的同学在测试Na2SO3溶液的pH时,遇到了困惑。为此,决心重新实验,揭开奥秘。请你也参与交流讨论。a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论
(1)、实验操作①所得溶液的物质的量浓度为;实验操作②中除酒精灯、玻璃棒、三角架及隔绝空气的设备外,还需要的仪器有。(2)、给Na2SO3•7H2O加热时为何要隔绝空气,请以简要的文字给以说明。(3)、猜想Na2SO3在高温强热下发生分解反应的化学方程式是。(4)、实验①和③中,两次测得的溶液pH相差明显,其合理的解释是(简要的文字和离子方程式给以说明) 。(5)、请你设计简单的实验方案,给上述分析猜想及解释加以佐证。并简单叙述实验步骤、现象和结论。。33. 硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域等。某化学实验小组用如图1装置制备。
已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图2所示。
(1)、若要检验a处混合气体中的CO2 , 实验方法是:将混合气体。(2)、三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的。(3)、设计以下实验测定以上制备的纯度:步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mLmol•L-1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+ , 加水稀释至100mL。
步骤3:向碘量瓶中加入1mLl%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:)
①写出“步骤2”中反应的离子方程式。
②试计算的纯度(写出计算过程)
(4)、利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备晶体,请补充完整实验方案,将固体混合物溶于水配成溶液, , 洗涤、干燥得晶体。(实验中须使用的试剂及仪器有:氧气、pH计)34. CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子
开始沉淀的pH
沉淀完全的pH
Co2+
7.6
9.4
Al3+
3.0
5.0
Zn2+
5.4
8.0
(1)、“酸浸”时通入SO2发生反应的离子方程式是。(2)、“除铝”时调节溶液pH范围为 , 该过程中主要反应的离子方程式为。(3)、“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是。(4)、“沉钴”时为使Co2+沉淀完全,Na2CO3溶液需稍过量且缓慢滴加,能说明Co2+已沉淀完全的实验操作是。(5)、CoCO3隔绝空气灼烧可以生成Co2O3 , 该反应的化学方程式为。(6)、某工业生产过程中得到溶液的溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如图,请设计从该混合液中获取ZnSO4晶体的实验方案:
向溶液中加入稍过量的锌粉,充分反应后, , 得到ZnSO4溶液, , 得到ZnSO4晶体。(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
35. 某卤水锂矿“沉锂”后所得滤饼的主要成分为Li2CO3 , 同时含有共生盐——氯化钠、氯化钾及少量重金属盐,为提高Li2CO3的纯度,需要在“沉锂”后进行“洗矿”,洗矿母液为接近饱和的碳酸锂的高盐废水,废水的pH约为10~12且重金属离子含量超标,需处理后排放,回收处理洗矿母液的工艺流程如图所示。
碳酸锂的溶解度(g/L)如表:
温度/℃
0
10
20
30
40
50
60
80
100
Li2CO3
1.54
1.43
1.33
1.25
1.17
1.08
1.01
0.85
0.72
回答下列问题:
(1)、“洗矿”通常采用90℃的热水进行,目的是。(2)、洗矿母液呈碱性的主要原因是(用离子方程式表示)。(3)、“除重金属”时所得滤渣含有硫化亚砷(As2S3),可用硝酸将其转化为砷酸(H3AsO4)、硫酸,同时生成一氧化氮,则该反应的化学方程式为。(4)、NaCl、KCl、LiCl的溶解度随温度的变化情况如图所示。流程中操作I为“加热蒸发、浓缩结晶、趁热过滤”,操作II为“冷却结晶、过滤”,则晶体b和晶体c的主要成分分别为、 (填化学式)。 (5)、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
(5)、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、洗涤、干燥得高纯Li2CO3。
①a中,阳极的电极反应式是 , 宜选用(填“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的离子方程式是。