高考二轮复习知识点:盐类水解的原理3
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列实验中,均产生白色沉淀。
 下列分析错误的是( )A、Na2CO3与NaHCO3溶液中所含微粒种类相同 B、CaCl2能促进Na2CO3、NaHCO3水解 C、Al2(SO4)3能促进Na2CO3、NaHCO3水解 D、4个实验中,溶液滴入后,试管中溶液pH均降低2. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:3. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。
下列分析错误的是( )A、Na2CO3与NaHCO3溶液中所含微粒种类相同 B、CaCl2能促进Na2CO3、NaHCO3水解 C、Al2(SO4)3能促进Na2CO3、NaHCO3水解 D、4个实验中,溶液滴入后,试管中溶液pH均降低2. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:3. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。下列叙述错误的是( )
 A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数4. LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[ ]下列有关LiH2PO4溶液的叙述正确的是( )
A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数4. LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[ ]下列有关LiH2PO4溶液的叙述正确的是( )

 A、溶液中存在3个平衡 B、含P元素的粒子有H2PO4–、HPO42–、PO43– C、随c初始(H2PO4–)增大,溶液的pH明显变小 D、用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3 , 当pH达到4.66时,H3PO4几乎全部转化为LiH2PO45. 氯化铵溶液中放入镁粉能放出H2和NH3 , 产生这种现象的原因是( )A、金属镁能把NH3置换出来 B、镁具有强还原性,NH具有氧化性,发生氧化还原反应 C、因为NH水解溶液显酸性,Mg与H+反应放出H2 , 平衡向正反应方向移动 D、因为Mg与H2O反应,生成Mg(OH)2与NH4Cl反应6. 将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系错误的是( )A、c(Na+)>c(Cl-)>c(H+)>c(OH-) B、c(Ac-)>c(Cl-)>c(HAc)>c(H+) C、c(Na+)>c(Ac-)+c(Cl-) D、c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-)7. 25℃时,向25mL0.1mol·L-1邻苯二甲酸(H2A)溶液中加入KOH固体,混合溶液的pH随-lgc(HA-)以及-lgc(A2-)的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发)。下列有关叙述错误的是( )
A、溶液中存在3个平衡 B、含P元素的粒子有H2PO4–、HPO42–、PO43– C、随c初始(H2PO4–)增大,溶液的pH明显变小 D、用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3 , 当pH达到4.66时,H3PO4几乎全部转化为LiH2PO45. 氯化铵溶液中放入镁粉能放出H2和NH3 , 产生这种现象的原因是( )A、金属镁能把NH3置换出来 B、镁具有强还原性,NH具有氧化性,发生氧化还原反应 C、因为NH水解溶液显酸性,Mg与H+反应放出H2 , 平衡向正反应方向移动 D、因为Mg与H2O反应,生成Mg(OH)2与NH4Cl反应6. 将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系错误的是( )A、c(Na+)>c(Cl-)>c(H+)>c(OH-) B、c(Ac-)>c(Cl-)>c(HAc)>c(H+) C、c(Na+)>c(Ac-)+c(Cl-) D、c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-)7. 25℃时,向25mL0.1mol·L-1邻苯二甲酸(H2A)溶液中加入KOH固体,混合溶液的pH随-lgc(HA-)以及-lgc(A2-)的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发)。下列有关叙述错误的是( ) A、邻苯二甲酸的Ka1约为1.0×10-3 B、b点有关微粒浓度大小关系为(HA-)>c(A2-)>c(H2A) C、从b点到e点,水电离产生的c(H+)先增大后减小 D、c点c(K+)>3c(A2-)8. , 向 溶液中滴入等浓度的 溶液, 下列判断一定正确的是( )A、若最终溶液含等摩尔 和 , 则 B、若 溶液过量, 则 C、若 溶液不足量, 则 溶液加入越少水的电离程度越大 D、若恰好完全反应, 则9. 25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)[δ(RCOOH)=]也随之改变。甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )
A、邻苯二甲酸的Ka1约为1.0×10-3 B、b点有关微粒浓度大小关系为(HA-)>c(A2-)>c(H2A) C、从b点到e点,水电离产生的c(H+)先增大后减小 D、c点c(K+)>3c(A2-)8. , 向 溶液中滴入等浓度的 溶液, 下列判断一定正确的是( )A、若最终溶液含等摩尔 和 , 则 B、若 溶液过量, 则 C、若 溶液不足量, 则 溶液加入越少水的电离程度越大 D、若恰好完全反应, 则9. 25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)[δ(RCOOH)=]也随之改变。甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( ) A、丙酸的电离常数数量级为10-5 B、等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者 C、水的电离程度:M点<N点 D、将0.1mol·L-1的HCOOH溶液与0.1mol·L-1的HCOONa溶液等体积混合,所得溶液中:c(HCOO-)>c(Na+)>c(HCOOH)>c(H+)>c(OH-)10. 常温下,向10 mL0.1 mol·L-1丙烯酸(CH2=CHCOOH)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。
A、丙酸的电离常数数量级为10-5 B、等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者 C、水的电离程度:M点<N点 D、将0.1mol·L-1的HCOOH溶液与0.1mol·L-1的HCOONa溶液等体积混合,所得溶液中:c(HCOO-)>c(Na+)>c(HCOOH)>c(H+)>c(OH-)10. 常温下,向10 mL0.1 mol·L-1丙烯酸(CH2=CHCOOH)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。
已知:AG=lg , 电离度=x 100%。
若忽略溶液混合时的体积变化,下列说法正确的是( )
A、b点对应的溶液中:c( Na+) >c(CH2=CHCOO-) >c(H+) >c(OH-) B、d点对应的溶液中:c(OH-) =c(H+) +c(CH2=CHCOO-) +c( CH2=CHCOOH) C、0.1 mol·L-1 CH2=CHCOOH溶液中丙烯酸的电离度近似等于10% D、若AG=0时V=x,则丙烯酸的电离常数为Ka=×10-711. 向100mL 0.1mol·L-1K2CO3溶液中缓慢滴加100mL 0.2mol·L-1盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示(H+和OH-未画出),已知:碳酸的电离平衡常数Ka1=4.31×10-7 , Ka2=5.60×10-11 , 下列说法错误的是( ) A、滴加至A点时, B、滴加至B点时, C、滴加至C点时, D、滴加至D点时,溶液的pH<712. 向盛有溶液的烧杯中,加入少量氨水,再加入过量Mg粉,有大量气泡产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的pH随时间的变化如图。
A、滴加至A点时, B、滴加至B点时, C、滴加至C点时, D、滴加至D点时,溶液的pH<712. 向盛有溶液的烧杯中,加入少量氨水,再加入过量Mg粉,有大量气泡产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的pH随时间的变化如图。
下列说法不正确的是( )
A、随着反应的进行,降低 B、产生的气体是混合物 C、pH=9时,溶液中 D、溶液的pH升高可能是Mg与、反应的结果13. 下列有关化学用语表示正确的是( )A、硬脂酸与乙醇发生酯化反应:C17H35COOH+C2H518OHC17H35CO18OC2H5+H2O B、用乙烯制备二氯乙烷:CH2=CH2+Cl2→CH3CHCl2 C、KHSO4熔融状态下电离:KHSO4=K++H++SO D、HCO水解:HCO+H2OCO+H3O+14. 某小组进行以下探究。实验①:Mg条与盐酸-KCl溶液(pH=3.08)反应;实验②:Mg条与0.001 溶液(pH=3.08)反应。两个实验所用的Mg条(打磨过)足量且表面积相同。测得溶液pH随时间变化的曲线如下图所示。两个实验过程中均观察到有无色气体产生,实验②中没有检测到和Fe。
下列说法不正确的是( )
A、无色气体为 B、0~200秒,实验②产生氢气的速率比实验①慢 C、实验①②中pH发生突变与Mg和水的反应有关 D、400秒时,:实验②>实验①15. 水溶液呈碱性的盐是A、 B、 C、 D、16. 室温下,下列说法正确的是( )A、含等物质的量的和的溶液呈碱性,可知 B、同的溶液:① ② ③ ④ , 物质的量浓度最大的是④ C、物质的量浓度相同的盐酸和醋酸溶液,存在 D、相同物质的量浓度的氨水和盐酸充分混合,若 , 则(氨水)(盐酸)17. ( )极易水解,主要用于制备酰基氯化物。下列关于说法错误的是( ) A、既有氧化性又有还原性 B、遇水反应生成和 C、可用作由制取无水的脱水剂 D、18. H2X为二元弱酸。20℃时,向100mL0.1mol·L-1的Na2X溶液中缓慢通入HCl(忽略溶液体积变化及H2X的挥发)。指定溶液中微粒的物质的量浓度关系一定正确的是( )A、通入HCl前:c(X2-)>c(HX-)>c(OH-)>c(H+) B、若通入5×10-3molHCl,溶液呈碱性,则溶液中c(X2-)=c(HX-) C、pH=7时:溶液中c(HX-)>c(Cl-) D、c(Cl-)=0.1mol·L-1时:c(OH-)-c(H+)=c(H2X)-c(X2-)19. 下列叙述正确的是( )A、0.1mol•L-1NH4Cl溶液:c(NH4+)=c(Cl-) B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 C、0.1mol•L-1与0.2mol•L-1氨水溶液中c(OH-)之比为1:2 D、中和pH与体积都相同的NaOH和Ba(OH)2溶液,消耗HCl的物质的量之比是1:220. 下列说法正确的是( )A、六水合氯化镁在空气中加热生成无水氯化镁 B、钠可以置换出四氯化钛溶液中的钛 C、二氧化碳通入氨的氯化钠饱和溶液中析出碳酸氢钠晶体 D、干燥的氯气不能漂白鲜花21. 室温下,用相同浓度的溶液,分别滴定浓度均为的三种酸、和溶液,滴定曲线如图所示。下列判断错误的是 ( )
)极易水解,主要用于制备酰基氯化物。下列关于说法错误的是( ) A、既有氧化性又有还原性 B、遇水反应生成和 C、可用作由制取无水的脱水剂 D、18. H2X为二元弱酸。20℃时,向100mL0.1mol·L-1的Na2X溶液中缓慢通入HCl(忽略溶液体积变化及H2X的挥发)。指定溶液中微粒的物质的量浓度关系一定正确的是( )A、通入HCl前:c(X2-)>c(HX-)>c(OH-)>c(H+) B、若通入5×10-3molHCl,溶液呈碱性,则溶液中c(X2-)=c(HX-) C、pH=7时:溶液中c(HX-)>c(Cl-) D、c(Cl-)=0.1mol·L-1时:c(OH-)-c(H+)=c(H2X)-c(X2-)19. 下列叙述正确的是( )A、0.1mol•L-1NH4Cl溶液:c(NH4+)=c(Cl-) B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 C、0.1mol•L-1与0.2mol•L-1氨水溶液中c(OH-)之比为1:2 D、中和pH与体积都相同的NaOH和Ba(OH)2溶液,消耗HCl的物质的量之比是1:220. 下列说法正确的是( )A、六水合氯化镁在空气中加热生成无水氯化镁 B、钠可以置换出四氯化钛溶液中的钛 C、二氧化碳通入氨的氯化钠饱和溶液中析出碳酸氢钠晶体 D、干燥的氯气不能漂白鲜花21. 室温下,用相同浓度的溶液,分别滴定浓度均为的三种酸、和溶液,滴定曲线如图所示。下列判断错误的是 ( )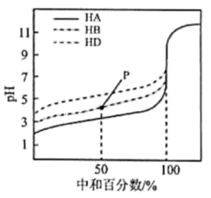 A、三种酸的电离常数关系: B、点时,溶液中: C、时,三种溶液中: D、当中和达时,溶液中:22. 类比pH,定义pC=-lgC,已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸,常温下,向1L0.1mol/L的H2A溶液中加入氢氧化钠固体,得到混合溶液的pH与pC(H2A、HA-、A2-)的关系如图所示(不考虑溶液体积和温度的变化),下列说法正确的是( )
A、三种酸的电离常数关系: B、点时,溶液中: C、时,三种溶液中: D、当中和达时,溶液中:22. 类比pH,定义pC=-lgC,已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸,常温下,向1L0.1mol/L的H2A溶液中加入氢氧化钠固体,得到混合溶液的pH与pC(H2A、HA-、A2-)的关系如图所示(不考虑溶液体积和温度的变化),下列说法正确的是( ) A、曲线I、II、III分别代表的粒子为A2- , H2A,HA- B、向pH=4.19的溶液中加NaOH至溶液pH=5.57的过程中水的电离程度逐渐减小 C、滴定过程中 =101.38保持不变 D、c(Na+)=0.1mol/L时,溶液满足c(Na+)>c(HA-)>c(H2A)>c(A2-)23. 下列实验操作、现象和所得结论都正确的是( )
A、曲线I、II、III分别代表的粒子为A2- , H2A,HA- B、向pH=4.19的溶液中加NaOH至溶液pH=5.57的过程中水的电离程度逐渐减小 C、滴定过程中 =101.38保持不变 D、c(Na+)=0.1mol/L时,溶液满足c(Na+)>c(HA-)>c(H2A)>c(A2-)23. 下列实验操作、现象和所得结论都正确的是( )选项
实验
现象
结论
A
向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡
溶液红色变浅
Na2CO3溶液存在水解平衡
B
向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液
溶液变为红色
X溶液中一定含有Fe2+
C
检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验
试纸不变蓝
该食盐不含有KIO3
D
向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液
均有沉淀生成
蛋白质均发生了盐析
A、A B、B C、C D、D24. H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2 O42-) =0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是( ) A、由图可知:Ka2(H2C2O4)的数量级为10-4 B、若将0.05mol NaHC2O4和0.05mol Na2C2O4固体完全溶于水配成1L溶液,所得混合液的pH为4 C、c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) D、用标准的氢氧化钠溶液滴定H2C2O4溶液,可用酚酞做指示剂
A、由图可知:Ka2(H2C2O4)的数量级为10-4 B、若将0.05mol NaHC2O4和0.05mol Na2C2O4固体完全溶于水配成1L溶液,所得混合液的pH为4 C、c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) D、用标准的氢氧化钠溶液滴定H2C2O4溶液,可用酚酞做指示剂二、多选题
-
25. 25℃时,向 的 溶液中滴加 的盐酸,溶液的 随加入的盐酸的体积 变化如图所示。下列有关说法正确的是( )
 A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,
A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,三、非选择题
-
26. 生活污水中氮是造成水体富营养化的主要原因。
完成下列填空:
(1)、某污水中存在NH4Cl。写出NH4Cl的电子式。该污水呈现酸性的原因 (结合离子方程式及相关文字说明)。(2)、向饱和NH4Cl溶液中加入或通入一种物质,可以使NH4Cl结晶析出,这种物质可以是 (任写-种),理由是。(3)、某污水中同时存在NH4+和NO3-时,可用下列方法除去:先利用O2将NH4+氧化成NO3-。请配平下列离子方程式并标出电子转移的方向和数目。 NH4++O2→ NO3-+ H2O+ H+; , 再将NO3-还原成N2 , 反应的离子方程式:2NO3-+5H2 N2+2 O H-+4H2O①NH4NO3晶体中所含化学键为。
② 若该污水中含有1mol NH4NO3 , 用以上方法处理完全后,共消耗mol氢气。
③ 该污水处理方法的好处是。
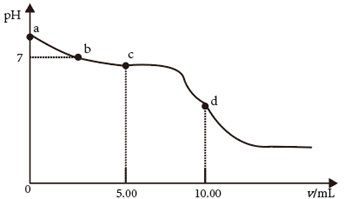
27.(1)、①25℃时,NH4Cl溶液呈酸性,原因是水解引起的(填“NH4+”或“Cl-”);②常温下,0.0100mol/L NaOH溶液的pH=;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是(填“AgCl”或“Ag2S”)。
(2)、已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列:
① 该反应的热化学方程式是 ;
② 该反应达到平衡后,升高温度平衡向 (填“正”、“逆”)反应方向移动;加入催化剂平衡(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是。
(3)、燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 (填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:。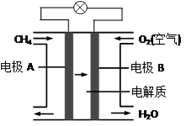 。28. 为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
。28. 为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
小组记录的实验现象如下表所示:
开始时
5min后
3天后
实验I
溶液立即变为红褐色,比II、III中略浅
与开始混合时一致
溶液呈黄色,底部出现红褐色沉淀
实验II
溶液立即变为红褐色
红褐色明显变浅
溶液呈黄绿色
实验III
溶液立即变为红褐色
红褐色变浅,比II中深
溶液呈黄色
(1)、测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是(用离子方程式表示)。(2)、开始混合时,实验I中红褐色比II、III中略浅的原因是。(3)、为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是。(4)、针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②;
③NO3- 在酸性环境下代替Fe3+氧化了SO32- , 同时消耗H+ , 使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响)
5min后的现象
实验V
在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约固体,再加入2滴0.4mol/L Na2SO3溶液
溶液的红褐色介于II、III之间
实验VI
在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)、通过上述实验,以下结果或推论合理的是(填字母)。a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2 , 使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
29. 人类对锡(50Sn)的使用有悠久的历史,可以追溯到大约公元前3000年,但这也是对锡的“异常”不断加深认识,不断“驯服”它的历史。(1)、锡与硅同主族,稳定化合价均为+4价,锡原子比硅原子核外多2个电子层,锡元素在周期表中的位置为。(2)、锡单质在常温下稳定(主要单质类别为白锡),但是它既怕冷又怕热。在-13.2℃以下,白锡转变成一种无定形的灰锡(粉末状),而且只要白锡接触到很少的灰锡。很失就会变成灰锡完全毁坏,就像得了瘟疫一样。①克服锡单质这一弱点的方法之一就是做成合金,合金与组分金属相比一般具有性质。
a.不导电 b硬度大
c.耐腐蚀
②对锡器的“瘟疫”作分析,以下推测合理的是。
a.灰锡携带病毒
b.灰锡与白锡形成原电池,加速白锡的转化
c.灰锡是白锡转化的催化剂,加速反应
(3)、实验室配制氯化亚锡(SnCl2)溶液时发现,向SnCl2固体中加水的过程中,产生刺激性气味气体,且只能得到悬浊液。配制、保存SnCl2溶液时,要用到的试剂为氯化亚锡固体、、和水(填试剂名称)。(4)、工业上,硫离子是一种很好的沉淀剂。但向1L 0.01 mol·L-1硫化钠溶液(pH=12)中逐渐加入SnCl2粉末时,一开始却并没观察至沉淀。请分析原因。当加SnCl2至溶液pH=9时,有两种沉淀生成。此时溶液中硫离子浓度为(保留两位有效数字)。(提示:25℃时,Ksp[Sn(OH)2]=1.4×10-28 , Ksp(SnS)=1.0×10-25。 Sn(OH)2 是两性物质。)(5)、测定固体中锡的含量时,常用的一种方法为:在强酸性环境中将固体溶解,然后将锡元素全部转化成Sn2+ , 以淀粉为指示剂,用碘酸钾标准溶液滴定。但在滴定初始并没有出现蓝色,滴定终点的现象为无色变蓝色。写出滴定过程中依次发生反应的离子反应方程式 , 。30. 钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)、BaTiO3中Ti元素的化合价为:。(2)、用盐酸酸浸时发生反应的离子方程式为: 。(3)、流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。①过滤操作中使用的玻璃仪器有。
②如何证明晶体已洗净?。
(4)、TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:。(5)、某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3 , 得产品13.98g,BaTiO3的产率为:。(6)、流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为 mol/L。31. 焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5 , 某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:(1)、采用下图装置制取Na2S2O5 , 装置Ⅲ中有Na2S2O5晶体析出。
①装置Ⅰ中盛放浓硫酸的仪器名称为;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是;裝置Ⅳ的作用是 , 盛装的试剂为。
(2)、将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因。
(3)、检验Na2S2O5晶体在空气中已被氧化的实验方案是。(4)、葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为g·L-1 , 该数据说明某葡萄酒中SO2的残留量 (填“是”或“否”)达到我国国家标准。
32. I.2Al+Fe2O3 Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:(1)、氧元素在元素周期表中的位置为 , 其离子结构示意图为。(2)、铝盐常用作净水剂,用文字和化学用语进行解释。(3)、氧的非金属性强于氮,用元素周期律知识分析原因。(4)、Al2O3与NaOH溶液反应的离子方程式为。(5)、II.NH4Al(SO4)2·12H2O水溶液呈性(选填“酸”、“碱”或“中”),比较溶液中离子浓度大小c(NH4+)c(Al3+)(选填“>”、“<”或“=”)。33. ①一水合氨 ②盐酸 ③氢氧化钠 ④碳酸氢钠 ⑤次氯酸钠 ⑥硫酸铝是实验室和生活中常见的物质。(1)、写出的电离方程式。(2)、次氯酸钠是84消毒液的主要成分,84消毒液呈(填“酸性”或“碱性”),结合化学用语解释原因:。(3)、将等浓度等体积的①与②混合后,溶液中存在的离子浓度由大到小的顺序是:。(4)、常温下的和的溶液,由水电离出的之比为。(5)、有关的溶液()的叙述正确的是____。A、溶液中所含微粒共四种,分别为 B、的电离程度大于水解程度 C、 D、(6)、泡沫灭火器使用碳酸氢钠和硫酸铝溶液产生大量气体来灭火,结合化学用语,从平衡移动角度解释产生的原因:。34. 溶液是常见的强碱弱酸盐,可由醋酸和溶液反应得到。(1)、用化学用语表示溶液呈碱性的原因(用离子方程式表示);溶液呈电中性,请用等式表示这一现象(用浓度符号“c”表示)(2)、用分别滴定盐酸和醋酸,滴定过程中变化曲线如图所示。

①在上述滴定过程中,不需要使用的玻璃仪器是(填序号)。
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据判断滴定盐酸的变化曲线为(填“图1”或“图2”),判断的理由:
ⅰ、起始未滴加液时,盐酸的。
ⅱ、加入溶液恰好反应时,所得溶液的。
③滴定溶液的过程中,当滴加溶液时,溶液中各离子浓度由大到小的顺序是(用符号“c”及“>”表示),此时溶液中。
(3)、用盐酸滴定未知浓度的溶液。下列操作会使测定结果偏低的是____。A、量取溶液的碱式滴定管未用待测碱液润洗 B、酸式滴定管未用标准盐酸润洗 C、滴定过程中滴定管内不慎有标准液溅出 D、滴定前俯视读数,滴定后读数正确35. 甲酸又名蚁酸,是一种常见的弱酸,常温下甲酸的电离平衡常数(已知)。(1)、设计实验证明甲酸为弱酸,下列实验设计合理的是____(填选项字母)。A、将甲酸溶液滴入溶液中,观察是否有气泡生成 B、向体积相同、相同的盐酸和甲酸溶液中加入足量 , 比较溶解的质量 C、取一定浓度的甲酸钠溶液,测其(2)、的甲酸钠溶液和的甲酸溶液等体积混合可配成一种缓冲溶液。①的水解平衡常数。
②该混合溶液的约为。
③该混合溶液中(填“>”“=”或“<”)。
(3)、催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。
①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是(填“II”“III”或“IV”)。
②由反应进程可知甲酸分解的(填“>”“=”或“<”)0,该历程中的决速步骤为(填选项字母),历程中最大能垒(活化能)。
a.I转化为II的过程 b.II转化为III的过程
c.III转化为IV的过程 d.IV转化为I的过程
-