高考二轮复习知识点:水的电离
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是
 A、约为 B、点a: C、点b: D、水的电离程度:2. 下列说法错误的是( )A、 的盐酸中 B、将 溶液从常温加热至 ,溶液的 变小但仍保持中性 C、常温下, 溶液呈碱性,说明 是弱电解质 D、常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大3. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。常温下,的电离常数 , , 利用盐酸滴定某溶液中的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是
A、约为 B、点a: C、点b: D、水的电离程度:2. 下列说法错误的是( )A、 的盐酸中 B、将 溶液从常温加热至 ,溶液的 变小但仍保持中性 C、常温下, 溶液呈碱性,说明 是弱电解质 D、常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大3. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。常温下,的电离常数 , , 利用盐酸滴定某溶液中的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是
(注:−表示电极电位曲线;…表示pH曲线)
A、该滴定过程需要加入酸碱指示剂 B、水的电离程度:a<b C、a点溶液中 D、b点溶液中存在:4. 化学上常用表示溶液中的。时,用的溶液滴定的溶液(),滴定过程中与所加溶液的体积()的关系如图所示(忽略体积变化),下列说法错误的是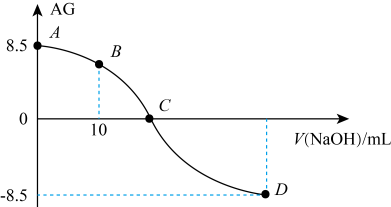 A、点溶液的 , 从点到点的过程中,水的电离程度先变大再变小 B、点溶液中存在: C、点加入溶液的体积小于 , 溶质为和 D、点加入溶液的体积小于5. 某研究小组利用电位滴定法研究盐酸滴加亚磷酸钠溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法错误的是
A、点溶液的 , 从点到点的过程中,水的电离程度先变大再变小 B、点溶液中存在: C、点加入溶液的体积小于 , 溶质为和 D、点加入溶液的体积小于5. 某研究小组利用电位滴定法研究盐酸滴加亚磷酸钠溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法错误的是
[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。②亚磷酸是二元弱酸,其电离常数分别是 , ]
A、a点对应溶液的溶质为和 , B、第二次电极电位突跃发生的化学反应为: C、c点对应的溶液中可能存在: D、水的电离程度:a>b6. 室温下,下列说法正确的是( )A、向溶液中加水稀释,溶液中减小 B、等物质的量浓度的和NaF溶液,前者pH较大,则可发生反应: C、的溶液与的溶液,水的电离程度相同 D、等浓度、等体积的NaOH溶液和二元弱酸溶液混合后溶液呈酸性,则混合液中:7. 向溶液中持续滴加稀盐酸,记录溶液及温度随时间的变化如图所示。下列说法正确的是 A、溶液的起始浓度为 B、在滴定至终点的过程中,水的电离程度不断减小 C、对应的溶液中均存在: D、由后溶液的温度变化可推知,与的反应是吸热反应8. 某温度下,将pH和体积均相同的HCl和溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述错误的是
A、溶液的起始浓度为 B、在滴定至终点的过程中,水的电离程度不断减小 C、对应的溶液中均存在: D、由后溶液的温度变化可推知,与的反应是吸热反应8. 某温度下,将pH和体积均相同的HCl和溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述错误的是 A、稀释前溶液的浓度: B、溶液中水的电离程度:b点<c点 C、从b点到d点,溶液中逐渐增大 D、在d点和e点均存在:(酸根阴离子)9. 常温下,向的溶液中以恒定的速率滴加稀盐酸,测得溶液pH随时间的变化如图所示。下列有关叙述错误的是
A、稀释前溶液的浓度: B、溶液中水的电离程度:b点<c点 C、从b点到d点,溶液中逐渐增大 D、在d点和e点均存在:(酸根阴离子)9. 常温下,向的溶液中以恒定的速率滴加稀盐酸,测得溶液pH随时间的变化如图所示。下列有关叙述错误的是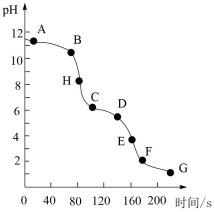 A、溶液中水的电离程度: B、B点对应的溶液满足关系: C、CD段主要发生的反应为: D、H点对应的溶液满足关系:10. 室温下,向20.0 mL 0.100 mol∙L−1的某弱酸HA的溶液中滴加同浓度的NaOH溶液,过程中随pH的变化关系如下图所示。下列说法错误的是
A、溶液中水的电离程度: B、B点对应的溶液满足关系: C、CD段主要发生的反应为: D、H点对应的溶液满足关系:10. 室温下,向20.0 mL 0.100 mol∙L−1的某弱酸HA的溶液中滴加同浓度的NaOH溶液,过程中随pH的变化关系如下图所示。下列说法错误的是 A、a到c的过程中,为定值 B、a到c的过程中,水的电离程度不断减小 C、b点时, D、c点时加入碱的体积小于20 mL11. 25℃时,用HCl气体调节0.1 mol/L氨水的pH,溶液中微粒浓度的对数值(1gc)、反应物的物质的量之比x与pH的关系如下图。若忽略通入气体后溶液体积的变化,[x=] 正确的是
A、a到c的过程中,为定值 B、a到c的过程中,水的电离程度不断减小 C、b点时, D、c点时加入碱的体积小于20 mL11. 25℃时,用HCl气体调节0.1 mol/L氨水的pH,溶液中微粒浓度的对数值(1gc)、反应物的物质的量之比x与pH的关系如下图。若忽略通入气体后溶液体积的变化,[x=] 正确的是 A、水的电离程度:P1>P2>P3 B、P2所示溶液中:c(Cl-)=c()+c(NH3·H2O) C、P3所示溶液中:c()>c(Cl-)>c(OH-)>c(H+) D、25℃时,的水解常数为10-9.2512. 已知:常温下,HCOOH的酸性强于CH3COOH。现将 pH=3,体积均为V0的两种酸溶液分别加水稀释至体积 V,pH 随lg的变化如图所示。下列叙述正确的是
A、水的电离程度:P1>P2>P3 B、P2所示溶液中:c(Cl-)=c()+c(NH3·H2O) C、P3所示溶液中:c()>c(Cl-)>c(OH-)>c(H+) D、25℃时,的水解常数为10-9.2512. 已知:常温下,HCOOH的酸性强于CH3COOH。现将 pH=3,体积均为V0的两种酸溶液分别加水稀释至体积 V,pH 随lg的变化如图所示。下列叙述正确的是 A、溶液中水的电离程度:a>b>c>d B、a 点的两种酸溶液分别与 NaOH 恰好完全中和后,溶液中n(Na+)相同 C、曲线I表示CH3COOH溶液的变化曲线 D、同温下 pH 相同的 NaOH 溶液、CH3COONa 溶液、HCOONa 溶液、NaHCO3溶液的浓度:c(NaOH)<c(NaHCO3)<c(CH3COONa)<c(HCOONa)13. 室温下,用0.05000mol·L-1稀硫酸滴定20.00mL某浓度的MOH溶液,混合溶液的pH随加入稀硫酸体积的变化如图所示。下列说法正确的是
A、溶液中水的电离程度:a>b>c>d B、a 点的两种酸溶液分别与 NaOH 恰好完全中和后,溶液中n(Na+)相同 C、曲线I表示CH3COOH溶液的变化曲线 D、同温下 pH 相同的 NaOH 溶液、CH3COONa 溶液、HCOONa 溶液、NaHCO3溶液的浓度:c(NaOH)<c(NaHCO3)<c(CH3COONa)<c(HCOONa)13. 室温下,用0.05000mol·L-1稀硫酸滴定20.00mL某浓度的MOH溶液,混合溶液的pH随加入稀硫酸体积的变化如图所示。下列说法正确的是 A、若反应在绝热容器中进行,a点对应的溶液温度最高 B、水的电离程度c>b>a C、b点对应的溶液中,c(M+):c(MOH)=104:1 D、c点对应的溶液中,c(H+)=c(OH-)+c(M+)+c(MOH)14. 常温下,水溶液中部分缓冲对的微粒浓度之比的对数值[x表示或]与溶液pH的关系如图所示。下列说法错误的是
A、若反应在绝热容器中进行,a点对应的溶液温度最高 B、水的电离程度c>b>a C、b点对应的溶液中,c(M+):c(MOH)=104:1 D、c点对应的溶液中,c(H+)=c(OH-)+c(M+)+c(MOH)14. 常温下,水溶液中部分缓冲对的微粒浓度之比的对数值[x表示或]与溶液pH的关系如图所示。下列说法错误的是 A、曲线Ⅰ表示与溶液pH的变化关系 B、 C、a→b的过程中,水的电离程度逐渐减小 D、当pH增大时,的值逐渐增大15. 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用的NaOH标准溶液滴定同浓度的溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知。下列说法错误的是
A、曲线Ⅰ表示与溶液pH的变化关系 B、 C、a→b的过程中,水的电离程度逐渐减小 D、当pH增大时,的值逐渐增大15. 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用的NaOH标准溶液滴定同浓度的溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知。下列说法错误的是 A、a点溶液中 B、b点溶液中 C、常温时,c点溶液中 D、b、d点水的电离程度:16. 常温下,向25mL0.1mol·L-1某二元弱酸H2R溶液中加入NaOH固体或通入HCl。已知:HR-的电离平衡常数(Ka=10-n)大于水解平衡常数。下列有关叙述正确的是A、在加入NaOH固体或通入HCl的过程中,水的电离程度均一直减小 B、pH=7时,c(HR-)+c(R2-)+c(OH-)=c(H+)+c(Na+) C、在NaHR溶液中,有关微粒浓度大小关系为c(HR-)>c(H2R)>c(R2-) D、加入NaOH固体至pH=n,此时存在c(H+)+c(Na+)=c(OH-)+3c(HR-)17. 电位滴定法是化学中常用的分析方法,可根据滴定过程中电极电位的突跃确定滴定终点。常温下,利用盐酸滴定一定物质的量浓度的碳酸钠溶液,其电位滴定曲线与pH曲线如图所示(已知:碳酸的电离常数Ka1=10−6.4 , Ka2=10−10.3)。下列说法正确的是
A、a点溶液中 B、b点溶液中 C、常温时,c点溶液中 D、b、d点水的电离程度:16. 常温下,向25mL0.1mol·L-1某二元弱酸H2R溶液中加入NaOH固体或通入HCl。已知:HR-的电离平衡常数(Ka=10-n)大于水解平衡常数。下列有关叙述正确的是A、在加入NaOH固体或通入HCl的过程中,水的电离程度均一直减小 B、pH=7时,c(HR-)+c(R2-)+c(OH-)=c(H+)+c(Na+) C、在NaHR溶液中,有关微粒浓度大小关系为c(HR-)>c(H2R)>c(R2-) D、加入NaOH固体至pH=n,此时存在c(H+)+c(Na+)=c(OH-)+3c(HR-)17. 电位滴定法是化学中常用的分析方法,可根据滴定过程中电极电位的突跃确定滴定终点。常温下,利用盐酸滴定一定物质的量浓度的碳酸钠溶液,其电位滴定曲线与pH曲线如图所示(已知:碳酸的电离常数Ka1=10−6.4 , Ka2=10−10.3)。下列说法正确的是 A、该实验中,a点须选择酚酞作指示剂 B、a点:c(Cl-) <c()+c()+c(H2CO3) C、水的电离程度:a点<b点 D、b点:比值的数量级为10718. 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的一元碱BOH溶液。溶液中,pH、B+的分布系数δ随滴加盐酸体积VHCl的变化关系如图所示。已知B+的分布系数。下列叙述正确的是
A、该实验中,a点须选择酚酞作指示剂 B、a点:c(Cl-) <c()+c()+c(H2CO3) C、水的电离程度:a点<b点 D、b点:比值的数量级为10718. 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的一元碱BOH溶液。溶液中,pH、B+的分布系数δ随滴加盐酸体积VHCl的变化关系如图所示。已知B+的分布系数。下列叙述正确的是 A、BOH的电离常数Kb=1.0× 10-6 B、滴定时,可以选择甲基橙作指示剂 C、滴定过程中,水的电离程度: n<m<p D、n点溶液中,粒子浓度大小为c(Cl-)>c(B+)> c(BOH)
A、BOH的电离常数Kb=1.0× 10-6 B、滴定时,可以选择甲基橙作指示剂 C、滴定过程中,水的电离程度: n<m<p D、n点溶液中,粒子浓度大小为c(Cl-)>c(B+)> c(BOH)二、多选题
-
19. 常温下,向 溶液中逐滴加入0.2 溶液10.0 ,溶液中微粒的物质的量(挥发的 未画出)随 的变化如下图所示。下列说法正确的是( )
 A、随着盐酸的加入,溶液中水的电离程度先减小后增大 B、 的水解常数 的数量级约为 C、a点对应溶液中离子浓度: D、b点对应溶液中:20. 已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3 , Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )A、0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-) B、加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A) C、加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A) D、在滴定过程中,水的电离程度一直减小21. 已知电导率越大导电能力越强。常温下用0.100mol·L-1 NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。
A、随着盐酸的加入,溶液中水的电离程度先减小后增大 B、 的水解常数 的数量级约为 C、a点对应溶液中离子浓度: D、b点对应溶液中:20. 已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3 , Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )A、0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-) B、加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A) C、加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A) D、在滴定过程中,水的电离程度一直减小21. 已知电导率越大导电能力越强。常温下用0.100mol·L-1 NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。
下列说法正确的是( )
A、曲线②代表滴定盐酸的曲线 B、滴定醋酸的过程应该选择甲基橙作为指示剂 C、a、b、c三点溶液中水的电离程度:a>c>b D、b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+ c(CH3COOH)22. 已知NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO ,某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.对于该溶液,下列叙述不正确的是( )A、该温度高于25℃ B、由水电离出的c(H+)=1×10﹣12 mol•L﹣1 C、c(H+)=c(OH﹣)+c(SO42﹣) D、该温度下加入等体积pH为12的NaOH溶液,可使反应后的溶液恰好呈中性三、非选择题
-
23. H2O和H2O2在特殊条件下会出现某些特殊的性质。(1)、与常温常压的水相比,高温高压液态水的离子积会显著增大,其原因是。(2)、温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)的水称为超临界水。超临界水能够与氧气等氧化剂以任意比例互溶,由此形成了超临界水氧化技术。一定实验条件下,运用超临界水氧化技术氧化乙醇的结果如图-1、图-2所示,其中x为以碳元素计的物质的量分数,t为反应时间。

①由图-1,乙醇氧化过程中存在中间产物,该中间产物的化学式为。
②由图-2,随温度升高,x(CO)峰值出现的时间提前,且峰值更高,其可能的原因是。
(3)、过氧化氢的电离方程式为H2O2⇌H++ 。研究表明,过氧化氢溶液中HO 的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图-3所示。
一定浓度的过氧化氢,随pH增大分解率增大的原因是。
(4)、半导体光催化剂在水中光照发生水光催化反应的原理如图-4所示(“h+”表示“空穴”),“价带”上发生的反应为2H2O+4h+=4H++O2↑。该光催化水分解的过程可描述为:在一定波长光线(hv)的照射下,。24. 在某温度时,将1.0mol・L-1氨水滴入10 mL1.0mol・L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示: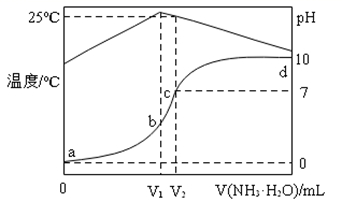 (1)、a、b、c、d对应的溶液中水的电离程度由大到小的是。(2)、氨水体积滴至时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据;此时溶液中离子浓度由大到小的顺序是。25. NaClO2是一种高效氧化剂和优质漂白剂,一种“二氧化氯泡腾片”有效成分为NaClO2、NaHCO3、NaHSO4 , 该泡腾片能快速溶于水,产生大量气泡,得到ClO2溶液。完成下列填空:(1)、“二氧化氯泡腾片”使用过程中产生ClO2的反应为:_ClO +_ _→_Cl- + _ClO2 +_H2O
(1)、a、b、c、d对应的溶液中水的电离程度由大到小的是。(2)、氨水体积滴至时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据;此时溶液中离子浓度由大到小的顺序是。25. NaClO2是一种高效氧化剂和优质漂白剂,一种“二氧化氯泡腾片”有效成分为NaClO2、NaHCO3、NaHSO4 , 该泡腾片能快速溶于水,产生大量气泡,得到ClO2溶液。完成下列填空:(1)、“二氧化氯泡腾片”使用过程中产生ClO2的反应为:_ClO +_ _→_Cl- + _ClO2 +_H2O完成并配平上述化学方程式,标出电子转移方向与数目;氧化剂与还原剂的物质的量之比为。
(2)、“二氧化氯泡腾片”使用过程中“产生大量气泡”的离子方程式为:。(3)、常温下,向20 mL某新制氯水中逐滴滴入相同物质的量浓度的氢氧化钠溶液,pH变化与加入NaOH溶液体积关系(不考虑HClO分解)如图所示。
i.①→②过程中,水的电离程度的变化是。
ii.用离子方程式表示点③所示溶液中存在的水解平衡: 。
iii.在②点所示溶液中,用“>、<或 =”判断下列关系:
V1 40 mL;c(Cl-) c(ClO-) +c(HClO)。
26. 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: (1)、A点水的离子积为 , B点水的离子积为。造成水的离子积变化的原因是。(2)、下列说法正确的是(填字母)。
(1)、A点水的离子积为 , B点水的离子积为。造成水的离子积变化的原因是。(2)、下列说法正确的是(填字母)。a.图中A,B,D三点处Kw的大小关系:B>A>D
b.AB线上任意点的溶液均显中性
c.B点溶液的pH=6,显酸性
d.图中温度T1>T2
(3)、某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。①盛装0.2000 mol/L盐酸标准液应该用式滴定管。
②终点判断方法:。
③有关数据记录如下:
实验序号待测液体积(mL)所消耗盐酸标准液的体积(mL)
实验序号
待测液体积(mL)
所消耗盐酸标准液的体积(mL)
滴定前
滴定后
1
20.00
0.60
20.70
2
20.00
6.00
25.90
3
20.00
0.40
23.20
则NaOH溶液的物质的量浓度为mol/L。(保留四位有效数字)
④若滴定时锥形瓶未干燥,则测定结果;(填“无影响”、“偏高”或“偏低”)。
27.(1)、Ⅰ、研究水溶液中的粒子行为在研究中具有重要价值。根据下表所列三种溶液在25℃时的相关数据,按要求填空:
溶液
物质的量浓度
用离子方程式表示溶液显酸性的原因
(Ⅰ)
3
(Ⅱ)
6
/
(Ⅲ)
1
/
(2)、比较溶液(Ⅱ)、(Ⅲ)中的大小关系是(Ⅱ)(Ⅲ)(填“>”、“<”或“=”)。(3)、溶液(Ⅱ)中各离子浓度由大到小的顺序是。(4)、溶液(Ⅰ)和(Ⅱ)中由水电离出的之比是。(5)、Ⅱ、海水是巨大的化学资源宝库,利用海水可以直接或间接获取很多物质。如下图是氯碱工业中电解饱和氯化钠溶液的示意图,饱和氯化钠溶液从a口进入,溶液从(填b或d)口导出,阳离子交换膜的作用是;电解饱和氯化钠溶液的方程式为。
 28. 现有以下五种电解质溶液,回答下列问题:
28. 现有以下五种电解质溶液,回答下列问题:①CH3COOH②NaOH③NH3•H2O④H2SO4⑤CH3COONa
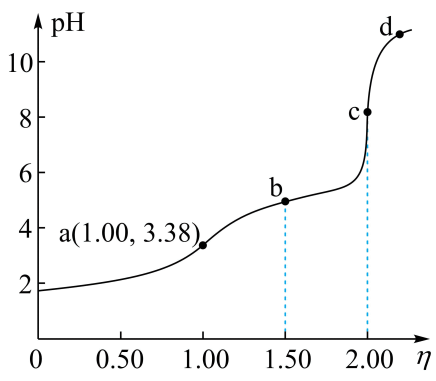
(1)、浓度均为0.1mol•L-1的五种溶液中导电能力最强的是(填序号)。(2)、pH=10的②③⑤三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为(填序号)。(3)、等体积的pH=2的①④两种溶液分别与足量金属锌反应,产生氢气的质量较多的是(填序号)。(4)、溶液①和溶液②混合后溶液呈中性,此时溶液中离子浓度由大到小的排列顺序为。(5)、室温下,pH=2的H2SO4溶液V1mL和pH=11的氢氧化钠溶液V2mL混合,恰好完全反应,=。29. 25℃时,某小组探究的性质。(1)、测得溶质的物质的量浓度为的溶液,为2.88。①的电离方程式是。
②25℃时,的(列出数学表达式)
(2)、测得溶质的物质的量浓度为的溶液,为3.38。小组同学判断稀释溶液时,的电离平衡向(填“左”或“右”)移动,理由是。(3)、查阅资料:25℃时, , , 推测25℃时下列反应可能发生的是(填字母)。a.
b.
c.
(4)、向的溶液中滴加的溶液,测得溶液变化如图。
①A点表示的溶液中,离子浓度由大到小的顺序是。
②A,B,C,D点表示的溶液中,水电离出的最大的是 (填字母)
30. 回答下列问题:(1)、用离子方程式表示碳酸钠溶液显碱性的主要原因:。(2)、亚磷酸()与足量NaOH溶液反应生成 , 从分类角度来看,属于(选填“酸式盐”、“正盐”或“碱式盐”)。(3)、等体积、等物质的量浓度的三种溶液:①盐酸②醋酸③硫酸,用某浓度NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小顺序为(用序号表示)。(4)、常温下,等体积、等物质的量浓度的盐酸与氨水混合后,溶液中水电离出的(填“>”、“=”或“<”)。(5)、25℃,向物质的量浓度均为的和混合溶液中,滴加溶液,首先沉淀的离子是 , 当两种难溶电解质均沉淀时,溶液中。[25℃, , ]31. 水的离子积常数与温度有关,回答下列问题:(1)、时,测得纯水中 , 则t(填“>”“<”或“=”),该温度下,溶液的。(2)、时,浓度相同的和的混合溶液中, , 则溶液中。(3)、时,的某强酸和的某强碱按体积比混合后,溶液恰好呈中性,则。32. 请回答以下问题:(1)、在常温下,溶液的 , 则溶液中由水电离出来的。(2)、火箭发射可以用肼( , 液态)作燃料,作氧化剂,两者反应生成和水蒸气。已知: ,
,
请写出与反应的热化学方程式。
(3)、常压下,物质的汽化热(液体在恒温下转化为气体时所吸收的热量)见下表:Ne
汽化热
548
1369
105
汽化热特别大的原因是。
(4)、下表列出了某短周期元素R的各级电离能数据(用、……表示)。元素
电离能
…
R
740
1500
7700
10500
13630
…
关于元素R的下列推断中,正确的是(用相应的编号填写)
①R元素基态原子的电子排布式为
②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为价
④R元素的第一电离能高于同周期相邻元素的第一电离能
(5)、溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为 , 忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=J。
(6)、根据甲醇在酸性电解质溶液中与氧气反应生成二氧化碳和水,设计了一种原电池,则该电池工作时,负极上反应的电极反应式为。33. 废水中的重金属离子通常用沉淀法除去。已知常温下各物质的溶度积或电离平衡常数如下表所示,请回答下列问题:(1)、溶液中加入一定量的反应后溶液呈中性,该溶液中(用 , 、等物质的浓度来表示)(2)、溶液中(填“>”、“<”、“=”),若向此溶液中加入溶液,恰好完全反应,所得溶液的7(填“>”、“<”、“=”)。(3)、向浓度均为0.1的和的混合溶液中加溶液,当加入溶液至出现两种沉淀时,则溶液中。(4)、向溶液中滴加溶液,滴加过程中与溶液体积(V)的关系如图所示。
A、B、C三点溶液中,水的电离程度最小的是点;溶液碱性最强的是点;和的乘积最小的是点。
34. 常温下,有的四种溶液:① ② ③ ④
(1)、任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:。(2)、溶液①的。(3)、溶液①、③等体积混合后,溶液中(填“>”、“<”或“=”)。(4)、溶液④中各离子浓度从大到小的顺序是。(5)、向中滴加溶液过程中,变化如图所示。
①滴加过程中发生反应的离子方程式是。
②下列说法正确的是。
a.A、C两点水的电离程度:A>C
b.B点溶液中微粒浓度满足:
c.D点溶液微粒浓度满足:
35. 回答下列问题:(1)、查阅资料,不同温度下水的离子积常数T/℃
0[
10
20
25
40
50
90
100
Kw/10-14
0.134
0.292
0.681
1.01
2.92
5.47
38.0
55.0
由此推出:水的电离过程是过程(填“吸热”或者“放热”),随着温度的升高,Kw的值(填“增大减小。
(2)、水中存在如下平衡:H2O+H2OH3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈碱性,可选择的方法是____(填字母)。A、向水中加入少量NaOH B、向水中加入少量NH4Cl固体 C、将水加热至100℃ D、在水中加入少量Na2CO3固体(3)、若用pH试纸测定100 ℃沸水,则试纸显色,pH7(填“>”“=”或“<”)。