高考二轮复习知识点:电离平衡常数2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下图是亚砷酸As(OH)3和酒石酸混合体系中部分物种的c-pH图(浓度:总As为 , 总T为)。下列说法错误的是( )
 A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为2. 常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为2. 常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中 , 当达到平衡时,下列叙述正确的是( )
A、溶液Ⅰ中 B、溶液Ⅱ中的的电离度为 C、溶液Ⅰ和Ⅱ中的不相等 D、溶液Ⅰ和Ⅱ中的之比为3. 室温下,用0.1mol·L-1的NaOH溶液滴定20mL0.1mol·L-1HA溶液,测得混合溶液的pH与的关系如图所示。下列说法正确的是 A、导电能力:a>b B、室温下,Ka(HA)=10-3.8 C、b点时,V(NaOH)=20mL D、c点时,c(A-)>c(Na+)4. 常温下,通过滴加KOH溶液改变0.10mol/LK2Cr2O7溶液的pH时,各种含铬元素粒子浓度变化如图所示。下列说法正确的是
A、导电能力:a>b B、室温下,Ka(HA)=10-3.8 C、b点时,V(NaOH)=20mL D、c点时,c(A-)>c(Na+)4. 常温下,通过滴加KOH溶液改变0.10mol/LK2Cr2O7溶液的pH时,各种含铬元素粒子浓度变化如图所示。下列说法正确的是 A、H2CrO4的K1=0.74 B、pH=4时,c( )>c()>c( )>c(H2CrO4) C、反应 + H2O 2 + 2H+的平衡常数K= 1× 10-13.2 D、B点溶液中c(K+ )>2c( )+3c()5. 25℃时,某二元弱碱M(OH)2的水溶液中含有M(OH)2、M(OH)+、M2+ , 它们的分布系数δ随溶液pH的变化曲线如图所示。Kb2为M(OH)2的第二步电离平衡常数,下列说法错误的是
A、H2CrO4的K1=0.74 B、pH=4时,c( )>c()>c( )>c(H2CrO4) C、反应 + H2O 2 + 2H+的平衡常数K= 1× 10-13.2 D、B点溶液中c(K+ )>2c( )+3c()5. 25℃时,某二元弱碱M(OH)2的水溶液中含有M(OH)2、M(OH)+、M2+ , 它们的分布系数δ随溶液pH的变化曲线如图所示。Kb2为M(OH)2的第二步电离平衡常数,下列说法错误的是 A、Kb2=1×10-5.5 B、曲线II代表的微粒为M(OH)+ C、m、n、p三点对应的水溶液中,m点水的电离程度最小 D、0.1 mol·L-1 M(OH)Cl溶液中:c(Cl-)>c[M(OH)2]>c(M2+)>c(OH- )> >c(H+)6. 常温下,向1升的NaClO溶液中缓慢通入气体,使其充分吸收,溶液pH与通入的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是
A、Kb2=1×10-5.5 B、曲线II代表的微粒为M(OH)+ C、m、n、p三点对应的水溶液中,m点水的电离程度最小 D、0.1 mol·L-1 M(OH)Cl溶液中:c(Cl-)>c[M(OH)2]>c(M2+)>c(OH- )> >c(H+)6. 常温下,向1升的NaClO溶液中缓慢通入气体,使其充分吸收,溶液pH与通入的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是 A、常温下,HClO电离平衡常数的数量级为 B、a点溶液中: C、b点溶液中: D、c点溶液中:7. 时,用溶液分别滴定、浓度均为的和溶液。滴定过程中,溶液的与(代表或 , HX代表或HB)的关系如图所示。下列说法正确的是
A、常温下,HClO电离平衡常数的数量级为 B、a点溶液中: C、b点溶液中: D、c点溶液中:7. 时,用溶液分别滴定、浓度均为的和溶液。滴定过程中,溶液的与(代表或 , HX代表或HB)的关系如图所示。下列说法正确的是 A、水的电离程度: B、的数量级为 C、滴定至点时,加入溶液的体积为 D、点和点的溶液中均存在8. 常温下,和溶液中含磷微粒的物质的量分数与溶液的关系分别如图所示,向等物质的量浓度的和混合溶液中加入适量的溶液,下列说法错误的是
A、水的电离程度: B、的数量级为 C、滴定至点时,加入溶液的体积为 D、点和点的溶液中均存在8. 常温下,和溶液中含磷微粒的物质的量分数与溶液的关系分别如图所示,向等物质的量浓度的和混合溶液中加入适量的溶液,下列说法错误的是 A、由图可知是二元酸 B、时, C、常温下,的反应平衡常数 D、溶液由3变为6.6的过程中,水的电离程度增大9. 常温下,向一定浓度的H3PO3(亚磷酸,
A、由图可知是二元酸 B、时, C、常温下,的反应平衡常数 D、溶液由3变为6.6的过程中,水的电离程度增大9. 常温下,向一定浓度的H3PO3(亚磷酸, )溶液中滴加一定浓度的NaOH溶液或H2SO4溶液,溶液中lg或lg随溶液的pH的变化关系如图所示。下列叙述正确的是
)溶液中滴加一定浓度的NaOH溶液或H2SO4溶液,溶液中lg或lg随溶液的pH的变化关系如图所示。下列叙述正确的是 A、直线b代表lg与pH的关系 B、Y点溶液的pH=4.5 C、2H++HPOH3PO3的平衡常数为108.1 D、pH=7时,c(Na+)>c(OH-)>c(HPO)>c(H2PO)10. H2R为某二元有机弱酸。常温下,在保持c(HR-) =0.01 mol·L-1的Na2R和NaHR的混合溶液中,若用pR、pH2R表示-lgc(R2-)、-lg c( H2R) ,则不同溶液中的pR或pH2R与pH的关系曲线如图所示。下列说法中正确的是
A、直线b代表lg与pH的关系 B、Y点溶液的pH=4.5 C、2H++HPOH3PO3的平衡常数为108.1 D、pH=7时,c(Na+)>c(OH-)>c(HPO)>c(H2PO)10. H2R为某二元有机弱酸。常温下,在保持c(HR-) =0.01 mol·L-1的Na2R和NaHR的混合溶液中,若用pR、pH2R表示-lgc(R2-)、-lg c( H2R) ,则不同溶液中的pR或pH2R与pH的关系曲线如图所示。下列说法中正确的是 A、XY所在的曲线是pR与pH的关系曲线 B、常温下,Ka2 (H2R)的数量级为10-5 C、Y点对应的pH =4.7 D、溶液中存在c(R2-) ·c(H2R) =10 -711. 下列由实验操作、现象所得结论正确的是
A、XY所在的曲线是pR与pH的关系曲线 B、常温下,Ka2 (H2R)的数量级为10-5 C、Y点对应的pH =4.7 D、溶液中存在c(R2-) ·c(H2R) =10 -711. 下列由实验操作、现象所得结论正确的是实验操作和现象
实验结论
A
将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去
铁锈中含有二价铁
B
用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变
CF2Cl2是极性分子
C
石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去
气体中含有乙烯
D
用pH计分别测0.1molL-1NaClO和CH3COONa溶液的pH,前者pH大
Ka(HClO)>Ka(CH3COOH)
A、A B、B C、C D、D12. 25℃时,某混合溶液中c(H2A) +c(HA-) +c(A2-) =0.01 mol/L,由水电离出的c水(H+) 的对数lgc水(H+ )与、的关系如图所示。下列说法正确的是 A、Ka1(H2A) =10-8 B、Z点时溶液的pH=7 C、M点和N点溶液的组成完全相同 D、从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O
A、Ka1(H2A) =10-8 B、Z点时溶液的pH=7 C、M点和N点溶液的组成完全相同 D、从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O二、多选题
-
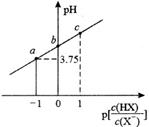
13. NaClO溶液具有添白能力,已知25℃时,。下列关于NaClO溶液说法正确的是( )A、0.01mol/L溶液中, B、长期露置在空气中,释放 , 漂白能力减弱 C、通入过量 , 反应的离子方程式为 D、25℃,的NaClO和HClO的混合溶液中,14. 室温下,向20.00mL0.1mol·L-1HX溶液中逐滴加0.1mol·L-1NaOH溶液。已知 ,溶液pH随 变化关系如图所示。下列说法错误的是( )
 A、当 =1时,溶液pH=5.75 B、当 =0时,加入NaOH溶液的体积大于10.00mL C、当加入10.00mLNaOH溶液时:c(H+)+c(HX)=c(Na+)+c(OH-) D、如图所示各点对应溶液中水电离出来的H+浓度:a>b>c15. 25℃时,甘氨酸在水中存在下列关系:+NH3CH2COOH +NH3CH2COO- NH2CH2COO- , 向10 mL 0.10 mol/L的+NH3CH2COOH溶液中滴加0.10 mol/L的NaOH溶液,溶液pH与所加NaOH溶液体积的关系如图所示。下列说法正确的是( )
A、当 =1时,溶液pH=5.75 B、当 =0时,加入NaOH溶液的体积大于10.00mL C、当加入10.00mLNaOH溶液时:c(H+)+c(HX)=c(Na+)+c(OH-) D、如图所示各点对应溶液中水电离出来的H+浓度:a>b>c15. 25℃时,甘氨酸在水中存在下列关系:+NH3CH2COOH +NH3CH2COO- NH2CH2COO- , 向10 mL 0.10 mol/L的+NH3CH2COOH溶液中滴加0.10 mol/L的NaOH溶液,溶液pH与所加NaOH溶液体积的关系如图所示。下列说法正确的是( ) A、K1的数量级为10-2 B、水的电离程度:a>b>c C、甘氨酸溶于水后显酸性 D、pH=7时,溶液中:c(+NH3CH2COO-)>c(NH2CH2COO-)>c(+NH3CH2COOH)16. 25℃时,用HCl气体调节0.1 mol·L-1氨水的pH,系统中微粒浓度的对数值(lgc)与pH的关系如图1所示,反应物的物质的量之比[ι= ]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是( )
A、K1的数量级为10-2 B、水的电离程度:a>b>c C、甘氨酸溶于水后显酸性 D、pH=7时,溶液中:c(+NH3CH2COO-)>c(NH2CH2COO-)>c(+NH3CH2COOH)16. 25℃时,用HCl气体调节0.1 mol·L-1氨水的pH,系统中微粒浓度的对数值(lgc)与pH的关系如图1所示,反应物的物质的量之比[ι= ]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是( ) A、P1所示溶液:c(Cl-)=0.05 mol·L-1 B、P2所示溶液:c(NH3·H2O)<c(OH-)+c(Cl-) C、P3所示溶液:c( )+c(NH3·H2O)=c(Cl-)+c(H+) D、25℃时,NH3·H2O的电离平衡常数为10-4.7517. 室温下,NH3·H2O的Kb=1.8×10-5 , H2SO3的Ka1=1.3×10-2 , Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )A、氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+) B、氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-) C、氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) D、氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O)18. 已知25℃时, 的 , ; 的 。则25℃时,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )A、溶液中: B、溶液中: C、等浓度、等体积的氨水和 溶液混合: D、0.6mol/L氨水和 溶液等体积混合:19. 室温下,通过下列实验探究草酸的性质.【已知:Ka1(H2C2O4)=5.6×10-2 , Ka2(H2C2O4)=1.5×10-4 , , , , 】
A、P1所示溶液:c(Cl-)=0.05 mol·L-1 B、P2所示溶液:c(NH3·H2O)<c(OH-)+c(Cl-) C、P3所示溶液:c( )+c(NH3·H2O)=c(Cl-)+c(H+) D、25℃时,NH3·H2O的电离平衡常数为10-4.7517. 室温下,NH3·H2O的Kb=1.8×10-5 , H2SO3的Ka1=1.3×10-2 , Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )A、氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+) B、氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-) C、氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) D、氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O)18. 已知25℃时, 的 , ; 的 。则25℃时,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )A、溶液中: B、溶液中: C、等浓度、等体积的氨水和 溶液混合: D、0.6mol/L氨水和 溶液等体积混合:19. 室温下,通过下列实验探究草酸的性质.【已知:Ka1(H2C2O4)=5.6×10-2 , Ka2(H2C2O4)=1.5×10-4 , , , , 】实验
实验操作和结果
1
向溶液中滴加溶液,测得小于7
2
向溶液中逐滴滴加溶液,测得
3
向溶液中逐滴滴加溶液,pH逐渐增大
4
向5 mL含有浓度均为0.01mol/L的Ag+和Ba2+的混合溶液中逐滴滴加实验3所得的溶液,有白色沉淀生成
下列有关说法正确的是( )
A、实验1所得溶液中离子浓度大小关系为 B、实验2得到的溶液中存在: C、实验3,当溶液中时,约为3.8 D、实验4中,产生的沉淀依次是Ag2C2O4、BaC2O420. 室温下,向10.00 mL0.1000 mol/LNaHCO3溶液中滴加0.1000 mol/L的盐酸,溶液的pH随加入的盐酸的体积V变化的曲线如图所示(已知室温下H2CO3的电离平衡常数: , 。忽略混合时溶液体积和温度的变化)。下列说法正确的是( ) A、a点时,对于反应 , 反应达到平衡状态时,平衡常数 B、b点溶液中的全部溶质为NaHCO3和NaCl C、c点溶液中,c(Na+)>c()>c(Cl-)>c(H+)>c(OH-) D、d点溶液中存在21. 用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
A、a点时,对于反应 , 反应达到平衡状态时,平衡常数 B、b点溶液中的全部溶质为NaHCO3和NaCl C、c点溶液中,c(Na+)>c()>c(Cl-)>c(H+)>c(OH-) D、d点溶液中存在21. 用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( ) A、Ka2(H2SO3)的数量级为10-2 B、若滴定到第一、二反应终点应该分别用甲基橙和酚酞作指示剂 C、图中溶液中水的电离程度:W<X<Y<Z<M D、图中Y点对应的溶液中:3c( )=c(Na+)+c(H+)-c(OH-)22. 肼(N2H4)为二元弱碱,在水中的电离方式与NH3相似。25℃时,水合肼(N2H4·H2O)的电离常数K1、K2依次为9.55×10-7、1.26×10-15。下列推测或叙述一定错误的是( )A、N2H4易溶于水和乙醇 B、N2H4分子中所有原子处于同一平面 C、N2H6Cl2溶液中:2c(N2H )+c(N2H )>c(Cl-)+c(OH-) D、25℃时,反应H++N2H4⇌N2H 的平衡常数K=9.55×107
A、Ka2(H2SO3)的数量级为10-2 B、若滴定到第一、二反应终点应该分别用甲基橙和酚酞作指示剂 C、图中溶液中水的电离程度:W<X<Y<Z<M D、图中Y点对应的溶液中:3c( )=c(Na+)+c(H+)-c(OH-)22. 肼(N2H4)为二元弱碱,在水中的电离方式与NH3相似。25℃时,水合肼(N2H4·H2O)的电离常数K1、K2依次为9.55×10-7、1.26×10-15。下列推测或叙述一定错误的是( )A、N2H4易溶于水和乙醇 B、N2H4分子中所有原子处于同一平面 C、N2H6Cl2溶液中:2c(N2H )+c(N2H )>c(Cl-)+c(OH-) D、25℃时,反应H++N2H4⇌N2H 的平衡常数K=9.55×107三、非选择题
-
23. 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物(L为配体)溶于弱碱性的海水中,制成吸收液,将气体转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①的吸收氧化;②的再生。反应原理如下:
①
②
回答下列问题:
(1)、该工艺的总反应方程式为。1mol 发生该反应的热量变化为 , 在总反应中的作用是。(2)、研究不同配体与所形成的配合物(A、B、C)对吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 , 测得单位体积吸收液中吸收转化率随时间变化的曲线如图1所示。以由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是(填“A”、“B”或“C”)。 (3)、的电离方程式为。25℃时,溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化关系如图2,由图2计算,的 , 。再生反应在常温下进行,解离出的易与溶液中的形成沉淀。若溶液中的 , , 为避免有FeS沉淀生成,应控制溶液pH不大于(已知25℃时,FeS的为)。
(3)、的电离方程式为。25℃时,溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化关系如图2,由图2计算,的 , 。再生反应在常温下进行,解离出的易与溶液中的形成沉淀。若溶液中的 , , 为避免有FeS沉淀生成,应控制溶液pH不大于(已知25℃时,FeS的为)。 24. 铬及其化合物在催化、金属防腐等方面具有重要应用。(1)、催化剂 可由 加热分解制备,反应同时生成无污染气体。
24. 铬及其化合物在催化、金属防腐等方面具有重要应用。(1)、催化剂 可由 加热分解制备,反应同时生成无污染气体。①完成化学方程式: 。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为(列式表示)。

③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路线(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为。
(2)、 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
(ⅱ)
①下列有关 溶液的说法正确的有。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时 与 的比值保持不变
② 时, 溶液中 随pH的变化关系如图2。当 时,设 、 与 的平衡浓度分别为x、y、z ,则x、y、z之间的关系式为 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。

③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关;在一定波长范围内,最大A对应的波长( )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、 不同的 稀溶液,测得其A随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是;溶液 从a变到b的过程中, 的值(填“增大”“减小”或“不变”)。
25. 国务院总理李克强在2021年国务院政府工作报告中指出,扎实做好碳达峰、碳中和各项工作,优化产业结构和能源结构,努力争取2060年前实现碳中和。碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:(1)、已知下列热化学方程式:i.CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3(g) ΔH=-133kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g) ΔH=-100kJ·mol-1
①写出相同条件下CH2=CHCH2Cl和HCl合成CH2ClCHClCH3的热化学方程式。
②已知①中的正反应的活化能E正为132kJ·mol-1 , 请在下图中标出①中逆反应的活化能E逆及数值。
 (2)、温度为T℃时向容积为2L的密闭容器中投入3molH2和1molCO2发生反应CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1 , 反应达到平衡时,测得放出热量19.76kJ,求平衡时:
(2)、温度为T℃时向容积为2L的密闭容器中投入3molH2和1molCO2发生反应CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1 , 反应达到平衡时,测得放出热量19.76kJ,求平衡时:①H2的转化率为
②T℃时该反应的平衡常数K=(列计算式表示)。
(3)、目前有Ni-CeO2催化CO2加H2形成CH4的反应,历程如图所示,吸附在催化剂表面的物种用*标注。
①写出上述转换中存在的主要反应的化学方程式。
②有人提出中间产物CO的处理,用反应2CO(g)=2C(s)+O2(g) ΔH>0来消除CO的污染,请用文字说明是否可行。
(4)、T℃,HCOOH与CH3COONa溶液反应:HCOOH+CH3COO-⇌HCOO-+CH3COOH,该反应的K=12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=(T℃时Ka(HCOOH)=2×10-4)。26. CO2的捕集、利用与封存成为科学家研究的重要课题。(1)、已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
则反应 3CO2(g)+CH4(g)=4CO(g)+2H2O(g)的ΔH3=kJ·mol-1。
(2)、探究反应 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应速率和平衡,向1L恒容密闭容器中通入CO2和CH4各1mol,测得CH4的平衡转化率与温度及压强的关系如图所示。
①CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH0(填“大于”或“小于”)。
②下列叙述能判断反应CO2(g)+CH4(g)=2CO(g)+2H2(g)达化学平衡状态的是。
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1 , 温度为1000℃时,反应经5min达平衡,用CO2表示的化学反应速率v(CO2)=;比较x点和y点的速率:xy(填“大于”“小于”或“等于”);压强p1P2(填“大于”“小于”或“等于”),原因是。
(3)、CO2可被 NaOH 溶液捕获,其所得溶液中c(HCO ):c(CO )=2:1,溶液pH=。(室温下,H2CO3的K1=4x10-7;K2=5x10-11)27. 汽车尾气和燃煤尾气是造成雾霾的主要原因之一、(1)、工业上利用甲烷催化还原 ,可减少氮氧化物的排放。已知:
甲烷直接将 还原为 的热化学方程式为。
(2)、减少汽车尾气污染的原理为 。向恒温恒容密闭容器中充入 和 ,用传感器测得的数据如下表所示:时间/s
0
1
2
3
4
9.00
4.00
2.00
1.00
1.00
9.00
4.00
2.00
1.00
1.00
①为了提高尾气处理的效果,可采取的措施有(写出一种即可)。
②此条件下达到平衡时,计算该反应的平衡常数 。
(3)、工业上用氢氧化钠溶液来同时吸收 和氮的氧化物气体( ),可得到 、 、 、 等溶液。(已知:常温下, 的电离常数为 , 的电离常数为 、 , 的水解常数为 )。①常温下,相同浓度的 、 溶液中pH较大的是溶液。
②常温下, 显性(填“酸”“碱”或“中”),判断的理由是: (通过计算说明)。
(4)、铈元素( )常见有 、 两种价态。 可以被含 的溶液吸收,生成 , (二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的 转化为无毒物质,同时再生 ,其原理如图所示。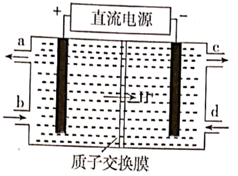
① 从电解槽的(填字母代号)口流出。
②写出阴极的电极反应式:。
28. CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:(1)、汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式。
(2)、若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1 , 若反应达到平衡时,所得的混合气体中含N2的体积分数随 的变化曲线如图1。
①a、b、c、d四点的平衡常数从大到小的顺序为。
②若 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为。
(3)、若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为 , 经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为 NA。(4)、常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为(用含a的式子表示)。29. 马日夫盐 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为 及少量的FeO、 和 )为原料制备马日夫盐的主要工艺流程如图: (1)、“浸锰”过程中,FeO参与氧化还原反应的离子方程式为。(2)、 的萃取率与溶液的pH的关系如图所示,当 时, 的萃取率急剧下降的原因可能为(用化学用语表示)。
(1)、“浸锰”过程中,FeO参与氧化还原反应的离子方程式为。(2)、 的萃取率与溶液的pH的关系如图所示,当 时, 的萃取率急剧下降的原因可能为(用化学用语表示)。 (3)、“调pH”的最大范围为。
(3)、“调pH”的最大范围为。金属离子
开始沉淀的pH
完全沉淀的pH
l. 8
3.2
3.0
5.0
5.8
8.8
7.8
9.8
(4)、如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备 ,需要控制温度在80℃~90℃之间的原因是 , 采用水浴加热,经蒸发浓缩、(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。 (5)、写出检验“沉锰”是否已完成的实验操作。(6)、常温下,马日夫盐溶液显性(填“酸”或“碱”),理由是:。(写出计算过程并结合必要的文字说明。已知: 的电离常数 , , )30. 常温下,以酚酞为指示剂,用的溶液滴定未知浓度溶液。溶液和微粒分布系数随滴加溶液体积的变化关系如下图所示。
(5)、写出检验“沉锰”是否已完成的实验操作。(6)、常温下,马日夫盐溶液显性(填“酸”或“碱”),理由是:。(写出计算过程并结合必要的文字说明。已知: 的电离常数 , , )30. 常温下,以酚酞为指示剂,用的溶液滴定未知浓度溶液。溶液和微粒分布系数随滴加溶液体积的变化关系如下图所示。

已知:ⅰ.二元酸在水中的电离方程式是: , 。
ⅱ.的分布系数
(1)、滴定时,的溶液装入滴定管中(填“a”或“b”)。(2)、实验测得,溶液的浓度为。(3)、曲线①代表(填“”、“”或“”)。(4)、常温下的电离平衡常数。(5)、当时,下列正确的是(填字母)。a.溶液为红色
b.
c.
d.
(6)、下列情况会造成测定结果偏高的是(填字母)。a.盛装溶液的滴定管,未用溶液润洗
b.盛装溶液的锥形瓶,用蒸馏水洗过后未用溶液润洗
c.盛装溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失
d.滴定终点读数时,俯视滴定管的刻度
31. 常温下,有浓度均为0.1 mol·L-1的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN
H2CO3
CH3COOH
Ka=4.9×10-10
Ka1=4×10-7
Ka2=5.6×10-11
Ka=1.7×10-5
(1)、这4种溶液pH由大到小的顺序是(填标号),其中②由水电离的H+浓度为mol/L。(2)、①中各离子浓度由大到小的顺序是。(3)、④的水解平衡常数Kh=。(4)、若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③④(填“>”“<”或“=”)。(5)、25 ℃时,测得HCN和NaCN的混合溶液的pH=11,则约为。向NaCN溶液中通入少量CO2 , 则发生反应的离子方程式为。32. 电解质水溶液中存在电离平衡、水解平衡,回答下列问题弱电解质
(甲酸)
(氰化氢)
(草酸)
电离平衡常数
(1)、写出的的表达式。(2)、向等体积、等的草酸和甲酸溶液中加入大小相同的锌粒,初始速率分别是、 , 其大小关系为(填“>”“<”或“=”)。(3)、稀释溶液(填“增大”“减小”或“不变”)。(4)、溶液显性(填“酸”“碱”或“中”)。(5)、向溶液中滴加过量的甲酸溶液,反应的离子方程式为。33. 工业上将石灰石和含硫煤混合使用,称之为“固硫”,其反应原理: 。已知: ;
。
回答下列问题:
(1)、 (用含x、y、z的式子表示)。(2)、℃时,向某恒容密闭容器中通入一定量的和足量CaO发生反应: , 的浓度随时间变化如下图所示:
则0~8min,用表示该反应速率为。
(3)、℃时,向2L的恒容密闭容器中通入和发生反应: , 达平衡时的体积分数为40%,则的转化率为 , ℃时该反应的平衡常数。(4)、已知:常温下,亚硫酸()在水中的电离平衡常数 , 。用离子方程式解释亚硫酸钠溶液呈碱性的原因: , 通过计算得出亚硫酸根第一步水解的平衡常数。34. H与O可以形成和两种化合物。请回答:(1)、可与形成 , 的空间构型名称为。根据的成键特点,画出与下图中分子直接相连的所有氢键 (用O—H…O表示)。 (2)、分子结构如图所示,、、中相等的角是 , 是分子(填“极性”或“非极性”)。晶体中有4种作用力:①键、②键、③范德华力、④氢键,这4种作用力由强到弱依次为:。
(2)、分子结构如图所示,、、中相等的角是 , 是分子(填“极性”或“非极性”)。晶体中有4种作用力:①键、②键、③范德华力、④氢键,这4种作用力由强到弱依次为:。 (3)、哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是____A、 B、 C、 D、 E、(4)、实验测得,25℃时的小于的 , 原因是(运用物质结构原理解释)。35. 用NaOH标准液滴定未知浓度的H2A溶液,其操作步骤如下:
(3)、哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是____A、 B、 C、 D、 E、(4)、实验测得,25℃时的小于的 , 原因是(运用物质结构原理解释)。35. 用NaOH标准液滴定未知浓度的H2A溶液,其操作步骤如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满溶液;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的未干燥的锥形瓶中,加入2滴指示剂溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)、以上操作步骤有不正确的是(填数字序号)。下列操作中,能造成中和滴定的测定结果偏高的有(填字母序号)。a.配制标准溶液的固体NaOH中混有KOH杂质
b.中和滴定到达终点时俯视滴定管内液面读数
c.振荡时锥形瓶中溶液飞溅出来
d.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)、某同学在滴定实验中,碱式滴定管中的液面如图所示。侧消耗的NaOH溶液的体积为mL。 (3)、常温下向0.2000 mol/L二元酸H2A溶液中滴加0.2000 mol/L NaOH溶液。溶液中H2A、HA-、A2-的物质的量分数()随溶液pH的变化关系如图所示。
(3)、常温下向0.2000 mol/L二元酸H2A溶液中滴加0.2000 mol/L NaOH溶液。溶液中H2A、HA-、A2-的物质的量分数()随溶液pH的变化关系如图所示。
①列说法正确的是(填字母序号)。
A.该滴定过程若选择单一指示剂最好选择甲基橙
B.当V(NaOH)=V(H2A)时,溶液中存在:
C.pH=6.27时,c(HA-)=c(A2-)>c(H+)>c(OH-)
D.V(NaOH):V(H2A)=3:2时,
②常温下H2A的电离平衡常数Ka1=。
③当pH=6时mol/L。
④滴加至a、b、c三个交点处,溶液中水的电离程度由大到小依次为(用字母排序)。
36. 已知常温下部分弱电解质的电离平衡常数如表:化学式
HF
HClO
H2CO3
NH3·H2O
电离常数
6.8×10-4
4.7×10-8
K1=4.3×10-7
K2=5.6×10-11
Kb=1.7×10-5
(1)、常温下,物质的量溶度相同的三种物质的量浓度①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是(填序号)。(2)、25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为。(3)、NaClO溶液中的电荷守恒关系为。(4)、向NaClO溶液中通入少量的CO2 , 所发生的离子方程式为。(5)、25℃下,将的苛性钠溶液与的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 , 则。(6)、25℃时,H2SO3⇌H++HSO的电离常数 , 则该温度下的水解常数Kh=。