高考二轮复习知识点:弱电解质在水溶液中的电离平衡2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
 A、海水酸化能引起 浓度增大、 浓度减小 B、海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 C、CO2能引起海水酸化,其原理为
A、海水酸化能引起 浓度增大、 浓度减小 B、海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 C、CO2能引起海水酸化,其原理为 H++
D、使用太阳能、氢能等新能源可改善珊瑚的生存环境
2. 以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数: ]
H++
D、使用太阳能、氢能等新能源可改善珊瑚的生存环境
2. 以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数: ]
下列叙述正确的是( )
A、曲线①代表 ,曲线②代表 B、H2A溶液的浓度为0.2000 mol·L−1 C、HA−的电离常数Ka=1.0×10−2 D、滴定终点时,溶液中3. 某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( ) A、曲线Ⅰ代表 溶液 B、溶液中水的电离程度:b点>c点 C、从c点到d点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子) D、相同体积a点的两溶液分别与 恰好中和后,溶液中 相同4.
A、曲线Ⅰ代表 溶液 B、溶液中水的电离程度:b点>c点 C、从c点到d点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子) D、相同体积a点的两溶液分别与 恰好中和后,溶液中 相同4.改变0.1mol•L﹣1二元弱酸H2A溶液的pH,溶液中的H2A、HA﹣、A2﹣的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)= ].下列叙述错误的是( )
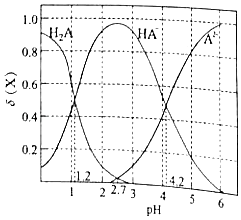 A、pH=1.2时,c(H2A)=c(HA﹣) B、pH=4.2时,lg[K2(H2A)]=﹣4.2 C、pH=2.7时,c(HA﹣)>c(H2A)=c(A2﹣) D、pH=4.2时,c(HA﹣)=c(A2﹣)=c(H2A)5. 已知: Ag+ +NH3 [Ag(NH3)]+ K1=103.32
A、pH=1.2时,c(H2A)=c(HA﹣) B、pH=4.2时,lg[K2(H2A)]=﹣4.2 C、pH=2.7时,c(HA﹣)>c(H2A)=c(A2﹣) D、pH=4.2时,c(HA﹣)=c(A2﹣)=c(H2A)5. 已知: Ag+ +NH3 [Ag(NH3)]+ K1=103.32[Ag(NH3)]++NH3 [Ag(NH3)2]+ K2
Ag+、[Ag(NH3)]+、 [Ag(NH3)2]+ 的分布分数δ与lgc(NH3 )关系如下图所示,下列说法正确的是{例如:分布分数δ(Ag+)=}
 A、曲线c代表[Ag(NH3)2]+ B、K2=10-3.61 C、[Ag(NH3)2]+Ag++ 2NH3平衡常数K' =10-7.22 D、当c(NH3 )<0.01 mol/L时,c [Ag(NH3)2]+> c [Ag(NH3)]+>c(Ag+)6. 的水溶液呈碱性,其电离方程式可表示为 , 。常温下。用的水溶液滴定盐酸,滴定过程中三种含氮微粒的物质的量分布分数与溶液pH的关系如图所示,下列说法错误的是
A、曲线c代表[Ag(NH3)2]+ B、K2=10-3.61 C、[Ag(NH3)2]+Ag++ 2NH3平衡常数K' =10-7.22 D、当c(NH3 )<0.01 mol/L时,c [Ag(NH3)2]+> c [Ag(NH3)]+>c(Ag+)6. 的水溶液呈碱性,其电离方程式可表示为 , 。常温下。用的水溶液滴定盐酸,滴定过程中三种含氮微粒的物质的量分布分数与溶液pH的关系如图所示,下列说法错误的是 A、曲线I代表的微粒是 B、pH=7时, C、 D、b点时溶液中存在:7. 室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是
A、曲线I代表的微粒是 B、pH=7时, C、 D、b点时溶液中存在:7. 室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是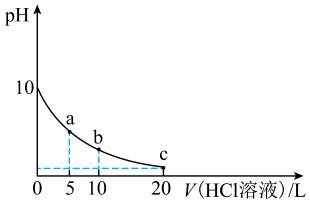 A、室温下,H2A的Ka2≈2.0 ×10-6 B、b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- ) C、a、b、c点溶液中水的电离程度:a<b<c D、a、b、c三点溶液均存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ )8. 牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
A、室温下,H2A的Ka2≈2.0 ×10-6 B、b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- ) C、a、b、c点溶液中水的电离程度:a<b<c D、a、b、c三点溶液均存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ )8. 牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:物质
或
下列说法正确的是
A、溶解的离子方程式为: B、牙膏中经常添加碳酸钙,主要是为了增加Ca2+浓度,抑制牙齿腐蚀 C、当时,可与反应转化为 D、向牙膏中添加NaHCO3、NaF均可增强护齿效果,两者原理相同9. 室温下,甲、乙两烧杯均盛有20mLpH=4的醋酸溶液,向乙烧杯中加水稀释至pH=5,对此时两烧杯中溶液描述正确的是A、溶液体积:10V甲>V乙 B、水电离出的H+浓度:c(H+)甲=10c(H+)乙 C、若分别用pH=10的NaOH溶液恰好完全中和,所得溶液的pH:甲>乙 D、若分别与10mLpH=10的NaOH溶液反应,所得溶液的pH:甲>乙10. 在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是A、中和时所需NaOH的量 B、溶液的导电能力 C、H+的物质的量 D、CH3COOH的物质的量11. 如图为某实验测得溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法错误的是 A、ab段,随温度升高而增大 B、a点溶液和d点溶液的相同 C、a点时, D、bc段可能发生反应:12. 将溶液与0.1mol/LHCl溶液等体积混合(忽略温度变化),下列说法正确的是A、混合溶液中 B、混合后的水解常数增大 C、混合溶液中 D、混合后加入适量固体,的电离平衡向右移动13. H3PO3是制造塑料稳定剂的原料。常温下,向100mL0.5mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中所有含磷微粒的物质的量分数(δ)与溶液pOH[pOH=-lgc(OH-)]的关系如图所示。下列说法错误的是
A、ab段,随温度升高而增大 B、a点溶液和d点溶液的相同 C、a点时, D、bc段可能发生反应:12. 将溶液与0.1mol/LHCl溶液等体积混合(忽略温度变化),下列说法正确的是A、混合溶液中 B、混合后的水解常数增大 C、混合溶液中 D、混合后加入适量固体,的电离平衡向右移动13. H3PO3是制造塑料稳定剂的原料。常温下,向100mL0.5mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中所有含磷微粒的物质的量分数(δ)与溶液pOH[pOH=-lgc(OH-)]的关系如图所示。下列说法错误的是 A、H3PO3的结构简式为
A、H3PO3的结构简式为 B、a点水电离出的c(OH-)=1×10-7.4mol·L-1
C、当pH=4时,c(HPO)=c(H3PO3)
D、b点时加入NaOH溶液的体积为50mL
14. 时,向柠檬酸三钠溶液中滴加的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知:柠檬酸(分子式为 , 其结构简式为
B、a点水电离出的c(OH-)=1×10-7.4mol·L-1
C、当pH=4时,c(HPO)=c(H3PO3)
D、b点时加入NaOH溶液的体积为50mL
14. 时,向柠檬酸三钠溶液中滴加的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知:柠檬酸(分子式为 , 其结构简式为 )属于三元弱酸,其电离平衡常数的。下列说法错误的是
)属于三元弱酸,其电离平衡常数的。下列说法错误的是 A、a点时溶液中的数量级为 B、b点溶液显酸性 C、c点溶液满足: D、时,溶液满足:
A、a点时溶液中的数量级为 B、b点溶液显酸性 C、c点溶液满足: D、时,溶液满足:二、多选题
-
15. 25℃时,某混合溶液中 ,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
 A、O点时, B、N点时, C、该体系中, D、pH由7到14的变化过程中, CH3COO-的水解程度始终增大16. 25℃时,向10.00mL0.1000mol/L的NaHCO3溶液中滴加0.1000mol/L的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法错误的是( )
A、O点时, B、N点时, C、该体系中, D、pH由7到14的变化过程中, CH3COO-的水解程度始终增大16. 25℃时,向10.00mL0.1000mol/L的NaHCO3溶液中滴加0.1000mol/L的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法错误的是( ) A、a点,溶液pH>7是由于水解程度大于电离程度 B、b点,c(Na+)=c()+c()+c(Cl−) C、c点,溶液中H+的主要来自的电离 D、d点,c(Na+)= c(Cl−)=0.0500mol/L17. 室温下,某混合溶液中c(M+) +c(MOH) =c(R-) +c(HR) ,和随pH变化关系如图所示,已知pX = -lg X。下列说法错误的是( )
A、a点,溶液pH>7是由于水解程度大于电离程度 B、b点,c(Na+)=c()+c()+c(Cl−) C、c点,溶液中H+的主要来自的电离 D、d点,c(Na+)= c(Cl−)=0.0500mol/L17. 室温下,某混合溶液中c(M+) +c(MOH) =c(R-) +c(HR) ,和随pH变化关系如图所示,已知pX = -lg X。下列说法错误的是( ) A、曲线I表示与pH关系曲线,pKa=pKb +2 B、b点溶液中c(M+) >c(R-),x= - 2 C、MR溶液显碱性,且MR溶液溶液中c(MOH) <c( HR) D、等物质的量的NaR与HR混合溶液中,c(HR) >c(Na+) >c(R-) >c(OH-) >c(H+)18. CH3NH2·H2O为一元弱碱,常温下,将HCl气体通入0.1mol/LCH3NH2·H2O水溶液中,混合溶液中pH与微粒浓度的对数值(lgc)的关系如图所示(忽略溶液体积的变化)。下列说法正确的是( )
A、曲线I表示与pH关系曲线,pKa=pKb +2 B、b点溶液中c(M+) >c(R-),x= - 2 C、MR溶液显碱性,且MR溶液溶液中c(MOH) <c( HR) D、等物质的量的NaR与HR混合溶液中,c(HR) >c(Na+) >c(R-) >c(OH-) >c(H+)18. CH3NH2·H2O为一元弱碱,常温下,将HCl气体通入0.1mol/LCH3NH2·H2O水溶液中,混合溶液中pH与微粒浓度的对数值(lgc)的关系如图所示(忽略溶液体积的变化)。下列说法正确的是( ) A、Kb(CH3NH2·H2O)的数量级为10-4 B、该体系中,c(OH-)= mol/L C、P点,c(Cl-)+c(CH3NH )+c(CH3NH2·H2O)=0.2mol/L D、P点之后,溶液中可能存在c(Cl-)+c(OH-)=2c(CH3NH )19. 常温下,2-戊烯酸(CH3CH2CH=CHCOOH)溶液中含碳粒子分布系数(δ)与溶液pH的关系如图1,向20mL 0. 1 mol· L-12-戊烯酸溶液中滴加0.1 mol·L-1的NaOH溶液,溶液pH与滴入NaOH溶液体积的关系如图2。已知:δ(CH3CH2CH =CHCOOH)=
A、Kb(CH3NH2·H2O)的数量级为10-4 B、该体系中,c(OH-)= mol/L C、P点,c(Cl-)+c(CH3NH )+c(CH3NH2·H2O)=0.2mol/L D、P点之后,溶液中可能存在c(Cl-)+c(OH-)=2c(CH3NH )19. 常温下,2-戊烯酸(CH3CH2CH=CHCOOH)溶液中含碳粒子分布系数(δ)与溶液pH的关系如图1,向20mL 0. 1 mol· L-12-戊烯酸溶液中滴加0.1 mol·L-1的NaOH溶液,溶液pH与滴入NaOH溶液体积的关系如图2。已知:δ(CH3CH2CH =CHCOOH)=
下列说法错误的是( )
A、图1中,曲线I表示的粒子是CH3CH2CH= CHCOO- B、图2中,①对应溶液的溶质为2-戊烯酸和2-戊烯酸钠,此时溶液的pH=4. 7, C、图2中,②对应的溶液中存在:c(Na+ )=c(CH3CH2CH=CHCOO- )>c(CH3CH2CH=CHCOOH) D、图2中,③对应的溶液中存在:c(OH- )=c(H+ )+c(CH3CH2CH=CHCOOH)20. 25℃时,向1L某缓冲溶液(含0.1mol·L-1CH3COOH、0.08mol·L-1CH3COONa)和1L0.1mol·L-1CH3COOH溶液中加入NaOH(s)或通入HCl(g),两种溶液的pH变化如图所示(不考虑溶液体积变化)。已知缓冲溶液pH=pKa-lg , 下列说法正确的是( ) A、曲线①对应的溶液是缓冲溶液 B、25℃时醋酸的电离常数的数量级为10-5 C、a点溶液中离子浓度的大小关系为c(CH3COO-)=c(CH3COOH)>c(H+)>c(OH-) D、b点溶液存在:4c(CH3COOH)+9c(H+)=9c(Cl-)+9c(OH-)+5c(CH3COO-)21. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。常温下,利用盐酸滴定某溶液中亚磷酸钠()的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是( )
A、曲线①对应的溶液是缓冲溶液 B、25℃时醋酸的电离常数的数量级为10-5 C、a点溶液中离子浓度的大小关系为c(CH3COO-)=c(CH3COOH)>c(H+)>c(OH-) D、b点溶液存在:4c(CH3COOH)+9c(H+)=9c(Cl-)+9c(OH-)+5c(CH3COO-)21. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。常温下,利用盐酸滴定某溶液中亚磷酸钠()的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是( )
已知:亚磷酸()是二元弱酸,电离常数 , 。
A、a点对应的溶液呈弱碱性 B、水的电离程度:a点大于b点 C、a点对应的溶液中存在: D、b点对应的溶液中存在:22. 相同温度和压强下,研究氯气分别在不同浓度的盐酸和氯化钠溶液中的溶解情况,实验测得氯气的饱和浓度c(Cl2)与盐酸和氯化钠溶液的浓度关系如图所示。
已知:氯气溶解过程发生如下反应:
①Cl2(aq)+H2O(l)H+(aq)+Cl-(ag)+HClO(aq)K1=4.2×10-4
②Cl2(aq)+Cl-(aq)Cl(aq)K2=0.19
③HClO(aq)H+(aq)+ClO-(aq)Ka=3.2×10-8
下列说法正确的是( )
A、a点溶液中存在:c(H+)>c(Cl-)>c(Cl)>c(ClO-) B、b点溶液中存在:c(HClO)+c(ClO-)+c(Na+)=c(Cl-)+c(Cl) C、由对比实验得出Cl-对Cl2的溶解存在较大的抑制作用 D、NaCl曲线中,随着Cl2溶解度的减小,溶液中减小23. 化学上把由浓度相对较大的弱酸(弱碱)及其相应的盐组成的溶液,外加少量酸、碱而pH基本不变,称为缓冲溶液。弱酸及其盐组成的缓冲溶液的 。现有25℃时,浓度均为0.10mol·L-1的CH3COOH和CH3COONa的缓冲溶液 。下列有关说法正确的是( )A、将该缓冲溶液加水稀释100倍,溶液的pH基本不变 B、该缓冲溶液的pH=4.76 C、该缓冲溶液中离子浓度大小顺序是: D、人体血液存在H2CO3(CO2)和NaHCO3的缓冲溶液,可除掉人体代谢产生的酸、碱,保持pH基本不变24. 研究多元酸碱反应的分步过程可借助于pH曲线。向 溶液中逐滴滴加 某二元酸H2B溶液,得溶液pH随加入的H2B体积 的变化如图所示。已知:H2CO3的 , 下列说法错误的是( ) A、该曲线有两处pH突变,突变分别出现在V=5mL和V=20mL处 B、 在0~5mL区间,发生的反应是 C、 D、 在5~20mL区间,HB-的物质的量一直在增加25. 常温下,向20.00mL0.10mol·L-1的HA溶液中滴加0.10mol·L-1的NaOH溶液,溶液中的p (pX=-lgX)随pH的变化关系如图所示(已知lg5=0.7)。下列说法正确的是( )
A、该曲线有两处pH突变,突变分别出现在V=5mL和V=20mL处 B、 在0~5mL区间,发生的反应是 C、 D、 在5~20mL区间,HB-的物质的量一直在增加25. 常温下,向20.00mL0.10mol·L-1的HA溶液中滴加0.10mol·L-1的NaOH溶液,溶液中的p (pX=-lgX)随pH的变化关系如图所示(已知lg5=0.7)。下列说法正确的是( ) A、常温下,HA的电离常数的数量级为10-5 B、图中a点的Y值为3.4 C、溶液中水的电离程度:a>b>c D、若d点加入的NaOH溶液的体积为20.00mL,则Q约为8.7
A、常温下,HA的电离常数的数量级为10-5 B、图中a点的Y值为3.4 C、溶液中水的电离程度:a>b>c D、若d点加入的NaOH溶液的体积为20.00mL,则Q约为8.7三、非选择题
-
26. 沉降法和吸附法是去除水体中砷(As)污染的有效措施,并可以实现As2O3的回收提取,流程见图:
 (1)、参考图1与图2,将废水pH调节至8.0时,其中所含三价砷和五价砷的最主要微粒分别是、。H3AsO4的pKa1=-lgKa1=(具体数值)。
(1)、参考图1与图2,将废水pH调节至8.0时,其中所含三价砷和五价砷的最主要微粒分别是、。H3AsO4的pKa1=-lgKa1=(具体数值)。
注:物种分布分数为各物种占其总和的比例
(2)、通入空气的目的是。(3)、溶液pH对吸附剂A表面所带电荷情况的影响如表:pH范围
<7.2
=7.2
>7.2
吸附剂A表面
带正电荷
不带电荷
带负电荷
在pH=4~7之间,吸附剂A对水中三价砷的去除能力(填“强于”或“弱于”)五价砷的,原因是。
(4)、“SO2还原”产生了粗As2O3中的微溶杂质,它是。用离子方程式表示其产生过程为。27. 2020年9月科学家发现金星上有磷化氢( ),实验室制备 的常用方法有两种:①
②
完成下列填空:
(1)、P核外能量最高的电子具有相同的___________(填写序号)。A、轨道 B、自旋方向 C、电子云形状 D、电子云伸展反应(2)、已知 与 的结构相似, 的空间结构是。 的分解温度比 (填“高”、“低”),判断的依据是。(3)、已知 为三元酸,其结构式为: 。
。
①次磷酸( 中的P的成键情况与 中的相同,则 的结构式是。
②利用反应②制备 时,即使KOH过量,仍只生成 ,说明 是元酸。
(4)、常温下, 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
①电离平衡常数与化学平衡常数意义相同,写出 第二步电离平衡常数表达式 。
(5)、图中可推断 溶液呈(填“酸”、“碱”、“中”)性,可能的原因是。 溶液中各含磷微粒以及 按浓度由大到小的顺序排列。28. 锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分为ZnO、ZnCl2 , 还含有SiO2、CuO、PbO和FeO。工业上利用锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
已知:Cu++Cl-=CuCl↓。回答下列问题:
(1)、酸浸时,H2SO4应选用(填“浓硫酸”或“稀硫酸”)。(2)、滤渣1的主要成分有。(3)、写出“沉铜”时的离子方程式:。(4)、“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是。(5)、氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH) 离子,每溶解1molZnO需消耗molKOH。电解池中的总反应离子方程式为。 (6)、该工艺废水中含有Zn2+ , 排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为
(6)、该工艺废水中含有Zn2+ , 排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为微粒
H2S
CH3COOH
CH3COO-
浓度/(mol·L-1)
0.10
0.05
0.10
处理后的废水的pH= , c(Zn2+)=。[已知:Ksp(ZnS)=1.0×10-23 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=1.0×10-14 , Ka(CH3COOH)=2.0×10-5]
29. 高纯度的氢氟酸是制造芯片的重要原料之一。(1)、已知:HF(aq)⇌H+(aq)+F-(aq) ΔH=-10.4kJ/molH+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
则:HF(aq)+NaOH(aq)=NaF(aq)+H2O(l)的ΔH=。
(2)、HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是 , 写出(HF)2发生第二步电离的电离方程式。(3)、如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。
若固定隔板于“5”处,当右侧容器内反应2HF(g)⇌(HF)2(g)达到平衡状态时,右侧容器内压强为P1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器内压强为P2 , 则P1P2(填“大于”“小于”或“等于”)。该温度下,2HF(g)⇌(HF)2(g)反应的平衡常数KP=kPa-1(KP为以分压表示的平衡常数,计算结果保留2位有效数字)。
(4)、若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平衡状态的是_______。A、容器右侧气体的密度不再改变 B、容器右侧的温度不再改变 C、容器右侧气体的压强不再改变 D、容器右侧气体的平均相对分子质量不再改变 E、(5)、某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀释时,溶液pH变化如图所示。
图中,氢氟酸溶液在稀释初期的pH上升特别快,据此判断,(HF)2与HF的酸性相比,较强的是。
(6)、NaF和HF的混合溶液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保持不变。试结合方程式和必要的文字解释之。30. CO2是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。回答下列问题:(1)、碱液吸收。用NaOH溶液捕获CO2 , 若所得溶液中c( )∶c( )=2∶1,则溶液pH=。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)。(2)、催化转化。以CO2、H2为原料在催化剂作用下合成CH3OH涉及的主要反应如下,答下列问题:Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5kJ/mol
Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4kJ/mol
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
①ΔH3=kJ/mol。
②一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,经tmin达到平衡时,容器中CH3OH(g)为amol,CO为bmol,这段时间内以H2O(g)表示的化学反应速率为mol∙L-1∙min-1(用含a、b、V、t的代数式表示)。
③不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度(T)的变化关系如下图所示。

其中纵坐标表示CH3OH的平衡产率的是(填“X”或“Y”);压强p1、p2、p3由大到小的顺序为;温度高于T1时,Y几乎相等的原因是。
④为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为(填标号)。
A.低温、低压 B.高温、高压 C.低温、高压 D.高温、低压
(3)、电解转化。电解CO2制得甲酸盐(HCOO-)的原理示意图如下。
①写出阴极的电极反应式
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
31. 硫及其化合物在工农业生产中有广泛的应用,请按要求回答下列问题。(1)、SCl2常做消毒剂,根据下列化学键的键能及S4的结构式:化学键
S—S
S—Cl
Cl—Cl
键能/(kJ•mol-1)
266
255
243

则反应S4(g)+4Cl2(g)=4SCl2(g)△H=kJ•mol-1。
(2)、S2Cl2常用作橡胶工业的硫化剂,其分子空间结构如图。两个Cl原子犹如在半张开的书的两面上,由此可知它属于分子(填“极性”或“非极性”)。且已知它易与水反应,产生无色有刺激性气味的气体,同时生成淡黄色沉淀,则该反应的化学方程式。 (3)、工业上制取SCl2的反应之一为S2Cl2(g)+Cl2(g)=2SCl2(g)△H<0。一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2发生上述反应,Cl2与SCl2的消耗速率与温度的关系如图所示。
(3)、工业上制取SCl2的反应之一为S2Cl2(g)+Cl2(g)=2SCl2(g)△H<0。一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2发生上述反应,Cl2与SCl2的消耗速率与温度的关系如图所示。
①A、B、C、D四点对应状态下,达到平衡状态的有(填字母),理由是 。
②提高SCl2产率可采取措施有(写出一项即可)。
③若某温度下,反应达到平衡时S2Cl2的转化率为x,则化学平衡常数K=(用含x的代数式表示)。
(4)、向含Zn2+的废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S ZnS(s)+2H+。处理后的废水中部分微粒浓度为:微粒
H2S
CH3COOH
CH3COO-
浓度(mol•L-1)
0.10
0.05
0.10
处理后的废水的pH= , c(Zn2+)=。[已知:Ksp(ZnS)=1.0×10-23 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=1.0×10-14 , Ka(CH3COOH)=2.0×10-5。
32. 某实验小组探究盐溶液对弱电解质的电离及难溶电解质的溶解的影响。文献指出:向弱电解质或难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使弱电解质的电离程度或难溶电解质的溶解度增大,这种现象可称为“盐效应”。
(1)、对弱电解质Fe(SCN)3的电离的影响。
资料:i.等浓度的MgSO4与FeSO4的盐效应相当。
ii.Fe2++2SCN-⇌Fe(SCN)2(无色);Mg2+与SCN-不反应。
①加入0.5mLH2O的目的是。
②对比a、b中的现象,得出的结论是。
③结合化学平衡移动原理解释c中红色比b浅的原因:。
(2)、对难溶电解质FeCO3的溶解性的影响。ⅰ

ⅱ

资料:等浓度的KCl与KSCN的盐效应相当。
对比实验ⅰ、ⅱ,对于ⅱ中溶液为红色,提出假设:
A.……
B.溶液中的SCN-与Fe2+结合,促进FeCO3的溶解。
设计对比实验ⅲ,证实假设B是主要原因。
①假设A是。
②对比实验ⅲ的步骤和现象:(按实验ⅱ的图示方式呈现)。
(3)、通过以上实验,说明该实验条件下盐溶液通过、可促进弱电解质的电离及难溶电解质的溶解。33. 机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) ∆H=-akJ·mol-1(1)、CO可用于炼铁,已知:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为
(2)、在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。
0~20 min CO2的平均速率v(CO2)= , CO的转化率为
(3)、下列能够说明该反应已经达到平衡的是a.该容器内压强不再改变
b.上述反应的焓变∆H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)、若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为(结果保留两位有效数字)(5)、利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为(6)、工业上用氨水将SO2转化为(NH4)2SO3 , 再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。34. 维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。(1)、常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。试剂
pH
初始
通入0.01 mol HCl气体
加入0.01 mol NaOH固体
i.1 L H2O
7
a
12
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液
4.76
4.67
4.85
①a=(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:。
③试剂ii中微粒浓度关系正确的有(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)、缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
Zn+2VOSO4+2H2SO4 ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)(填“增大”“减小”或“不变”),结合化学用语说明理由:。
②充电时,A室中的c(H+)变化缓慢的原因是。
35. 对烟道气中的SO2进行吸收或回收再利用具有一定的社会和经济价值。请回答下列问题:
(1)、用NaOH溶液吸收SO2 , 写出相关反应的离子方程式。(2)、已知NaHSO3溶液显酸性,比较NaHSO3溶液中c(H2SO3) c(SO32-)(填“>”“<”或“=”),请简述判断理由。烟道气中的SO2 , 也可通过如下反应回收硫:2CO(g)+SO2(g) S(s)+2CO2(g) + Q kJ。某温度下,在2 L恒容密闭容器中通入2 mol SO2和一定量的CO,发生上述反应,5 min后达到平衡,生成1 mol CO2。
(3)、一定条件下,上述反应的能量变化如图1,则 Q =kJ。 (4)、写出该反应平衡常数表达式;0~5min内SO2的平均反应速率为。(5)、对反应2CO(g)+SO2(g) S(s)+2CO2(g) + Q kJ的分析正确的是。
(4)、写出该反应平衡常数表达式;0~5min内SO2的平均反应速率为。(5)、对反应2CO(g)+SO2(g) S(s)+2CO2(g) + Q kJ的分析正确的是。a.若混合气体密度保持不变,则反应已达平衡状态
b.从反应开始到平衡时,容器内气体的压强保持不变
c.平衡时,其它条件不变,分离出硫,正反应速率加快
d.平衡时,其它条件不变,再充入一定量CO2 , 平衡常数保持不变
(6)、其他条件不变时,随着温度的升高,SO2的平衡转化率随温度的变化曲线如图2所示,请解释其可能的原因。(已知硫的沸点约是445°C)