高考二轮复习知识点:弱电解质在水溶液中的电离平衡1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:(1040℃)远高于(178℃升华)
晶体类型
C
酸性:()远强于()
羟基极性
D
溶解度(20℃):(29g)大于(8g)
阴离子电荷
A、A B、B C、C D、D2. 甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法错误的是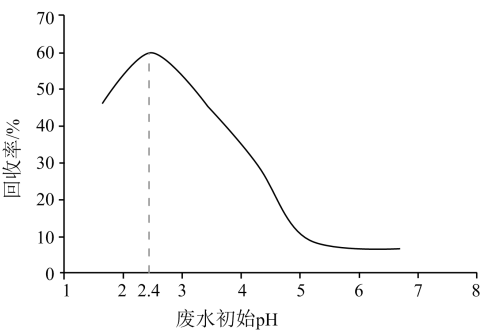 A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在3. 下图是亚砷酸As(OH)3和酒石酸混合体系中部分物种的c-pH图(浓度:总As为 , 总T为)。下列说法错误的是( )
A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在3. 下图是亚砷酸As(OH)3和酒石酸混合体系中部分物种的c-pH图(浓度:总As为 , 总T为)。下列说法错误的是( ) A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为4. 常温下, , , , 下列说法不正确的是A、浓度均为0.1 mol/L的HCOONa和溶液中阳离子的物质的量浓度之和:前者>后者 B、用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和溶液至终点,消耗NaOH溶液的体积:前者<后者 C、0.2mol/L 与0.1 mol/L盐酸等体积混合后,溶液中微粒浓度: D、0.2mol/L HCOONa溶液与0.1mol/L NaOH溶液等体积混合后的溶液中:5. 用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的CH3COOH溶液时,溶液的温度(I)、pH(II)随NaOH体积的变化如下图(图中虚线为校正至25℃时的pH曲线),V1时溶液中 =1。
A、的为 B、的酸性比的强 C、时,的浓度比的高 D、时,溶液中浓度最高的物种为4. 常温下, , , , 下列说法不正确的是A、浓度均为0.1 mol/L的HCOONa和溶液中阳离子的物质的量浓度之和:前者>后者 B、用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和溶液至终点,消耗NaOH溶液的体积:前者<后者 C、0.2mol/L 与0.1 mol/L盐酸等体积混合后,溶液中微粒浓度: D、0.2mol/L HCOONa溶液与0.1mol/L NaOH溶液等体积混合后的溶液中:5. 用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的CH3COOH溶液时,溶液的温度(I)、pH(II)随NaOH体积的变化如下图(图中虚线为校正至25℃时的pH曲线),V1时溶液中 =1。
下列说法正确的是
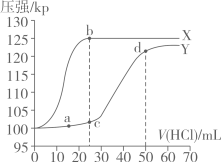
A、x点溶液中,CH3COOH电离程度小于CH3COONa的水解程度 B、y点溶液中,c(CH3COO-)=c(Na+)>c(H+)= c(OH-) C、w点溶液的碱性强于z点溶液的碱性 D、25℃时,CH3COOH的电离常数Ka=1×10-a6. 常温下,用如图所示装置,分别向溶液和溶液中逐滴滴加的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。下列说法正确的是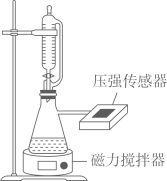
 A、X曲线为溶液与盐酸反应的压强变化曲线 B、c点的溶液中: C、用pH试纸测得c点的pH约为8,可知: D、a、d两点水的电离程度:7. 室温下,以氟磷灰石为原料,经酸浸、转化可得到、和。已知:25℃,的、、();下列说法错误的是( )A、的沉淀溶解平衡可表示为: B、酸浸过程中溶液时, C、溶液中存在: D、向溶液中加入少量水稀释时,的值增大8. 下列说法正确的是( )A、在元素周期表中,每一周期都是从碱金属元素开始,以稀有气体元素结束 B、弱电解质电离平衡正向移动,则电离程度增大,溶液导电性增强 C、难溶电解质的越大,其溶解度不一定越大 D、向平衡体系中加入反应物,则正反应速率增大,平衡正向移动9. 常温下,用标准溶液滴定等浓度的三元酸 , 得到与、或或的关系分别如图1、图2所示。
A、X曲线为溶液与盐酸反应的压强变化曲线 B、c点的溶液中: C、用pH试纸测得c点的pH约为8,可知: D、a、d两点水的电离程度:7. 室温下,以氟磷灰石为原料,经酸浸、转化可得到、和。已知:25℃,的、、();下列说法错误的是( )A、的沉淀溶解平衡可表示为: B、酸浸过程中溶液时, C、溶液中存在: D、向溶液中加入少量水稀释时,的值增大8. 下列说法正确的是( )A、在元素周期表中,每一周期都是从碱金属元素开始,以稀有气体元素结束 B、弱电解质电离平衡正向移动,则电离程度增大,溶液导电性增强 C、难溶电解质的越大,其溶解度不一定越大 D、向平衡体系中加入反应物,则正反应速率增大,平衡正向移动9. 常温下,用标准溶液滴定等浓度的三元酸 , 得到与、或或的关系分别如图1、图2所示。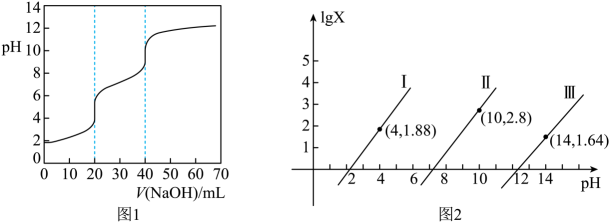
下列说法错误的是( )
A、曲线Ⅰ表示与的变化关系 B、由图1知中和溶液时,未出现突跃 C、当体系中溶液的时, D、当滴入溶液时,10. 某酸溶液中含X粒子的物质的量分数与pH的关系如图所示。下列说法正确的是 A、已知亚磷酸的结构为
A、已知亚磷酸的结构为 ,则X可能为P
B、在溶液中滴加少量溶液,发生反应的离子方程式为
C、溶液中有
D、溶液中有
11. HA是一元弱酸,含少量MA固体的难溶盐MA的饱和溶液中c(M+)随c(H+)而变化, M+不发生水解。实验发现,298K 时c2(M+)~ c(H+)为线性关系,如下图中实线所示。下列叙述错误的是
,则X可能为P
B、在溶液中滴加少量溶液,发生反应的离子方程式为
C、溶液中有
D、溶液中有
11. HA是一元弱酸,含少量MA固体的难溶盐MA的饱和溶液中c(M+)随c(H+)而变化, M+不发生水解。实验发现,298K 时c2(M+)~ c(H+)为线性关系,如下图中实线所示。下列叙述错误的是 A、c(H+) 增大的原因可能是加入了酸HA B、溶液c(H+)= 2×10-4时,c(M+)> 3×10-4mol·L-1 C、随着c(H+)的增大, MA的溶度积Ksp(MA)保持不变 D、c2(M+)~ c(H+) 的线性关系为: c2(M+)= Ksp(MA)12. 已知常温时的的 , 现将和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,随溶液体积的变化如图所示,下列叙述正确的是
A、c(H+) 增大的原因可能是加入了酸HA B、溶液c(H+)= 2×10-4时,c(M+)> 3×10-4mol·L-1 C、随着c(H+)的增大, MA的溶度积Ksp(MA)保持不变 D、c2(M+)~ c(H+) 的线性关系为: c2(M+)= Ksp(MA)12. 已知常温时的的 , 现将和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,随溶液体积的变化如图所示,下列叙述正确的是 A、曲线Ⅱ为氢氟酸稀释时的变化曲线 B、取相同体积a点的两种酸溶液,中和相同浓度的溶液,消耗溶液体积较小 C、b点溶液中水的电离程度比c点溶液中水的电离程度小 D、从b点到d点,溶液中的值变小(代表或)13. 常温下,用溶液滴定溶液,消耗溶液的体积与混合液关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸 , ;。下列说法正确的是
A、曲线Ⅱ为氢氟酸稀释时的变化曲线 B、取相同体积a点的两种酸溶液,中和相同浓度的溶液,消耗溶液体积较小 C、b点溶液中水的电离程度比c点溶液中水的电离程度小 D、从b点到d点,溶液中的值变小(代表或)13. 常温下,用溶液滴定溶液,消耗溶液的体积与混合液关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸 , ;。下列说法正确的是 A、ab段升高的主要原因: B、bc段溶液不可能出现白色沉淀 C、b点: D、c点:
A、ab段升高的主要原因: B、bc段溶液不可能出现白色沉淀 C、b点: D、c点:二、多选题
-
14. NaClO溶液具有添白能力,已知25℃时,。下列关于NaClO溶液说法正确的是( )A、0.01mol/L溶液中, B、长期露置在空气中,释放 , 漂白能力减弱 C、通入过量 , 反应的离子方程式为 D、25℃,的NaClO和HClO的混合溶液中,15. 用双硫腺(H2Dz,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子,从而达到污水处理的目的。如在分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DzCu(HDz)2+2H+ , 再加入CCl4 , Cu(HDz)2就很容易被萃取到CCl4中。如图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率),下列说法错误的是
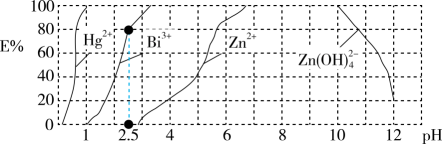 A、当分离过程中,Bi3+发生的络合反应为Bi3++3H2DzBi(HDz)3+3H+ B、加NaOH溶液调节pH=11,一定存在关系:c(Na+)>c(D)=c[Zn(OH)]>c(OH—)>c(H+) C、NaHDz溶液存在关系:c(D)+c(OH-)=c(H2Dz)+c(H+) D、若pH=2.5且-lgc(H2Dz)=pH时,络合反应达到平衡,则H2Dz与Bi3+络合反应平衡常数约为516. 分析化学中“滴定分数”的定义为滴定过程中标准溶液与待测溶液溶质的物质的量之比。常温下用0.01mol·L-1的NaOH溶液滴定0.01mol·L-1某二元弱酸H2R溶液的滴定曲线如图所示。下列说法错误的是
A、当分离过程中,Bi3+发生的络合反应为Bi3++3H2DzBi(HDz)3+3H+ B、加NaOH溶液调节pH=11,一定存在关系:c(Na+)>c(D)=c[Zn(OH)]>c(OH—)>c(H+) C、NaHDz溶液存在关系:c(D)+c(OH-)=c(H2Dz)+c(H+) D、若pH=2.5且-lgc(H2Dz)=pH时,络合反应达到平衡,则H2Dz与Bi3+络合反应平衡常数约为516. 分析化学中“滴定分数”的定义为滴定过程中标准溶液与待测溶液溶质的物质的量之比。常温下用0.01mol·L-1的NaOH溶液滴定0.01mol·L-1某二元弱酸H2R溶液的滴定曲线如图所示。下列说法错误的是 A、H2R的Ka1约为5.67×10-2 , Ka2约为4×10-5 B、从b点到e点,溶液中一定存在:c(R2-)>c(H2R) C、c点溶液中,c(R2-)+c(OH-)=c(HR-)+c(H+)+3c(H2R) D、滴定过程中,混合溶液中始终增大17. 常温下,向20 mL 0.1 mol·L-1NaN溶液中滴入等浓度的HM溶液,所得溶液中与的关系如图所示。已知 , 下列说法错误的是
A、H2R的Ka1约为5.67×10-2 , Ka2约为4×10-5 B、从b点到e点,溶液中一定存在:c(R2-)>c(H2R) C、c点溶液中,c(R2-)+c(OH-)=c(HR-)+c(H+)+3c(H2R) D、滴定过程中,混合溶液中始终增大17. 常温下,向20 mL 0.1 mol·L-1NaN溶液中滴入等浓度的HM溶液,所得溶液中与的关系如图所示。已知 , 下列说法错误的是 A、 B、滴入20 mL HM溶液后,溶液中存在: C、随着HM溶液的加入的值变大 D、滴入20 mL HM溶液后,溶液中存在:18. 常温下,将0.2 mol·L⁻¹ 溶液与0.2 mol·L⁻¹ NaHA溶液等体积混合所得溶液。向混合溶液中缓慢通入HCl气体或加入NaOH固体(无逸出),溶液中的粒子分布系数随溶液pOH的变化如图所示。
A、 B、滴入20 mL HM溶液后,溶液中存在: C、随着HM溶液的加入的值变大 D、滴入20 mL HM溶液后,溶液中存在:18. 常温下,将0.2 mol·L⁻¹ 溶液与0.2 mol·L⁻¹ NaHA溶液等体积混合所得溶液。向混合溶液中缓慢通入HCl气体或加入NaOH固体(无逸出),溶液中的粒子分布系数随溶液pOH的变化如图所示。已知:或;a、b、c、d、e分别表示、、、、中的一种。。

下列说法错误的是
A、图中曲线a表示的是 , 曲线e表示的是 B、pH=7时,mol·L⁻¹ C、M点时, D、时,19. 常温下,向某浓度的H2C2O4溶液中缓慢滴加一定浓度的NaOH溶液,所得溶液中H2C2O4、、三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( ) A、曲线3表示δ() B、草酸H2C2O4的电离常数Ka1=1.0×10-1.2 C、pH=3时,c(H2C2O4)>c()>c() D、水的电离程度:点(A)<点(B)20. 25℃下,用NaOH溶液分别滴定、两种溶液,(M=Cu、Fe),pM随pH变化关系如图所示,已知水溶液中比更难溶。下列说法错误的是( )
A、曲线3表示δ() B、草酸H2C2O4的电离常数Ka1=1.0×10-1.2 C、pH=3时,c(H2C2O4)>c()>c() D、水的电离程度:点(A)<点(B)20. 25℃下,用NaOH溶液分别滴定、两种溶液,(M=Cu、Fe),pM随pH变化关系如图所示,已知水溶液中比更难溶。下列说法错误的是( ) A、①代表滴定溶液的变化关系 B、调控溶液的pH=7,可除去工业废水中的 C、当与共沉淀时溶液中 D、若某一元弱酸(HA)的 , 则易溶于HA溶液中21. 室温下,向含1mol N2H4的水溶液中通入HCl气体,溶液的pOH[pOH=-1gc(OH-)]与含氮粒子的分布分数δ(X)(X代表N2H4、N2H、N2H等粒子)的关系如图所示。下列说法错误的是( )
A、①代表滴定溶液的变化关系 B、调控溶液的pH=7,可除去工业废水中的 C、当与共沉淀时溶液中 D、若某一元弱酸(HA)的 , 则易溶于HA溶液中21. 室温下,向含1mol N2H4的水溶液中通入HCl气体,溶液的pOH[pOH=-1gc(OH-)]与含氮粒子的分布分数δ(X)(X代表N2H4、N2H、N2H等粒子)的关系如图所示。下列说法错误的是( ) A、曲线III表示N2H分布分数的变化 B、N2HN2H+H+的平衡常数为10-12 C、L→M→N过程中,水的电离程度先增大后减小 D、当通入2mol HCl时溶液中:c(H+)-c(OH-)=c(N2H)+2c(N2H4)22. 常温下,向二元弱酸溶液中滴加溶液,测得混合溶液的与离子浓度变化的关系如图所示,下列说法错误的是( )
A、曲线III表示N2H分布分数的变化 B、N2HN2H+H+的平衡常数为10-12 C、L→M→N过程中,水的电离程度先增大后减小 D、当通入2mol HCl时溶液中:c(H+)-c(OH-)=c(N2H)+2c(N2H4)22. 常温下,向二元弱酸溶液中滴加溶液,测得混合溶液的与离子浓度变化的关系如图所示,下列说法错误的是( ) A、 B、交点a的溶液中: C、m表示与的变化关系 D、等浓度等体积的溶液与溶液混合,所得溶液呈碱性23. 实验测得浓度均为0.1mol·L-1的NaOH溶液、CH3COONa溶液和NH4Cl溶液的pH随温度变化的曲线如图所示。下列说法错误的是( )
A、 B、交点a的溶液中: C、m表示与的变化关系 D、等浓度等体积的溶液与溶液混合,所得溶液呈碱性23. 实验测得浓度均为0.1mol·L-1的NaOH溶液、CH3COONa溶液和NH4Cl溶液的pH随温度变化的曲线如图所示。下列说法错误的是( ) A、20℃时,纯水的Kw约为10-14.17 B、随温度升高,CH3COONa溶液和NH4Cl溶液中的c(OH-)均减小 C、|随温度升高,CH3COONa溶液和NH4Cl溶液的水解平衡均正向移动 D、50℃时,将CH3COONa和NH4Cl配制成pH=7的混合液,溶液中存在:c(CH3COO-)+c(Cl-)=c(NH)+c(Na+)24. 25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )
A、20℃时,纯水的Kw约为10-14.17 B、随温度升高,CH3COONa溶液和NH4Cl溶液中的c(OH-)均减小 C、|随温度升高,CH3COONa溶液和NH4Cl溶液的水解平衡均正向移动 D、50℃时,将CH3COONa和NH4Cl配制成pH=7的混合液,溶液中存在:c(CH3COO-)+c(Cl-)=c(NH)+c(Na+)24. 25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )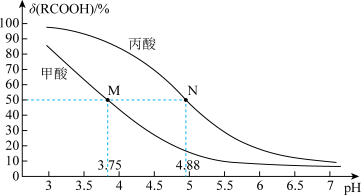 A、甲酸酸性大于丙酸 B、对于甲酸和丙酸,当lg[c(RCOOH)/c(RCOO-)]>0时,溶液都为酸性 C、等浓度的HCOONa和CH3CH2COONa两种溶液中的水电离的c(OH-)相等 D、将0.1mol·L-1的HCOOH溶液与0.1mol/L的CH3CH2COONa溶液等体积混合,所得溶液中:c(HCOO-)<c(CH3CH2COOH)
A、甲酸酸性大于丙酸 B、对于甲酸和丙酸,当lg[c(RCOOH)/c(RCOO-)]>0时,溶液都为酸性 C、等浓度的HCOONa和CH3CH2COONa两种溶液中的水电离的c(OH-)相等 D、将0.1mol·L-1的HCOOH溶液与0.1mol/L的CH3CH2COONa溶液等体积混合,所得溶液中:c(HCOO-)<c(CH3CH2COOH)三、非选择题
-
25. 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物(L为配体)溶于弱碱性的海水中,制成吸收液,将气体转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①的吸收氧化;②的再生。反应原理如下:
①
②
回答下列问题:
(1)、该工艺的总反应方程式为。1mol 发生该反应的热量变化为 , 在总反应中的作用是。(2)、研究不同配体与所形成的配合物(A、B、C)对吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 , 测得单位体积吸收液中吸收转化率随时间变化的曲线如图1所示。以由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是(填“A”、“B”或“C”)。 (3)、的电离方程式为。25℃时,溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化关系如图2,由图2计算,的 , 。再生反应在常温下进行,解离出的易与溶液中的形成沉淀。若溶液中的 , , 为避免有FeS沉淀生成,应控制溶液pH不大于(已知25℃时,FeS的为)。
(3)、的电离方程式为。25℃时,溶液中、、在含硫粒子总浓度中所占分数随溶液pH的变化关系如图2,由图2计算,的 , 。再生反应在常温下进行,解离出的易与溶液中的形成沉淀。若溶液中的 , , 为避免有FeS沉淀生成,应控制溶液pH不大于(已知25℃时,FeS的为)。 26.(1)、Ⅰ.纯碱()和小苏打()都是白色晶体,在日常生活中都可以找到。
26.(1)、Ⅰ.纯碱()和小苏打()都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下列方法中可行的是。
a.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
b.分别用干净铁丝蘸取样品在煤气灶的火焰上灼烧,观察火焰颜色
c.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
d.分别放在炒锅中加热,观察是否有残留物
(2)、溶液和溶液中都含有、、、、、、 , 写出一个用浓度表示这些微粒之间的电荷守恒的关系式。(3)、Ⅱ.某同学在两个相同的特制容器中分别加入溶液和溶液,再分别用盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
甲、乙两条线中表示向溶液中滴加盐酸的是 , 理由是。丙、丁两条线中表示向溶液中滴加盐酸的是 , 理由是。
(4)、当滴加盐酸的体积为时(a点、b点),所发生的反应用化学方程式表示为。根据图分析,滴定时c点可用、d点可用作指示剂指示滴定终点(选填“甲基橙”“石蕊”或“酚酞”)。(5)、NaClO也是生活中常见的钠的化合物。废水脱氮工艺中有一种方法是在废水中加入过量NaClO使完全转化为 , 该反应的离子方程式为。27. 乙二酸俗称草酸(),是一种二元弱酸,易溶于水,具有还原性。25℃时,的电离平衡常数 , 。(1)、Ⅰ.学习小组甲用酸性标准溶液滴定未知浓度的草酸溶液。中C元素的化合价是 , 写出的电离方程式。
(2)、某学生的滴定方式(夹持部分略去)如图1所示,合理的是(填“a”或“b”),由图2可知消耗溶液体积为mL,若滴定终点时俯视滴定管刻度读数,则由此测得的草酸溶液的物质的量浓度会(填“偏大”“偏小”或“不变”)。 (3)、Ⅱ.学习小组乙查阅文献获得以下信息:
(3)、Ⅱ.学习小组乙查阅文献获得以下信息:①三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解,是一种稳定的配离子,能类似于中的在溶液中稳定存在。和存在如下平衡:
ⅰ.
ⅱ.
②相同条件下,草酸根(C2O)的还原性强于
③为黄色固体,微溶于水,可溶于强酸
【实验】探究Fe3+和草酸根在溶液中的反应。
操作
现象
在避光处,向10mL 0.5 溶液中缓慢加入0.5 溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤
得到翠绿色溶液和翠绿色晶体
取实验中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,原因是(结合ⅰ、ⅱ平衡,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,与结合使ⅱ平衡移动(填“正向”或“逆向”)。经检验发现上述实验中和未发生氧化还原反应。
(4)、取实验中少量的翠绿色溶液于试管中光照一段时间,产生黄色沉淀和气泡,反应的离子方程式为 , 用单线桥法表示该反应中的电子转移情况。(5)、写出一种利用盐类水解原理在生产或生活中应用的实例。28. 非金属元素及其化合物与科研、工农业生产有着密切联系。回答下列问题:(1)、次氯酸的结构式为 , 碳化硅晶体属于晶体。非金属性SCl(填“>”或“<”),用原子结构知识解释其原因:同一周期元素,由左到右。(2)、常温下,浓度均为0.1 mol/L的六种溶液pH如下:溶质
NaClO
Na2CO3
NaHCO3
Na2SiO3
Na2SO3
NaHSO3
pH
10.3
11.6
9.7
12.3
10.0
4.0
常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是(填序号) 。
a.H2CO3 b.H2SO3 c.H2SiO3
六种溶液中,水的电离程度最小的是(填化学式)。
(3)、用离子方程式说明Na2CO3溶液pH>7的原因。(4)、欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是(填化学式) , 用化学平衡移动的原理解释其原因:。29. 硫、氮、氯、氧、钠、铝、铁等是人们熟悉的元素,它们的单质及其化合物对工农业有着很重要的地位。(1)、硫原子的最外层电子排布式。铝原子核外电子占据轨道有个,氯原子能量最高的电子亚层是。过氧化钠的电子式;氮原子的电子云形状有种。(2)、氯化钠晶体的熔点高于氯化钾,原因是。(3)、用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被氧化使Fe2(SO4)3再生,其原理为: FeSO4+O2+H2SO4Fe2(SO4)3+H2O①配平上面Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。
②硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为;若反应温度过高,反应速率下降,其原因是。
 (4)、常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
(4)、常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。温度(℃)
c(氨水)(mol/L)
电离度(%)
c(OH-)(mol/L)
0
16.56
9.098
1.507×10-2
10
15.16
10.18
1.543×10-2
20
13.63
11.2
1.527×10-2
①温度升高,NH3·H2O的电离平衡向(填“左”、“右”)移动。
②表中c(OH-)基本不变的原因是。
30. 室温下,Ka1(H2SO3)=10-1.81 , Ka1(H2SO3)=10-6.99。室温下通过下列实验探究Na2SO3、NaHSO3溶液的性质。实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol·L-1NaHSO3溶液中加氨水至pH=7。
实验3:向0.10mol·L-1Na2SO3溶液中滴几滴0.10mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液不变红。
实验4:向0.10mol·L-1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是( )
A、实验1的溶液中:=10-1.6 B、实验2得到的溶液中有 C、实验3中加FeCl3溶液的离子方程式为: D、实验4的上层清液中有c(SO)•c(Ba2+)=Ksp(BaSO3),产生的气体中一定有SO231. 硫化氢的转化是资源利用和环境保护的重要研究课题。(1)、工业上将含有硫化物的废水(以H2S、HS-、S2-的形式存在)引入氧化池,加入高锰酸钾溶液氧化。已知高锰酸钾在酸性条件下的还原产物为Mn2+ , 碱性条件下的为MnO2。①pH>7时高锰酸钾将废水中的硫化物氧化为S,该反应的离子方程式为。
②研究发现:其他条件相同时,废水呈酸性时硫化物的去除率明显大于呈碱性时去除率,则可能的原因。
(2)、常温下,H2S的Ka1=1.3×10-7、Ka2=7.0×10-15 , Ksp(MnS)=1.4×10-15。向含有0.0020mol·L-1Mn2+废水中通入一定量的H2S,当溶液的pH=a、c(HS-)=1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。(3)、表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图1表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是。
②若水膜过厚,H2S的氧化去除率减小的原因是。
(4)、甲硫醇是一种恶臭、有毒物质。生物法去除甲硫醇反应为2CH3SH+7O2=2CO2+2H2O+2H2SO4。研究表明,在H2S存在条件下,可改变甲硫醇(用 表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程。
表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程。 32. 磷及其化合物与人类生产、生活密切相关。(1)、基态P原子中,电子占据的最高能级的符号为。(2)、核外电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、如图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。
32. 磷及其化合物与人类生产、生活密切相关。(1)、基态P原子中,电子占据的最高能级的符号为。(2)、核外电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、如图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。 (4)、已知有关氮、磷的单键和三键的键能(kJ·mol-1)如表:
(4)、已知有关氮、磷的单键和三键的键能(kJ·mol-1)如表:N-N
N≡N
P-P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式为
 )形式存在的原因是 , 白磷中P原子的杂化方式为。(5)、已知PCl3是不稳定的无色液体,遇水反应可生成两种酸,该反应的化学方程式为 , 所得含氧酸(已知该含氧酸的各步电离平衡常数分别为Ka1=1.6×10-2和Ka2=7×10-7)的结构式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是 , 白磷中P原子的杂化方式为。(5)、已知PCl3是不稳定的无色液体,遇水反应可生成两种酸,该反应的化学方程式为 , 所得含氧酸(已知该含氧酸的各步电离平衡常数分别为Ka1=1.6×10-2和Ka2=7×10-7)的结构式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
(7)、分别用 、●表示H2PO和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
、●表示H2PO和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为(填标号)。
 33. 某实验小组利用如图装置模拟古法硫酸生产方法并进行SO2性质探究。
33. 某实验小组利用如图装置模拟古法硫酸生产方法并进行SO2性质探究。
已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2 , 关闭活塞K3 , 通入一段时间N2后,关闭活塞K1、K2 , 打开活塞K3 , 高温加热绿矾。
完成下列填空:
(1)、C装置中覆盖食用油的目的是;B中所得硫酸溶液的质量分数理论值为 (保留三位有效数字)。(2)、该装置存在的不足之处为。为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
①
②
③
④
已煮沸的BaCl2溶液
未煮沸的BaCl2溶液
已煮沸的Ba(NO3)2溶液
未煮沸的Ba(NO3)2溶液
注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。
得到如下pH-t图:
 (3)、曲线①呈缓慢下降趋势,这是因为。曲线②出现骤降,表明溶液中生成了 (填物质名称)。对比分析上述四组数据,可得出的结论是 (任写2条)。(4)、为对排气法收集到的SO2气体进行含量测定,将1120mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀10.718g.则SO2气体的体积分数为 (保留两位有效数字)。若该实验数据较实际值偏大,则可能的原因是 (选填序号)。
(3)、曲线①呈缓慢下降趋势,这是因为。曲线②出现骤降,表明溶液中生成了 (填物质名称)。对比分析上述四组数据,可得出的结论是 (任写2条)。(4)、为对排气法收集到的SO2气体进行含量测定,将1120mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀10.718g.则SO2气体的体积分数为 (保留两位有效数字)。若该实验数据较实际值偏大,则可能的原因是 (选填序号)。a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面
(5)、SO2属于大气污染物,还可用H2与其高温反应消除SO2带来的污染,其反应原理如图所示:
①反应原理过程中X为 (填名称)。
②写出检验X所需试剂及实验现象。
34. 探究含碳化合物的转化,有一定的现实意义。(1)、①溶于海水的 以 形式存在。在海洋中,通过如图钙化作用实现碳自净。写出钙化作用的离子方程式。
②利用氨水作吸收液生成 ,是当前有效捕捉 的方法之一、下列有关说法错误的是
A.该方法的优势在于生成的 易分解,可实现吸收液的再生
B. 溶液中存在
C. 溶液中存在
D.已知 ,可推测 溶液呈酸性
(2)、利用反应 ,制备重要的化工原料甲醇,在一定条件下进行该反应,测得 的转化率与温度(T)、起始投料比(m)关系如图。
①下列描述正确的是。
A.若 ,则 最大
B.在 前, ,在 时,
C.若 ,则a点 的平衡转化率等于 的平衡转化率
D.若反应一段时间后 和 的体积分数相同可判断上述反应达平衡
②图中在 时,不同的投料比 转化率趋于相近的原因是。
(3)、以 、 为原料催化重整可得到合成气: ;①在t℃下,向2L恒容的密闭容器中充入 和 进行催化重整反应,平衡后测得 和CO的体积分数相等,则t℃下该反应的平衡常数。
②催化重整时,催化剂活性会因积碳增多而降低,有关积碳和消碳反应如下:
积碳反应:
消碳反应:
在一定的温度下,增大 的浓度,有助于增大催化剂活性的原因是。
35. 硒是一种重要的半导体材料,用富硒铜阳极泥(主要成分为Se、Cu2Se、Ag2Se和银、金等)为原料制备硒的工艺流程如下:
回答下列问题:
(1)、试推断34Se在元素周期表中的位置 , 据此写出Na2Se的电子式。(2)、“苏打烧结”时主要发生的化学反应方程式为; ; 。(3)、“含硒烧渣”浸取时需控制温度为80℃,则最佳加热方式为;浸出渣中主要的杂质有、Ag、Au等。(4)、已知SeO2易溶于水生成H2SeO3 , 相同温度下,H2SeO3、H2CO3的电离平衡常数如下:化学式
H2SeO3
H2CO3
电离平衡常数
K1=2.7×10-3
K2=2.5×10-8
K1=4.3×10-7
K2=5.6×10-11
若向Na2CO3溶液中通入过量SeO2 , 则下列反应的离子方程式正确的是_______。
A、 B、 C、 D、(5)、研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液可直接制得单质Se,写出电解时的阴极反应式:。(6)、回收硒还可采用另一工艺:即向阳极泥加入浓硫酸,用水吸收生成的SeO2和SO2 , 试分析此工艺存在的不足之处(答一点即可)。