高考二轮复习知识点:离子反应发生的条件
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、
-
2. 某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是( )
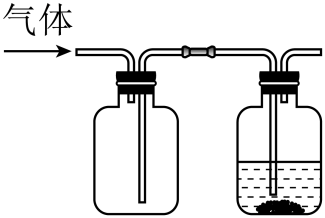
气体
液体
固体粉末
A
饱和溶液
B
溶液
Fe
C
溶液
D
A、A B、B C、C D、D -
3. 下列化合物中,能与Na2CO3溶液反应生成沉淀且沉淀可溶于NaOH溶液的是( )A、MgCl2 B、Ca(NO)3 C、FeSO4 D、AlCl3
-
4. 下列指定反应的离子方程式正确的是( )A、饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4 CaCO3+SO42− B、酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O C、KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O D、电解饱和食盐水:2Cl−+2H+ Cl2↑+ H2↑
-
5. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− B、0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+、NO3−、SO42− C、0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− D、0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
-
6. 侯德榜先生于1943年创立了“侯氏制碱法”。该工艺中一般不涉及的离子反应是( )A、 B、 C、 D、
-
7. +5价V在不同pH下微粒的化学式不同,其微粒与pH关系如表所示。
含钒元素的不同微粒
VO
VO
V2O
VO
pH
4~6
6~8
8~10
10~12
另外,V价态不同在溶液中颜色不同,如V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO(黄色)、VO(无色)、V5O(红棕色)等。下列说法正确的是( )
A、VO转化为V2O的离子反应为2VO+H2O=V2O+2H+ B、含VO的溶液中滴加氨水有NH4VO3沉淀产生,该过程V元素被还原 C、酸性VO滴加烧碱溶液,溶液显红棕色时离子反应为5VO+8OH-=V5O+4H2O D、紫色VSO4溶液中滴加酸性高锰酸钾溶液,溶液颜色出现绿色→蓝色→黄色,两个过程均失去1mol电子 -
8. 下列关于离子共存或者离子反应的说法正确的是( )A、 溶液可能大量存在: 、 、 、 B、用NaOH溶液吸收过量CO2: C、 氯化亚铁溶液:Na+、 、 、MnO D、氢氧化铁和碘化氢溶液反应:
-
9. 常温下,用一定浓度的盐酸滴定某浓度的氨水。滴定终点附近溶液的pH和导电能力的变化如图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是( )
 A、a点对应的溶液中: B、a→b过程中, 不断增大 C、c→d溶液导电性增强的主要原因是 和 增大 D、根据溶液pH和导电能力的变化可判断:
A、a点对应的溶液中: B、a→b过程中, 不断增大 C、c→d溶液导电性增强的主要原因是 和 增大 D、根据溶液pH和导电能力的变化可判断: -
10. 某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。

已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
A、根据步骤①的现象,说明废液中一定含有Al3+ B、由步骤②中红棕色固体可知,废液中一定存在Fe3+ C、沉淀甲中可能含有Al(OH)3 D、该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种 -
11. 下列各组反应中不属于离子反应的是( )A、NaCl与AgNO3反应 B、FeCl3与Cu反应 C、Na2O与H2O反应 D、在氧气中点燃氢气
-
12. 不能用离子方程式Ca2++CO32- →CaCO3↓表示的反应是( )A、澄清石灰水和碳酸 B、澄清石灰水和碳酸钠溶液 C、硝酸钙溶液和碳酸铵溶液 D、氯化钙溶液和碳酸钾溶液
-
13. 向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42-全部沉淀时,铝元素的主要存在形式为( )A、Al3+ B、AlO2- C、Al(OH)3 D、Al(OH)3、AlO2-
-
14. 在pH=13的某溶液中存在大量的Na+、ClO-、NO3- , 该溶液还可能大量存在的离子是( )A、NH4+ B、HCO3- C、SO42- D、Al3+
-
15. 某无色溶液中可能存在Br-、CO32-、SO32-、Fe3+、I-、Mg2+、Na+等例子中的某几种,现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液肯定不存在的大量离子是( )
A、Fe3+、SO32-、I- B、Mg2+、CO32-、I- C、Fe3+、Mg2+、SO32- D、Na+、Br-、CO32- -
16. 下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、I-、Cl-
NaOH溶液
Fe3+ + 3OH- =Fe(OH)3↓
B
K+、ClO-、SO42-
盐酸
H++ClO- =HClO
C
K+、OH-、Cl-
过量SO2
SO2+ OH-=HSO3-
D
H+、Fe2+、 SO42-
Ba(NO3)2溶液
SO42-+ Ba2+ =BaSO4↓
A、A B、B C、C D、D -
17. 解释下列事实的方程式正确的是( )A、纯碱溶液显碱性:CO32-+2H2O H2CO3+2OH- B、用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O C、向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4 D、碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
-
18. 常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )
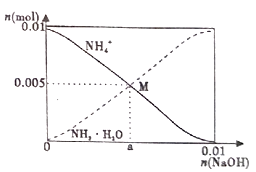 A、M点溶液中水的电离程度比原溶液大 B、在M点时,n(H+)-n(OH-)=(0.005-a)mol C、随着NaOH溶液的滴加, 不断增大 D、当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
A、M点溶液中水的电离程度比原溶液大 B、在M点时,n(H+)-n(OH-)=(0.005-a)mol C、随着NaOH溶液的滴加, 不断增大 D、当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-) -
19. 下列物质之间进行反应时,可用离子方程式2H+ + CO32- → H2O+CO2 ↑表示的是( )A、碳酸钠溶液中加入足量醋酸溶液 B、碳酸钡和稀硝酸反应 C、碳酸氢钠溶液中加入少量稀硫酸 D、在盐酸溶液中滴入少量碳酸钾溶液
-
20. 某溶液含有①NO3-、②HCO3- 、③SO32- 、④CO32- 、⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )A、① B、①⑤ C、①④⑤ D、①③④⑤
-
21. 下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A、Mg2+、Na+、SO42-、Cl- B、K+、CO32-、Cl-、NO3- C、Na+、K+、NO3-、SO32- D、NH4+、Na+、SO42-、NO3- -
22. 已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
H2O2 + I- = H2O + IO-慢
H2O2 + IO-= H2O + O2 + I- 快
下列说法正确的是( )
A、IO-是该反应的催化剂 B、反应的速率与I-浓度有关 C、ν(H2O2) =ν(H2O) =ν(O2) D、反应活化能等于98kJ/mol -
23. 下列有关水处理的离子方程式错误的是( )A、沉淀法:加入Na2S处理含Hg2+废水,Hg2++ S2- =HgS B、中和法:加入生石灰处理酸性废水,H++ OH- =H2O C、氧化法:加入次氯酸处理氨氮废水,2NH4++3HClO =N2↑+3H2O+5 H++ 3Cl- D、混凝法:加入明矾[K2SO4·Al2(SO4)3·24H2O]使水中的悬浮颗粒发生凝聚,Al3++3H2O =Al(OH)3+3H+
-
24. Cl2是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装
钢瓶
储运要求
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪
泄漏处理
NaOH、NaHSO3溶液吸收
下列解释事实的方程式错误的是( )
A、电解饱和食盐水制取Cl2:2Cl- +2H2O 2OH-+ H2↑+Cl2↑ B、氯气用于自来水消毒:Cl2 + H2O 2H+ + Cl-+ ClO-
C、浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 = 6 NH4Cl + N2
D、氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O = SO42-+ 3H+ + 2Cl-
2H+ + Cl-+ ClO-
C、浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 = 6 NH4Cl + N2
D、氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O = SO42-+ 3H+ + 2Cl-
-
25. 下列反应的离子方程式书写正确的是( )A、Na2CO3 溶液中滴入少量盐酸:CO32-+2H+→CO2↑+H2O B、铁粉与稀 H2SO4反应:2Fe+6H+→2Fe3++3H2↑ C、Cu(OH)2与稀 H2SO4反应:OH-+H+→ H2O D、氯气与氢氧化钠溶液反应 Cl2+2OH‾→ClO‾+Cl‾+H2O
-
26. 下列指定反应的离子方程式正确的是( )A、向偏铝酸钠和碳酸钠的混合溶液中滴加少量盐酸:AlO2-+ H++H2O=Al(OH)3 ↓ B、将少量SO2 通入次氯酸钠溶液:ClO-+SO2+H2O=2H++Cl-+SO42- C、向碘化亚铁溶液中滴加少量稀硝酸:NO3-+3Fe2++4H+=3Fe3++ NO↑+2H2O D、向氯化铝溶液中滴加硫化钠溶液:3S2-+2Al3+=Al2S3↓
-
27. A、B、C、D、E 五种物质中均含有同一种短周期主族元素R, 它们能发生如图所示的转化关系,已知A、B、D、E四种物质均难溶于水,单质R能与NaOH溶液反应生成盐和氢气。

下列说法正确的是( )
A、反应①中氧化剂与还原剂的物质的量之比为1∶1 B、化合物A既能溶于NaOH又能溶于氢氟酸 C、反应④的离子方程式为:2R+2OH-+2H2O=2RO2-+3H2↑ D、化合物C的溶液与反应①产生的气体能够发生化学反应
二、非选择题
-
28. 某工厂废水中含有Zn2+、Cd2+、Al3+、Fe2+、Fe3+、SO42-等离子,可以通过“降温结晶一化学沉淀一溶剂萃取”的方法对金属离子分别进行分离和回收,图1展示了实验开发的金属回收工艺。

回答下列问题:
(1)、取200mL废水置于烧杯中,水浴加热至60℃,搅拌的同时按照化学计量数之比加入硫酸铵固体,待其完全溶解后,在低温时搅拌析出铵明矾晶体,其化学式为NH4Al(SO4)2·12H2O,发生反应的化学方程式为。(2)、降温结晶除掉了废水中大部分铝元素,还需将剩余铝、铁元素去除,故降温结晶、过滤后,向滤液中加入X溶液,将废水中的Fe2+完全氧化为Fe3+ , 再调节pH为4.9.根据题意可推知X的电子式为;滤渣1的主要成分是(填化学式)。(3)、工业上常采用有机磷酸类萃取剂P2O4来回收硫酸锌。如果没有设计萃取这一步骤,将会产生的影响是;滤渣2的主要成分是(填化学式);已知Al(OH)3在强碱溶液中生成Al(OH)4]- , 且滤渣2性质类似Al(OH)3 , 请写出滤渣2与强碱溶液反应的离子方程式。(4)、为提高资源利用率,水相经过滤得到的废液可在实验工艺流程中步骤循环使用。 -
29. 我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):

成分
Si
Fe
Cu
Mn
Mg
Zn
Ti
Li
Al
含量
0.08
0.1
2.9~3.5
0.5
0.25~0.8
0.25
0.1
0.8~1.1
Bal
为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:
(1)、铝锂合金可用于制造飞机,铝锂合金材料的主要特点是。(2)、铝元素原子核外有种不同运动状态的电子,最外层电子排布式为。(3)、碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式(写一个即可)。(4)、镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱(5)、向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:;写出其现象中的一个离子方程式。 -
30. 醋酸亚铬[(CH3COO)2Cr∙H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬(溶液呈绿色)还原为二价铬(溶液呈亮蓝色);二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如下,请回答以下问题:
 (1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量的锌和氧化铬固体置于c中,加入少量蒸馏水,按图连接好,打开K1、K2 , 关闭K3。此时观察到c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为;过量锌的作用是。(3)、打开K3 , 关闭K1、K2 , 观察到现象为、d中出现砖红色沉淀,为得到纯净的砖红色晶体,需采取的操作是、、洗涤、干燥。(4)、装置d可能存在的缺点为。
(1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量的锌和氧化铬固体置于c中,加入少量蒸馏水,按图连接好,打开K1、K2 , 关闭K3。此时观察到c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为;过量锌的作用是。(3)、打开K3 , 关闭K1、K2 , 观察到现象为、d中出现砖红色沉淀,为得到纯净的砖红色晶体,需采取的操作是、、洗涤、干燥。(4)、装置d可能存在的缺点为。 -
31. 醋酸亚铬,通常以二水盐[Cr(CH3COO)2]2·2H2O的形式存在,是深红色晶体,潮湿时易被氧化。不溶于冷水,微溶于乙醇。醋酸亚铬的一种实验室制备装置和实验步骤如下:

易被氧化。不W 于冷水,微游于乙M。
①连接装置,检查装置气密性,加入药品
②………………………….,A中反应液变浅蓝色后,停止滴入盐酸,向C中通入N2
③打开a,关闭b,保持通入N2 , 再次滴入盐酸
④待C中有大量红色晶体析出,停止滴入盐酸
⑤取C中物质,抽滤,依次用水、乙醇洗涤沉淀,干燥,称重
回答下列问题:
(1)、装置A的名称为 , 导管c的作用是。(2)、补充步骤②中的实验操作。(3)、步骤②中Zn与K2Cr2O7反应的离子方程式为。(4)、步骤③中出现的现象是 , 保持通入N2的目的是。(5)、洗涤时依次用水、乙醇,目的依次为。(6)、铬离子会污染水,常温下处理上述实验中多余Cr2+时,可向溶液中通入足量的(填物质名称或化学式)再加入碱调节pH为6,此时溶液中残留的Cr3+浓度为mol/L。已知:Ksp[Cr(OH)3] =6.3×10-31 -
32. 碘化钾是一种无色晶体。易溶于水。实验室制备KI晶体的步骤如下:
I.在如图所示的三颈烧瓶中加入127g研细的单质I2 和195g30% KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3);
II.碘完全反应后,打开分液漏斗中的活塞、弹簧夹,向装置C中通入足量的H2S;
III.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热;
IV.冷却,过滤得KI粗溶液。
 (1)、检查装置A气密性的方法是 , 步骤I控制KOH溶液过量的目的是。(2)、装置B的作用是 , 装置D中盛放的溶液是 。(3)、写出装置C中H2S和KIO3反应的离子方程式: 。(4)、步骤III中水浴加热的目的是除去 (填化学式)。(5)、由步骤IV所得的KI粗溶液(含SO42-)制备KI晶体的实验方案:边搅拌边向溶液中加入足量的 (填化学式,下同),充分搅拌、过滤、洗涤并检验后,将滤液和洗涤液合并,加入HI溶液调至弱酸性,在不断搅拌下蒸发至较多固体析出,停止加热,用余热蒸干,得到KI晶体。在测定产品中KI含量时,测得其含量为101.5%,其原因可能是产品中含有。
(1)、检查装置A气密性的方法是 , 步骤I控制KOH溶液过量的目的是。(2)、装置B的作用是 , 装置D中盛放的溶液是 。(3)、写出装置C中H2S和KIO3反应的离子方程式: 。(4)、步骤III中水浴加热的目的是除去 (填化学式)。(5)、由步骤IV所得的KI粗溶液(含SO42-)制备KI晶体的实验方案:边搅拌边向溶液中加入足量的 (填化学式,下同),充分搅拌、过滤、洗涤并检验后,将滤液和洗涤液合并,加入HI溶液调至弱酸性,在不断搅拌下蒸发至较多固体析出,停止加热,用余热蒸干,得到KI晶体。在测定产品中KI含量时,测得其含量为101.5%,其原因可能是产品中含有。 -
33. 亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,同时也是对烟气进行脱硫、脱硝的吸收剂。
Ⅰ.以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO2∙3H2O,等于或高于38℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl。
(1)、试剂A应选择。(填字母)a.SO2
b.浓硝酸
c.KMnO4
(2)、反应②的离子方程式为。(3)、已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是。(4)、下列关于上述流程的说法中,合理的是。(填字母)a.反应①进行过程中应持续鼓入空气
b.反应①后得到的母液中,溶质的主要成分是NaCl
c.反应②中NaOH溶液应过量
d.冷却结晶时温度选择38℃,过滤后进行温水洗涤,然后在低于60℃下进行干燥,得到粗产品NaClO2
(5)、Ⅱ.采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol/L。反应一段时间后溶液中离子浓度的分析结果如下表:
离子
SO42−
SO32−
NO3−
NO2−
Cl−
c /(mol/L)
8.35×10−4
6.87×10−6
1.5×10−4
1.2×10−5
3.4×10−3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式。
②由实验结果可知,脱硫反应速率(填“大于”或“小于”)脱硝反应速率。除SO2和NO在烟气中的初始浓度不同外,还可能存在的原因是。(答出两条即可)
-
34. 某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号
实验操作
实验现象
I
将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中
铁丝表面有银白色固体析出,溶液逐渐变为浅绿色
II
取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液
有蓝色沉淀生成
(1)、根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是。(2)、乙同学认为实验中可能生成Fe3+ , 设计并完成如下实验实验序号
实验操作
实验现象
III
取少量实验I中上层清液,滴入少量KSCN溶液,振荡
产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+ , 理由是 。
(3)、乙同学继续探究红色褪去的原因,设计并完成如下实验实验序号
实验操作
实验现象
IV
取少量实验I中上层清液,滴加几滴稀盐酸
有白色沉淀生成
V
取1mL Fe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液
溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀.
① 实验IV的目的是;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因。
(4)、丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红
①其中X溶液是;
②由实验得出Ag+和Fe2+反应的离子方程式是;
③ 丙同学的实验设计及结论是否合理,请说明理由。
-
35. 钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
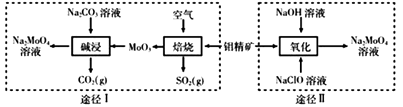 (1)、途径I碱浸时发生反应的化学反应方程式为。(2)、途径II氧化时还有Na2SO4生成,则反应的离子方程式为。(3)、已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8 , 忽略溶液的体积变化]。(4)、分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的气体一起通入水中,得到正盐的化学式是。(5)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:
(1)、途径I碱浸时发生反应的化学反应方程式为。(2)、途径II氧化时还有Na2SO4生成,则反应的离子方程式为。(3)、已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8 , 忽略溶液的体积变化]。(4)、分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的气体一起通入水中,得到正盐的化学式是。(5)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图: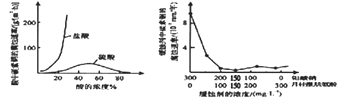
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1 , 则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓度为(计算结果保留3位有效数字)。
(6)、二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n。则电池放电时正极的电极反应是:。
