高考二轮复习知识点:电解质在水溶液中的电离1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 一种捕集烟气中CO2的过程如图所示。室温下以0.1mol∙L-1KOH溶液吸收CO2 , 若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c()+c()。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是 ( )
 A、KOH吸收CO2所得到的溶液中:c(H2CO3)>c() B、KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c()+c(H2CO3) C、KOH溶液吸收CO2 , c总=0.1mol∙L-1溶液中:c(H2CO3)>c() D、如图所示的“吸收”“转化”过程中,溶液的温度下降2. 甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是( )
A、KOH吸收CO2所得到的溶液中:c(H2CO3)>c() B、KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c()+c(H2CO3) C、KOH溶液吸收CO2 , c总=0.1mol∙L-1溶液中:c(H2CO3)>c() D、如图所示的“吸收”“转化”过程中,溶液的温度下降2. 甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是( )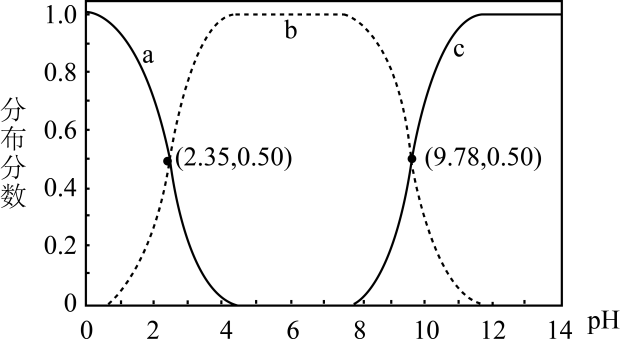 A、甘氨酸具有两性 B、曲线c代表 C、的平衡常数 D、3. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
A、甘氨酸具有两性 B、曲线c代表 C、的平衡常数 D、3. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
下列说法正确的的是( )
A、图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 B、当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO+H+=CO2↑+H2O C、根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 D、Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)4. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中5. 25℃时,下列说法正确的是( )A、NaHA溶液呈酸性,可以推测H2A为强酸 B、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐 C、0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2 , 则α1<α2 D、100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol6. 实验小组用双指示剂法准确测定样品(杂质为)的纯度。步骤如下:①称取m g样品,配制成100mL溶液;
②取出25mL溶液置于锥形瓶中,加入2滴酚酞溶液,用浓度为的盐酸滴定至溶液恰好褪色(溶质为和),消耗盐酸体积为;
③滴入2滴甲基橙溶液,继续滴定至终点,消耗盐酸体积为。
下列说法正确的是( )
A、①中配制溶液时,需在容量瓶中加入100mL水 B、②中溶液恰好褪色时: C、样品纯度为 D、配制溶液时放置时间过长,会导致最终测定结果偏高7. 联氨()溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时, , 。下列说法不正确的是( )A、的溶液呈酸性 B、的第二步电离方程式为 C、与稀中和生成的酸式盐的化学式为 D、的稀溶液中存在8. 室温下,某实验小组借助传感器完成了下列两个实验。实验一:测得0.1mol·L-1NaHCO3溶液升温过程中溶液pH变化如图1所示。
实验二:向Na2CO3和NaHCO3的混合溶液中加入少量CaCl2溶液(溶液体积变化,温度变化忽略不计),测得溶液中离子浓度的关系如图2所示。

下列说法不正确的是( )
A、图1中25~45℃过程,溶液pH逐渐减小,说明HCO 及水的电离平衡正移对pH影响大于HCO 水解平衡正移对pH的影响 B、图1中45~60℃过程,溶液pH逐渐增大,原因是升高温度使NaHCO3的水解平衡正向移动 C、图2中a、b两点对应的溶液中pH较大的为a点 D、图2中b点对应的溶液中存在:2c(Ca2+)+c(Na+)+c(H+)=3c(CO )+c(OH-)+c(Cl-)9. T℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是( ) A、曲线I是CdCO3的沉淀溶解平衡曲线 B、加热可使溶液由X点变到Z点 C、Y点对应的Cd(OH)2溶液是过饱和溶液 D、T℃,在CdCO3(s)+2OH-(aq)⇌Cd(OH)2(s)+(aq)平衡体系中,平衡常数K=10210. 缓冲溶液可以将溶液pH控制在9.16~10.83范围内,时,、 , 下列说法不正确的是( )A、的溶液pH约为12 B、的溶液中,水电离产生的 C、的溶液中存在 D、的该缓冲溶液中存在:11. 下列说法正确的是( )A、0.1mol·L-1盐酸与氨水混合,所得溶液呈中性,则氨水浓度一定大于0.1mol·L-1 B、20mL0.10mol·L-1Na2CO3溶液中加入20mL某NaOH溶液,溶液碱性一定增强 C、将0.1mol·L-1'醋酸钠溶液加水稀释,溶液中所有离子浓度一定都减小 D、pH=a(a>0)的某酸HA溶液加水稀释至原体积的10b倍,则所得溶液的pH一定不大于(a+b)12. 在H2C2O4溶液中加入NaOH溶液,不断调整溶液pH,测绘H2C2O4、HC2O和C2O物质的量分数与pH关系图如图所示,[已知δ(X)=]。下列说法不正确的是( )
A、曲线I是CdCO3的沉淀溶解平衡曲线 B、加热可使溶液由X点变到Z点 C、Y点对应的Cd(OH)2溶液是过饱和溶液 D、T℃,在CdCO3(s)+2OH-(aq)⇌Cd(OH)2(s)+(aq)平衡体系中,平衡常数K=10210. 缓冲溶液可以将溶液pH控制在9.16~10.83范围内,时,、 , 下列说法不正确的是( )A、的溶液pH约为12 B、的溶液中,水电离产生的 C、的溶液中存在 D、的该缓冲溶液中存在:11. 下列说法正确的是( )A、0.1mol·L-1盐酸与氨水混合,所得溶液呈中性,则氨水浓度一定大于0.1mol·L-1 B、20mL0.10mol·L-1Na2CO3溶液中加入20mL某NaOH溶液,溶液碱性一定增强 C、将0.1mol·L-1'醋酸钠溶液加水稀释,溶液中所有离子浓度一定都减小 D、pH=a(a>0)的某酸HA溶液加水稀释至原体积的10b倍,则所得溶液的pH一定不大于(a+b)12. 在H2C2O4溶液中加入NaOH溶液,不断调整溶液pH,测绘H2C2O4、HC2O和C2O物质的量分数与pH关系图如图所示,[已知δ(X)=]。下列说法不正确的是( ) A、D点c(C2O)=c(H2C2O4),pH=2.7 B、A点与B点纵坐标相同,δ(X)均为50% C、向草酸溶液中滴加氢氧化钠溶液至pH为4.2时:c(Na+)+c(H+)=3c(C2O)+c(OH-) D、0.1mol·L-1NaHC2O4(aq)中:c(HC2O)>c(C2O)>(H2C2O4)13. 在25℃下,和溶液的随浓度变化如下表所示:
A、D点c(C2O)=c(H2C2O4),pH=2.7 B、A点与B点纵坐标相同,δ(X)均为50% C、向草酸溶液中滴加氢氧化钠溶液至pH为4.2时:c(Na+)+c(H+)=3c(C2O)+c(OH-) D、0.1mol·L-1NaHC2O4(aq)中:c(HC2O)>c(C2O)>(H2C2O4)13. 在25℃下,和溶液的随浓度变化如下表所示:实验序号
①
②
③
④
⑤
0.075
0.15
0.3
0.6
1.2
2.93
2.79
2.64
2.49
7.5
8.3
8.6
8.7
下列说法错误的是( )
A、实验①中,溶液由水电离产生的是的倍 B、实验②→③中,浓度变化2倍,变化小于 , 说明为弱酸 C、实验④中,溶液中离子总数大于溶液 D、实验⑤中,若将等体积的两溶液混合,已知:的 , 则有:14. 常温下,向1L1.0mol/L的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2的物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法正确的是( ) A、常温下,HClO电离平衡常数的数量级为10-7 B、a点溶液中存在 C、b点溶液中存在 D、c点溶液中15. 由于血液中存在如下平衡过程: 、 、 ,使血液的pH维持在7.35~7.45.如超出这个范围会造成酸中毒(pH过低)或碱中毒(pH过高),急性中毒时需静脉注射 或 进行治疗。下列叙述正确的是( )A、血液中 浓度过高会导致酸中毒,使血液中 的值增大 B、治疗碱中毒时,患者需降低呼吸频率,以增加血液中 浓度 C、急性酸中毒时,救治方式是静脉注射 溶液 D、酸或碱中毒时,会导致血液中的酶发生水解16. 下列物质溶于水后,溶液中仅含一种分子的是( )A、 B、 C、 D、17. 室温下H2SO4是二元强酸,其稀溶液中,第一步解离是完全的,第二步解离程度较低,HSO H++SO (K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )A、56 g单质铁与足量稀硫酸反应产生22.4 L H2 B、1 L 0.1 mol/L的硫酸溶液中,含H+的数目为0.2 NA C、室温下,NaHSO4溶液显碱性 D、稀硫酸溶液中存在关系:c(HSO )+c(OH-)+2c(SO )=c(H+)18. 下列说法错误的是( )A、升高HCl稀溶液温度,溶液中c(H+)不变 B、常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-) C、向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变 D、25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.019. 常温下,向amL浓度均为0.1mol·L-1的NaOH和一水合二甲胺[(CH3)2NH·H2O]的混合溶液中逐滴加入bmL0.1mol·L-1盐酸(已知一水合二甲胺在水中电离与一水合氨相似,常温下Kb[(CH3)2NH·H2O]=2.0×10-5)。下列说法错误的是( )A、b=0的溶液中有c(Na+)+c[(CH3)2NH ]=c(OH-)-c(H+) B、b=a所得溶液的pH值无法计算 C、b=1.5a所得溶液中有c[(CH3)2NH ]>c[(CH3)2NH·H2O] D、b=2a时水的电离程度最大20. 下列有关电解质溶液的叙述错误的是( )A、25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=l×10-10mol·L-1 B、25℃时,将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 C、25℃时,pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为1×10-11mol·L-1 D、温度一定时,CH3COOH和CH3COONa的混合溶液中, =21. 下列实验操作、现象和得出的结论全部正确的是( )
A、常温下,HClO电离平衡常数的数量级为10-7 B、a点溶液中存在 C、b点溶液中存在 D、c点溶液中15. 由于血液中存在如下平衡过程: 、 、 ,使血液的pH维持在7.35~7.45.如超出这个范围会造成酸中毒(pH过低)或碱中毒(pH过高),急性中毒时需静脉注射 或 进行治疗。下列叙述正确的是( )A、血液中 浓度过高会导致酸中毒,使血液中 的值增大 B、治疗碱中毒时,患者需降低呼吸频率,以增加血液中 浓度 C、急性酸中毒时,救治方式是静脉注射 溶液 D、酸或碱中毒时,会导致血液中的酶发生水解16. 下列物质溶于水后,溶液中仅含一种分子的是( )A、 B、 C、 D、17. 室温下H2SO4是二元强酸,其稀溶液中,第一步解离是完全的,第二步解离程度较低,HSO H++SO (K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )A、56 g单质铁与足量稀硫酸反应产生22.4 L H2 B、1 L 0.1 mol/L的硫酸溶液中,含H+的数目为0.2 NA C、室温下,NaHSO4溶液显碱性 D、稀硫酸溶液中存在关系:c(HSO )+c(OH-)+2c(SO )=c(H+)18. 下列说法错误的是( )A、升高HCl稀溶液温度,溶液中c(H+)不变 B、常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-) C、向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变 D、25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.019. 常温下,向amL浓度均为0.1mol·L-1的NaOH和一水合二甲胺[(CH3)2NH·H2O]的混合溶液中逐滴加入bmL0.1mol·L-1盐酸(已知一水合二甲胺在水中电离与一水合氨相似,常温下Kb[(CH3)2NH·H2O]=2.0×10-5)。下列说法错误的是( )A、b=0的溶液中有c(Na+)+c[(CH3)2NH ]=c(OH-)-c(H+) B、b=a所得溶液的pH值无法计算 C、b=1.5a所得溶液中有c[(CH3)2NH ]>c[(CH3)2NH·H2O] D、b=2a时水的电离程度最大20. 下列有关电解质溶液的叙述错误的是( )A、25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=l×10-10mol·L-1 B、25℃时,将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 C、25℃时,pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为1×10-11mol·L-1 D、温度一定时,CH3COOH和CH3COONa的混合溶液中, =21. 下列实验操作、现象和得出的结论全部正确的是( )实验操作
现象
结论
A
向某溶液中滴加稀HNO3 , 再加入过量的BaCl2溶液
产生白色沉淀
原溶液中一定含有SO
B
25℃时分别测定等物质的量浓度的NaHCO3溶液和NaHC2O4溶液的pH值
NaHCO3溶液的pH更大
酸性:H2CO3<H2C2O4
C
其他条件不变,将H2(g) + I2(g) 2HI(g)的平衡体系的容器体积增大为原来的10倍
气体颜色变浅
减小压强,平衡正向移动
D
将氯气和甲烷在光照下反应后的混合气体通入紫色石蕊试液
紫色石蕊试液变红
甲烷的氯代产物具有酸性
A、A B、B C、C D、D22. 饱和氯化钠溶液中存在如图所示过程,下列说法正确的是( ) A、a离子为Na+ , b离子为Cl- B、此过程中溶解速率大于结晶速率 C、再加入NaCl固体,溶质微粒浓度不变 D、此过程可以说明NaCl的电离:NaCl⇌Na++Cl-23. 古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是( )
A、a离子为Na+ , b离子为Cl- B、此过程中溶解速率大于结晶速率 C、再加入NaCl固体,溶质微粒浓度不变 D、此过程可以说明NaCl的电离:NaCl⇌Na++Cl-23. 古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是( )选项
传统文化
化学角度解读
A
本草经集注 记载“如握盐雪不冰,强烧之,紫青烟起 云是真硝石也
利用物理方法可以检验钠盐和钾盐
B
“司南之杓 勺 ,投之于地,其柢 勺柄 指南”
司南中“杓”的材质为Fe3O4
C
本草图经 在绿矾项记载:“盖此矾色绿,味酸,烧之则赤 ”
因为绿矾能电离出H+ , 所以“味酸”
D
兰陵美酒郁金香,玉碗盛来琥珀光
“香”主要因为美酒含有酯类物质
A、A B、B C、C D、D二、多选题
-
24. 25℃时,0.100mol/L二元弱酸(或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数(或)的关系如下图所示,下列说法正确的是( )
 A、曲线①表示盐酸滴定溶液 B、25℃时, C、溶液中:a点比b点大 D、c点溶液中:25. 用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定终点附近溶液pH和导电能力的变化分别如图所示。下列说法正确的是( )
A、曲线①表示盐酸滴定溶液 B、25℃时, C、溶液中:a点比b点大 D、c点溶液中:25. 用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定终点附近溶液pH和导电能力的变化分别如图所示。下列说法正确的是( ) A、HA为一元弱酸 B、b点对应的溶液中:c(A-)>c(Na+) C、根据溶液pH和导电能力的变化可判断V2<V3 D、a、b、c三点对应的溶液中水的电离程度依次减小
A、HA为一元弱酸 B、b点对应的溶液中:c(A-)>c(Na+) C、根据溶液pH和导电能力的变化可判断V2<V3 D、a、b、c三点对应的溶液中水的电离程度依次减小三、非选择题
-
26. CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。(1)、I.①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1 ,
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4 , 发生如下反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=。
(2)、II.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。

250~300℃时,乙酸的生成速率减小的原因是。
②为了提高该反应中CH4的转化率,可以采取的措施是。
(3)、III.已知:某酸HA Ka=4.0×10–7(298K)。25℃时,向100mL 0.1mol·L−1 HA的溶液中逐滴加0.2mol·L−1NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计) 。
。①25℃时,0.1mol·L−1HA溶液中的c(H+)=mol·L-1。
②在X点时,溶液中各离子浓度由大到小的排列顺序是。
③在K点时,溶液中c(OH-)+c(A-)-c(H+)=mol·L−1。
27. 某研究性学习小组为探究醋酸的电离情况,进行了如下实验:(1)、取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对该醋酸溶液的浓度进行标定。①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。解稀释过程中a、b、c点对应溶液的pH由大到小的顺序为。

②为标定稀释所得醋酸溶液的准确浓度,用0.2000mol/L的NaOH标准溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
实验序号
1
2
3
4
消耗NaOH溶液的体积(mL)
20.05
20.00
18.80
19.95
该醋酸溶液的准确浓度为mol/L。上述标定过程中,会造成测定结果偏高的原因可能是(填字母)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)、该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度醋酸的pH,其结果如表:醋酸浓度(mol/L)
0.0010
0.0100
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.73
①根据表中数据,可得出醋酸是弱电解质的结论,你认为得出此结论的依据是。
②从表中数据还可得出另一结论:随着醋酸浓度的增大,醋酸的电离程度将(填“增大”、“减小”或“不变”)。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:。
28. 电解质溶液与生产、生活密切相关。(1)、Ⅰ. 在室温下,下列四种溶液:①溶液 ②溶液
③溶液 ④和混合液
请根据要求回答下列问题:
溶液①显酸性,其原因是(用离子方程式表示)。
(2)、在溶液④中(填离子符号)的浓度为;和(填离子符号)的浓度之和为。(3)、室温下,测得溶液②的 , 则说明的水解程度(填“”“”或“”,下同)的水解程度,该溶液中与浓度的大小关系是c(CH3COO-)c(NH)(4)、Ⅱ.医学上在进行胃肠疾病的检查时,利用X射线对穿透能力较差的特性,常用做内服造影剂,这种检查手段称为钡餐透视。请用文字叙述和离子方程式说明钡餐透视时为什么不用?。
(5)、某课外活动小组为探究的溶解度,分别将足量放入:①水 ②的溶液 ③的溶液④的溶液中,溶解至饱和。以上各溶液中,的大小顺序正确的是 , 的溶解度的大小顺序为(填序号)。
A.③>①>④>② B.③>①>②>④ C.①>④>③>② D.①>③>④>②
(6)、某同学取同样的溶液③和溶液④直接混合,则混合溶液的为(假设混合后溶液的体积为混合前两溶液的体积之和)。29. 对于成千上万、形形色色的化学物质,用分类的思想对其进行学习和研究极其重要。有以下物质,请按要求作答。① ② ③熔融 ④盐酸 ⑤葡萄糖溶液⑥ ⑦胶体 ⑧ ⑨细铁丝 ⑩
(1)、上述物质能导电的有(填序号,下同),属于电解质的有。(2)、请写出②与④反应的化学方程式。(3)、胶体是一类重要的分散系,请写出实验室制备⑦的化学方程。(4)、向⑩的水溶液中逐滴滴加⑧的水溶液,溶液的导电能力变化曲线如图中的(填字母),当溶液恰好呈中性时与的物质的量之比为。 30.(1)、现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
30.(1)、现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):Ⅰ、以上物质中属于电解质的是。
Ⅱ、以上物质中属于非电解质的是。
Ⅲ、请写出①在水溶液中的电离方程式。
(2)、维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+ , 这说明维生素C具有(填“氧化性”或“还原性”)。(3)、当光束通过下列物质时,会出现丁达尔效应的是。①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(4)、用单线桥标出下列反应中电子转移的情况:。8NH3+6NO2 7N2+12H2O
(5)、请写出最恰当的试剂除去括号中的杂质:CO2(HCl)31. 室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1 的盐酸和醋酸,如图所示。 (1)、表示滴定盐酸的曲线是。(填I或II)(2)、当醋酸中滴入10 mL NaOH溶液时,溶液中含有的溶质有:;溶液中离子浓度由大到小顺序为:。(3)、当醋酸中滴入20 mL NaOH溶液时,将所得溶液加热,溶液pH随温度变化如图所示。下列说法正确的是。(填序号)
(1)、表示滴定盐酸的曲线是。(填I或II)(2)、当醋酸中滴入10 mL NaOH溶液时,溶液中含有的溶质有:;溶液中离子浓度由大到小顺序为:。(3)、当醋酸中滴入20 mL NaOH溶液时,将所得溶液加热,溶液pH随温度变化如图所示。下列说法正确的是。(填序号)a. 加热促进水的电离和醋酸钠水解
b. 加热使溶液碱性减弱
c. 加热使溶液中c(H+)/c(OH-)比值减小
 32. 海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。(1)、①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法错误的是(填字母序号)。
32. 海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。(1)、①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法错误的是(填字母序号)。
a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是。
(2)、海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2 , 该过程的离子方程式是。
(3)、洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2 , 是一种处理的有效方式。①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是。
②上述方式使处理后海水pH升高的原因是。
33.(1)、I.实验室用 标准溶液滴定未知浓度的盐酸。
盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的操作。(填“甲”、“乙”、“丙”)
(2)、选择酚酞作为指示剂,滴定终点的现象为。(3)、下列操作会导致实验结果偏低的是_________。(填标号)A、碱式滴定管未用标准NaOH溶液润洗 B、盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 C、滴定终点读数时,仰视滴定管的刻度 D、滴定过程中振荡锥形瓶,液体不慎溅出(4)、某学生进行3次实验得到相关数据如表所示。滴定次数
待测盐酸的体积/mL
消耗 溶液的体积/mL
滴定前读数
滴定后读数
第一次
25.00
0.00
26.11
第二次
25.00
1.56
30.30
第三次
25.00
0.22
26.31
则盐酸的物质的量浓度为 。(保留三位小数)
(5)、II.一定浓度的H2SO4溶液中所含硫元素所有微粒的物质的量分数随pH的变化如图2所示。
NaHSO4在水中电离方程式为。
(6)、图中a、b、c三点,水电离的 由大到小的顺序分为。(用a、b、c表示)(7)、pH=3时, 。

