高考二轮复习知识点:电解质在水溶液中的电离2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 水溶液呈酸性的是( )A、 B、 C、 D、2. 下列说法错误的是( )A、 的盐酸中 B、将 溶液从常温加热至 ,溶液的 变小但仍保持中性 C、常温下, 溶液呈碱性,说明 是弱电解质 D、常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大3. 设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )A、每升溶液中的H+数目为0.02NA B、c(H+)= c( H2PO4- )+2c( HPO42- )+3c( PO43- )+ c(OH−) C、加水稀释使电离度增大,溶液pH减小 D、加入NaH2PO4固体,溶液酸性增强4. NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×10−3 , Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
 A、混合溶液的导电能力与离子浓度和种类有关 B、Na+与A2−的导电能力之和大于HA−的 C、b点的混合溶液pH=7 D、c点的混合溶液中,c(Na+)>c(K+)>c(OH−)5. 设为阿伏加德罗常数的值,下列说法正确的是A、盐酸中含有个分子 B、已知核反应: , 则1mol中含有中子数55 C、与一定量浓硫酸反应后完全溶解,生成气体的分子数等于 D、溶液中与离子数之和小于6. 下列说法正确的是A、常温下,等pH的与溶液的导电性相同 B、溶液呈酸性,是由于水解大于电离 C、常温下,pH=3的①溶液②HCl溶液③溶液中水电离程度:③>②=① D、常温下,的NaOH溶液,加水稀释10倍,所得溶液7. 次磷酸()是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成 , 下列叙述错误的是( )A、的水溶液加水稀释,增大 B、溶液中存在电离平衡: C、溶液中: D、溶液中存在:8. 常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
A、混合溶液的导电能力与离子浓度和种类有关 B、Na+与A2−的导电能力之和大于HA−的 C、b点的混合溶液pH=7 D、c点的混合溶液中,c(Na+)>c(K+)>c(OH−)5. 设为阿伏加德罗常数的值,下列说法正确的是A、盐酸中含有个分子 B、已知核反应: , 则1mol中含有中子数55 C、与一定量浓硫酸反应后完全溶解,生成气体的分子数等于 D、溶液中与离子数之和小于6. 下列说法正确的是A、常温下,等pH的与溶液的导电性相同 B、溶液呈酸性,是由于水解大于电离 C、常温下,pH=3的①溶液②HCl溶液③溶液中水电离程度:③>②=① D、常温下,的NaOH溶液,加水稀释10倍,所得溶液7. 次磷酸()是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成 , 下列叙述错误的是( )A、的水溶液加水稀释,增大 B、溶液中存在电离平衡: C、溶液中: D、溶液中存在:8. 常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是( )
A、曲线I和II对应的酸分别为HY和HX B、相比曲线I,曲线II选用酚酞作终点指示剂误差更小 C、把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1 D、0.01mol/L弱酸HX和HY电离度之比为1:109. 25℃时,某混合溶液中c(H2A)+c(HA-)+c(A2-)=0.01 mol·L-1 , 由水电离出的c水(H+)的对数1g c水(H+)与的关系如图所示。下列说法正确的是( ) A、曲线L1表示1g c水(H+)与的变化关系 B、Y点时存在c(H2A)=c(HA-)=c(A2-) C、X点时溶液的pH=5 D、Ka2(H2A)=10-810. 相同温度和压强下,研究Cl2分别在不同浓度的盐酸和NaCl溶液中的溶解度(用溶解Cl2的物质的量浓度表示)变化如图所示。
A、曲线L1表示1g c水(H+)与的变化关系 B、Y点时存在c(H2A)=c(HA-)=c(A2-) C、X点时溶液的pH=5 D、Ka2(H2A)=10-810. 相同温度和压强下,研究Cl2分别在不同浓度的盐酸和NaCl溶液中的溶解度(用溶解Cl2的物质的量浓度表示)变化如图所示。
已知氯气溶解存在以下过程:
①Cl2(aq)+H2O(l)H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4
②Cl2(aq)+Cl-(aq)Cl(aq) K2=0.19
③HClO(aq)H+(aq)+ClO-(aq) Ka=3.2×10-8
下列说法错误的是( )
A、随着NaCl浓度的增大,Cl2溶解度减小,溶液中减小 B、随着盐酸浓度的增大,反应①被抑制,反应②为主要反应从而促进Cl2溶解 C、a点时,c(H+)>c(Cl-)>c(Cl)>c(ClO-) D、b点时,c(HClO)+c(ClO-)+c(Na+)=c(Cl-)+c(Cl)11. 常温下,向某浓度的二元弱酸H2X溶液中逐滴加入NaOH稀溶液,所得溶液中三种微粒H2X、HX-、X2-的物质的量分数(δ)与溶液pH的关系如图所示。下列叙述错误的是( ) A、M →A反应的离子方程式为: H2X+OH- = HX- + H2O B、B点的溶液中: c(Na+)> 3c(X2-) C、NaHX溶液中: c(OH-)+ c(X2-)= c(H+) + c(H2X) D、外界条件不变时,加入NaOH稀溶液的过程中,=10, 且始终保持不变12. 甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述错误的是( )
A、M →A反应的离子方程式为: H2X+OH- = HX- + H2O B、B点的溶液中: c(Na+)> 3c(X2-) C、NaHX溶液中: c(OH-)+ c(X2-)= c(H+) + c(H2X) D、外界条件不变时,加入NaOH稀溶液的过程中,=10, 且始终保持不变12. 甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述错误的是( ) A、图中a=2.7,b=7 B、该过程中, 增大 C、Q点溶液中溶质为CH3NH3Cl和CH3NH2 D、N点溶液中:c( )=c(Cl-)13. 25℃时,下列说法正确的是( )A、N2H4的水溶液呈弱碱性,Kb1≈1.0×10-6 , 则0.01mol·L-1 N2H4水溶液的pH≈10 B、向NaHSO3溶液中加入少量的I2 , 则溶液中将减小 C、中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多 D、pH=7的某溶液,溶质对水的电离平衡肯定无影响14. 常温时,向溶液中逐滴加入的氨水,导电能力、pH与的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
A、图中a=2.7,b=7 B、该过程中, 增大 C、Q点溶液中溶质为CH3NH3Cl和CH3NH2 D、N点溶液中:c( )=c(Cl-)13. 25℃时,下列说法正确的是( )A、N2H4的水溶液呈弱碱性,Kb1≈1.0×10-6 , 则0.01mol·L-1 N2H4水溶液的pH≈10 B、向NaHSO3溶液中加入少量的I2 , 则溶液中将减小 C、中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多 D、pH=7的某溶液,溶质对水的电离平衡肯定无影响14. 常温时,向溶液中逐滴加入的氨水,导电能力、pH与的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( ) A、水的电离程度: B、 , 该温度下的 C、该温度下反应的平衡常数的数量级为 D、a点对应的溶液中存在15. 水溶液呈酸性的盐是( )A、HNO2 B、NaHCO3 C、NaCl D、KHSO416. H3PO2是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成NaH2PO2 , 下列叙述正确的是( )A、NaH2PO2的溶液呈碱性 B、0.01mol/LH3PO2水溶液加水稀,pH减小 C、H3PO2溶液中存在电离平衡: D、0.01mol/L溶液中存在:17. 已知时的 , 下列说法正确的是( )A、分别测定某醋酸溶液样品、溶液样品的发现前者小于后者,可推测的 B、的溶液中加入的溶液,当溶液中水的电离程度与纯水相同时,可能大于 C、向的溶液中加入的溶液充分反应,所得溶液中 D、将的溶液与的盐酸混合,的电离度增大
A、水的电离程度: B、 , 该温度下的 C、该温度下反应的平衡常数的数量级为 D、a点对应的溶液中存在15. 水溶液呈酸性的盐是( )A、HNO2 B、NaHCO3 C、NaCl D、KHSO416. H3PO2是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成NaH2PO2 , 下列叙述正确的是( )A、NaH2PO2的溶液呈碱性 B、0.01mol/LH3PO2水溶液加水稀,pH减小 C、H3PO2溶液中存在电离平衡: D、0.01mol/L溶液中存在:17. 已知时的 , 下列说法正确的是( )A、分别测定某醋酸溶液样品、溶液样品的发现前者小于后者,可推测的 B、的溶液中加入的溶液,当溶液中水的电离程度与纯水相同时,可能大于 C、向的溶液中加入的溶液充分反应,所得溶液中 D、将的溶液与的盐酸混合,的电离度增大二、多选题
-
18. 室温下,将两种浓度均为 的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )A、 混合溶液(pH=10.30): B、氨水-NH4Cl混合溶液(pH=9.25): C、 混合溶液(pH=4.76): D、 混合溶液(pH=1.68,H2C2O4为二元弱酸):19. 25℃时,0.10mol·L-1HCOONH4溶液中lgc(HCOOH)、lgc(NH3·H2O)、lgc(H+)和lgc(OH-)随pH变化(加入HCl或NaOH)的关系如图所示。已知:Ka(HCOOH)=1.8×10-4 , Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
 A、原溶液中,+c(OH-)=+c(H+) B、该体系中,c(NH3·H2O)-c(HCOOH)=c(NH)-c(HCOO-) C、N点时,c(HCOO-)=c(NH)>c(H+)=c(OH-) D、M点时,pH=6.520. 常温下,向 某一元碱 溶液中逐滴加入 的 溶液,溶液中 中和率的变化如图所示。 为 的电离常数, 下列说法正确的是( )
A、原溶液中,+c(OH-)=+c(H+) B、该体系中,c(NH3·H2O)-c(HCOOH)=c(NH)-c(HCOO-) C、N点时,c(HCOO-)=c(NH)>c(H+)=c(OH-) D、M点时,pH=6.520. 常温下,向 某一元碱 溶液中逐滴加入 的 溶液,溶液中 中和率的变化如图所示。 为 的电离常数, 下列说法正确的是( )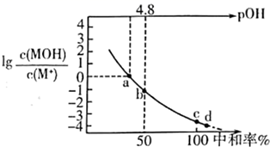 A、溶液中水的电离程度从a点到d点逐渐增大 B、a点时, C、b点时, D、c点时,21. 常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( )
A、溶液中水的电离程度从a点到d点逐渐增大 B、a点时, C、b点时, D、c点时,21. 常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( ) A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-22. 常温下,向H2C2O4溶液中逐滴滴加NaOH溶液,若定义pc=-lgc,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是( )
A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-22. 常温下,向H2C2O4溶液中逐滴滴加NaOH溶液,若定义pc=-lgc,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是( ) A、常温下,Ka1(H2C2O4)=10-1.3 B、pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-) C、M点时,c(Na+)<2c(HC2O4-)+c(C2O42-) D、 随pH的升高而增大
A、常温下,Ka1(H2C2O4)=10-1.3 B、pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-) C、M点时,c(Na+)<2c(HC2O4-)+c(C2O42-) D、 随pH的升高而增大三、非选择题
-
23. 从铜电解液中分离得到的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。

已知:i.含镍溶液中的主要离子有:Ni2+、SO、Cu2+、Fe2+、AsO、Ca2+和Zn2+
ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
物质
电离常数
物质
溶度积常数
物质
溶度积常数
H2S
Ka1=1.1×10−7
Ka2=1.3×10−13
CuS
6.3×10−36
FeS
6.3×10−18
NiS
3.2×10−19
Ni(OH)2
5.5×10−16
CaF2
4×10−11
Fe(OH)3
2.8×10−39
(1)、H2S是弱电解质,Ka1×Ka2=[用c(H2S)、c(H+)和c(S2−)表示]=1.43×10−20。(2)、滤渣1中含有As2S3和S,写出生成As2S3和S的离子方程式。(3)、解释“氧化除杂”中析出Fe(OH)3的原因。(4)、“氟化除杂”中试剂a为。(5)、“P204萃取”水溶液的pH约为3.3,结合下图解释原因。 (6)、理论上“硫化除杂”之后,溶液中c(Cu2+)=mol/L[计算时c(H2S)取0.1mol/L,结果保留两位有效数字]。24.(1)、多硫化钠( )是一系列含多硫离子的化合物,有 等,各原子均满足 稳定结构,其中 的电子式是。(2)、水因质子自递( )能导电,无水硫酸也能导电,其原因是(用化学用语表示)。(3)、青蒿素结构如图,只能在低温条件下萃取青滿索是因其分子中的某个基团对热不稳定,且该基团能与NaI反应生成 。该基团的结构式为。
(6)、理论上“硫化除杂”之后,溶液中c(Cu2+)=mol/L[计算时c(H2S)取0.1mol/L,结果保留两位有效数字]。24.(1)、多硫化钠( )是一系列含多硫离子的化合物,有 等,各原子均满足 稳定结构,其中 的电子式是。(2)、水因质子自递( )能导电,无水硫酸也能导电,其原因是(用化学用语表示)。(3)、青蒿素结构如图,只能在低温条件下萃取青滿索是因其分子中的某个基团对热不稳定,且该基团能与NaI反应生成 。该基团的结构式为。 25. 某兴趣小组用白云石(主要含CaCO3 和MgCO3)和废铝屑制备一种化合物12CaO·7Al2O3。
25. 某兴趣小组用白云石(主要含CaCO3 和MgCO3)和废铝屑制备一种化合物12CaO·7Al2O3。
相关信息如下:
①MgCO3 分解温度低于 CaCO3;
②金属离子形成氢氧化物沉淀的 pH 范围:
金属离子
pH
开始沉淀
完全沉淀
Ca2+
11.3
-
Mg2+
8.4
10.9
③AlCl3 易水解,易升华。请回答:
(1)、从煅粉经一系列操作可制备纯净的CaCO3。请给出合理的操作排序(从下列操作中选取,按先后次序列出字母) :煅粉→加入适量 NH4NO3 溶液→( )→()→()→通入 NH3 和 CO2 , 控制pH<11.0→过滤→洗涤→CaCO3
a.过滤 b.控制 pH=11.0 c.控制 pH=8.0 d.取滤渣加水形成悬浊液 e.取滤液
(2)、煅粉加入 NH4NO3 溶液发生反应的离子方程式是。(3)、通入 NH3 和 CO2 时,需控制 pH<11.0 的原因是。(4)、下列说法正确的是_________。A、煅烧时,需用玻璃棒不断搅拌坩埚中固体,使其受热均匀 B、煅烧时产生 CO2 的体积恰好等于制备 CaCO3 时需要通入 CO2 的体积(已换算为相同状况) C、NH4NO3 溶液还可用(NH4)2SO4、NH4HCO3 等溶液代替 D、过滤时,应选用玻璃砂漏斗,以免滤纸被溶液腐蚀(5)、废铝屑需要先放在乙醇和丙酮混合溶液中,放入超声波清洗器中清洗 30 分钟,目的是。取出晾干,用以下装置制备 AlCl3 溶液。请为虚线框中补充必须的装置,并按连接顺序排列 (填写代表装置的字母,不考虑橡皮管连接)。 26. 食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。的应用与其电离平衡密切相关。25℃时,的。(1)、写出醋酸(用表示)的电离方程式:。(2)、25℃时,的水解常数。(3)、某小组研究25℃下电离平衡的影响因素。
26. 食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。的应用与其电离平衡密切相关。25℃时,的。(1)、写出醋酸(用表示)的电离方程式:。(2)、25℃时,的水解常数。(3)、某小组研究25℃下电离平衡的影响因素。提出假设:稀释溶液或改变浓度,电离平衡会发生移动。设计方案并完成以下实验用浓度均为的和溶液,按下表配制总体积相同的系列溶液;测定 , 记录数据。
序号
I
40.00
/
/
0
2.86
II
4.00
/
36.00
0
3.36
…
VII
4.00
a
b
4.53
VIII
4.00
4.00
32.00
4.65
①根据表中信息,补充数据:a= , b=。
②由实验I和II可知,稀释溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据,给出判断理由:。
(4)、小组分析上表数据发现:随着的增加,的值逐渐接近的。查阅资料获悉:一定条件下,按配制的溶液中,的值等于的。对比数据发现,实验VIII中与资料数据存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定溶液的浓度再验证。①移取溶液于锥形瓶中,加入2滴溶液R,用溶液滴定至终点,消耗体积为 , 则R是(填名称),该溶液的浓度为。
(5)、小组进一步提出:如果只有浓度均约为的和溶液,如何准确测定的?小组同学设计方案并进行实验。请完成下表中II的内容:I
移取溶液,用溶液滴定至终点,消耗溶液
II
(填实验操作步骤),测得溶液的为4.76
实验总结得到的结果与资料数据相符,方案可行。
27. 下列是四种状态下NaCl的图示(M、N均为惰性电极),完成下列各题。①
②
③
④




 (1)、①中存在Na+和Cl- , 但①不能导电,请说明理由。(2)、结合图示信息和所学知识,判断下列说法正确的是____。A、由②③可知,a为Cl- , b为Na+ B、在③中,只存在Na+和Cl-两种微粒 C、①中的氯化钠晶体变为②中的a和b的过程,称为电解 D、NaCl溶于水时,在H2O分子作用下,Na+和Cl-脱离固体表面进入水中,与H2O结合成自由移动的水合Na+和水合Cl-(3)、写出③状态下发生反应的化学方程式。可用于检验N极产生气体的试剂是。
(1)、①中存在Na+和Cl- , 但①不能导电,请说明理由。(2)、结合图示信息和所学知识,判断下列说法正确的是____。A、由②③可知,a为Cl- , b为Na+ B、在③中,只存在Na+和Cl-两种微粒 C、①中的氯化钠晶体变为②中的a和b的过程,称为电解 D、NaCl溶于水时,在H2O分子作用下,Na+和Cl-脱离固体表面进入水中,与H2O结合成自由移动的水合Na+和水合Cl-(3)、写出③状态下发生反应的化学方程式。可用于检验N极产生气体的试剂是。A.稀盐酸 B.氢氧化钠溶液 C.淀粉碘化钾溶液 D.硝酸银溶液
(4)、由④可知M与电源的(填“正极”或“负极”)相连。由③④可知电解质导电的条件是。(5)、若用“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子。如图四种变化中,能体现水“参与”“化学变化”的微观本质是____。 A、
”表示氧原子。如图四种变化中,能体现水“参与”“化学变化”的微观本质是____。 A、 B、
B、 C、
C、 D、
D、 28. 滴定是一种定量分析的方法,在科学研究中具有广泛的应用。(1)、对比盐酸和醋酸分别与的反应
28. 滴定是一种定量分析的方法,在科学研究中具有广泛的应用。(1)、对比盐酸和醋酸分别与的反应室温下,用0.1mol/LNaOH溶液分别滴定20mL0.1mol/L的醋酸和盐酸溶液,滴定过程中溶液pH的变化曲线如下图所示。

①曲线Ⅱ表示滴定盐酸的过程,判断的理由是。
②a点溶液中,离子浓度大小关系为。
③b点溶液中,由水电离的。
④时, (填“>”“<”或“=”,下题同)。
⑤c点溶液中b点的。
(2)、测定某些物质的含量。如测定血液中钙的含量时,进行如下实验:
ⅰ可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成沉淀,过滤、洗涤,将沉淀用稀硫酸处理得溶液。
ⅱ将ⅰ得到的溶液,再用酸性溶液滴定,氧化产物为 , 还原产物为。
ⅲ终点时用去的溶液。
①写出用酸性溶液滴定的离子方程式。
②如何判定滴定终点。
③计算:血液中含钙离子的浓度为(用字母表示)。
29. 25℃时有以下 5 种溶液:①0.10mol/LHCl 溶液②0.10mol/LCH3COOH 溶液③0.10mol/LNaOH 溶液④0.10mol/LNH4Cl 溶液⑤饱和 FeCl3 溶液。(1)、溶液①的 pH7(填“>”、“<”或者“=”)。(2)、写出 CH3COOH 的电离方程式。(3)、将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是(4)、用广泛pH 试纸测得④的 pH=5,请结合化学用语对 NH4Cl 溶液显酸性的原因进行完整说明。(5)、加热⑤可制备 Fe(OH)3 胶体,请结合化学用语解释。30. 甲烷、甲醇(CH3OH)、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物, 广泛应用于化工、医药、能源等方面,研究“一碳”化合物的化学称为“一碳”化学。(1)、已知: HCHO(g )+H2(g)=CH3OH(g) △H1= - 84kJ/molCO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2= - 49.5 kJ/mol
则反应CO2(g)+ 2H2(g)=HCHO(g)+H2O(g) △H3=kJ/mol
(2)、工业上合成甲醇的反应: CO(g)+ 2H2(g) CH3OH(g) △H4 , 在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如下图所示。
①压强p1 P2(填“大于”或“小于”), 该反应达到平衡的标志是(填标号)。
A.反应速率v正(H2) =2v逆(CH3OH )
B.容器内CO和H2物质的量之比为1:2.
C.混合气体的质量不再变化
D.混合气体的平均摩尔质量不再变化
②a点条件下,H2的平衡转化率为 , 该温度下达到平衡后,在容积不变的条件下再充入mol CO和mol CH3OH,平衡(填“ 正向” “逆向”或“不”)移动,新平衡时的逆反应速率 (填“大于” “等于”或“小于”)原平衡。
(3)、工业上用甲醇可以制备甲胺(CH3NH2),甲胺与氨在水中的电离方式相似。则甲胺在水中的电离方程式为 , 常温下,反应CH3NH2·H2O(aq)+H+(aq) CH3NH(aq)+ H2O(1)的平衡常数K=2.5×104 , 该温度下,甲胺的电离常数Kb=(填数值)。31. 如图所示,先在小烧杯中加入0.01 mol/L Ba(OH)2溶液50mL,再滴入几滴酚酞溶液,接通电源,可观察到小灯泡变亮。 (1)、从物质类别看,Ba(OH)2属于 , 它在水中电离的方程式是;小灯泡变亮的原因是。(2)、向小烧杯中滴加0.2 mol/L H2SO4溶液,观察到以下现象,按要求填写产生对应现象的原因:
(1)、从物质类别看,Ba(OH)2属于 , 它在水中电离的方程式是;小灯泡变亮的原因是。(2)、向小烧杯中滴加0.2 mol/L H2SO4溶液,观察到以下现象,按要求填写产生对应现象的原因:序号
现象
产生该现象的原因
1
酚酞颜色变浅直至褪去
用化学用语表达:①。
2
产生白色沉淀
用化学用语表达:②。
3
小灯泡变暗直至熄灭
文字表达:③。
4
小灯泡又变亮
用化学用语表达:④。
32. 常温下,有以下五种溶液:编号
①
②
③
④
⑤
溶液
醋酸
硫酸
氨水
氢氧化钠
氯化铵
3
3
11
11
3
请回答以下问题:
(1)、向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①(填“>”、“<”或“=”)v② , 若收集等体积的 , 则消耗时间更短的是(填化学式),醋酸和锌反应的离子方程式为。(2)、若向⑤溶液中加入少量④,⑤的将(填“增大”、“减小”或“不变”,下同);若加入少量②,⑤的水解程度将。(3)、将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的由大到小的顺序是(填编号)。(4)、分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是(填化学名称)。(5)、将等体积的①和②溶液混合后,加入蒸馏水,溶液中将(填“增大”、“减小”或“不变”)。(6)、①,②,③,④,⑤五种溶液中由水电离出的浓度由大到小的顺序是(填编号)。33. 强弱电解质在水中的行为是不同的。(1)、醋酸在水中的电离方程式为。(2)、室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的醋酸和盐酸溶液,滴定曲线如图所示。
①II表示滴定的曲线(填“盐酸”或“醋酸”)。
②当滴定到pH=7时,消耗NaOH溶液的体积大的是(填“盐酸”或“醋酸”)。
③当V(NaOH)=10.00mL时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是。
④在上述滴定过程中,需要使用的玻璃仪器是(填序号)。
A.碱式滴定管 B.锥形瓶 C.容量瓶 D.玻璃棒
34. 常温时,向体积均为V0、浓度均为1mol/L的HClO2和HBF4两种酸溶液中分别加水,稀释至体积为V,稀释过程中溶液pH随()的变化如下图所示。
回答下列问题:
(1)、HBF4为酸(填“强”或“弱”)。(2)、HClO2的电离方程式为。(3)、b→c过程中,HBF4溶液被稀释了倍。(4)、中和等体积、pH均为3的这两种酸溶液,消耗NaOH的物质的量较多的是(写出化学式)。(5)、依据a点,Ka(HClO2)=(结果保留两位有效数字)。35. 在实验室探究温度对盐溶液和水的pH的影响,测得0.1 mol/LCuSO4溶液、0.1 mol/L Na2SO3溶液以及H2O的pH随温度变化的曲线如图所示。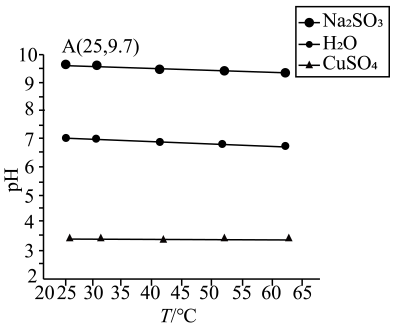
回答下列问题:
(1)、温度升高H2O的pH减小,c(H+)c(OH-)(填“>”、“<”或“=”)。(2)、加热 CuSO4溶液pH变小,试结合化学用语解释原因。(3)、常温时向Na2SO3溶液滴加2滴酚酞,现象是;恢复至室温与加热前相比Kw(填“增大”、“减小”或“不变”);计算25℃时,H2SO3的Ka2的值为(忽略水的电离及的二级水解)。(4)、向加热前后的Na2SO3溶液中滴加盐酸酸化的BaCl2溶液,发现加热后的溶液中产生的白色沉淀更多。试以此分析Na2SO3溶液pH随温度升高而降低的原因:①;②温度升高Kw增大。