高考二轮复习知识点:强电解质和弱电解质
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 硫酸铜应用广泛,下列说法错误的是A、元素位于周期表p区 B、硫酸铜属于强电解质 C、硫酸铜溶液呈酸性 D、硫酸铜能使蛋白质变性2. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法错误的是( )A、醋酸钠是强电解质 B、醋酸钠晶体与冰都是离子晶体 C、常温下,醋酸钠溶液的 D、该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出3. 下列物质属于强电解质的是( )A、 B、 C、 D、4. 下列物质属于弱电解质的是( )A、CO2 B、H2O C、HNO3 D、NaOH5. 下列物质属于强电解质的是( )A、KOH B、H3PO4 C、SO3 D、CH3CHO6. 能证明乙酸是弱酸的实验事实是( )A、CH3COOH溶液与Zn反应放出H2 B、0.1 mol/L CH3COONa溶液的pH大于7 C、CH3COOH溶液与NaCO3反应生成CO2 D、0.1 mol/L CH3COOH溶液可使紫色石蕊变红7. 下列属于弱电解质的是( )A、CaCO3 B、SO2 C、NH3·H2O D、Ba(OH)28. 以下物质属于弱电解质的是( )A、乙醇 B、乙酸 C、次氯酸钠 D、高锰酸钾9. 室温下,等体积的溶液和溶液,下列叙述正确的是A、钠离子浓度相同 B、滴入几滴稀盐酸,均无明显现象 C、水电离的总浓度均为 D、滴入少量溶液,均得到沉淀10. 室温下,t1时刻向两个盛有50mL蒸馏水的烧杯中分别加入①1gCaCO3、②1g蔗糖,搅拌,最终分别得到悬浊液和澄清溶液,溶解过程中分散系的导电能力变化如图。

下列分析错误的是
A、该实验可证明蔗糖不是电解质 B、该实验可证明碳酸钙是强电解质 C、当①中导电能力不变时,CaCO3(s)Ca2+(aq)+CO(aq)达到平衡 D、t2时刻,①中再加1gCaCO3 , 导电能力不变11. 食醋是烹饪美食的调味品,其有效成分主要是醋酸(),下列说法正确的是A、属于离子晶体 B、含有非极性共价键 C、属于强电解质 D、含有酸基12. 下列化学概念或化学用语叙述正确的是A、属于弱电解质 B、四氯化碳充填模型可表示为 C、和互为同素异形体
D、的结构式为
13. 将4份等量的铝片分别加到足量的下列溶液中充分反应后,产生氢气量最快的是A、溶液 B、溶液 C、溶液 D、溶液14. 下列属于弱电解质的是A、Na B、HClO C、BaSO4 D、NaOH15. 下列厨房中常用物质的主要成分属于强电解质的是A、醋酸 B、自来水 C、小苏打 D、淀粉16. 已知溶于水发生电离。某工业制硼的有机合物的催化过程如下(其中R、Ln为基团,Pd为钯元素,X为卤素元素),下列说法正确的是( )
C、和互为同素异形体
D、的结构式为
13. 将4份等量的铝片分别加到足量的下列溶液中充分反应后,产生氢气量最快的是A、溶液 B、溶液 C、溶液 D、溶液14. 下列属于弱电解质的是A、Na B、HClO C、BaSO4 D、NaOH15. 下列厨房中常用物质的主要成分属于强电解质的是A、醋酸 B、自来水 C、小苏打 D、淀粉16. 已知溶于水发生电离。某工业制硼的有机合物的催化过程如下(其中R、Ln为基团,Pd为钯元素,X为卤素元素),下列说法正确的是( ) A、是三元酸 B、和微粒中原子周围都达到8个电子结构 C、LnPb是催化剂,
A、是三元酸 B、和微粒中原子周围都达到8个电子结构 C、LnPb是催化剂, 是中问产物
D、加入反应时,LnPd被氧化
17. 下列物质属于强电解质的是( )A、HF B、 C、 D、HCOOH18. 下列物质属于强电解质的是( )A、CH3COOH B、H2O C、AlCl3 D、CO219. 下列物质属于弱电解质的是( )A、 B、 C、 D、20. 下列关于实验现象的解释或所得结论正确的是( )
是中问产物
D、加入反应时,LnPd被氧化
17. 下列物质属于强电解质的是( )A、HF B、 C、 D、HCOOH18. 下列物质属于强电解质的是( )A、CH3COOH B、H2O C、AlCl3 D、CO219. 下列物质属于弱电解质的是( )A、 B、 C、 D、20. 下列关于实验现象的解释或所得结论正确的是( )选项
实验操作
现象
解释或所得结论
A
向某无色溶液中滴加盐酸酸化的BaCl2溶液
产生白色沉淀
该无色溶液中含有SO
B
用pH计分别测定相同浓度的Na2S和NaCl溶液的pH
Na2S溶液的pH较大
Cl的非金属性强于S
C
将pH=3的醋酸溶液稀释到原体积的100倍再测其pH
3<pH<5
醋酸是弱酸
D
将久置于空气中的NaOH固体溶于水,向其中加入BaCl2溶液
有白色沉淀生成
该NaOH固体已完全变质
A、A B、B C、C D、D21. 下列气体与水发生反应,生成物中没有强电解质的是( )A、NO2 B、SO3 C、(CH3CO)2O D、Cl222. 下列事实一定能说明CH3COOH是弱电解质的是( )A、CH3COOH属于有机化合物 B、CH3COOH能与乙醇发生酯化反应 C、用CH3COOH溶液做导电实验,灯泡较暗 D、常温下,0.1mol·L-1CH3COOH溶液的pH约为323. 常温下,已知弱酸溶液中含R物种的浓度之和为 , 溶液中所有含R物种的的关系如图所示,下列说法错误的是( )
已知,①pOH表示浓度的负对数[]。
②a、b、c三点的坐标,a(7.3,-1.3)、b(10.0.-3.6)、c(12.6,-1.3)。
A、为二元弱酸 B、曲线③表示随pOH的变化 C、pH=6.7的溶液中: D、反应的平衡常数二、多选题
-
24. 室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度(mol/L)
反应后溶液的pH
①
0.1
0.1
9
②
0.2
7
下列判断错误的是( )
A、实验①反应的溶液中: B、实验①反应的溶液中: C、实验②反应的溶液中: D、实验②反应的溶液中:三、非选择题
-
25.(1)、比较给出H+的能力的相对强弱:H2CO3C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32‾和C6H5O‾结合H+能力的相对强弱。(2)、Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式。(3)、常压下,水晶的硬度比晶体硅的硬度大,其主要原因是。26. 工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)
 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。 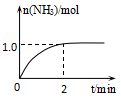 (1)、0~2min内的平均反应速率v(H2)=。(2)、该温度下,反应的平衡常数表达式K=。
(1)、0~2min内的平均反应速率v(H2)=。(2)、该温度下,反应的平衡常数表达式K=。其平衡常数K与温度T的关系如下表:

试判断K1K2(填写“>”、“=”或“<”)。
(3)、能说明该合成氨反应已达到平衡状态的是(选填编号)。a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1 , c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。

请回答:
(4)、①中所得混合溶液,pH7(填“>”、“<”或“=”);②中c 0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为。(5)、请你设计一个能证明一水合氨是弱电解质的简要方案。27. 回答或解释下列问题:(1)、已知: , 则稳定性:白磷红磷(填“大于”或“小于”)。(2)、在常温常压下,1 g氢气在足量氯气中完全燃烧生成氯化氢气体,放出91.5的热量。写出相应的热化学方程式为;(3)、将浓氨水滴入到固体氢氧化钠中,可以快速制备氨气,用平衡移动原理解释原因:;(4)、常温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL0.1 mol/LHCl溶液和20.00 mL 0.1 mol/L CH3COOH溶液,得到2条滴定曲线如图所示:
①由A、C点判断,滴定HCl溶液的曲线是(填“图1”或“图2”)。
②E为滴定终点,则a=mL。
③D点对应离子浓度由大到小的顺序为。
(5)、肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。已知断裂1 mol化学键所需的能量:N≡N为942 kJ、N-N为154 kJ,另外1 mol O2(g)变成2 mol O(g)需吸收500 kJ能量,则断裂1 mol N-N键所需的能量是。 28. 硫及其化合物在生产、生活中具有广泛的应用,根据所学知识,回答下列问题:(1)、Al2(SO4)3溶液显(填“酸”、“碱”或“中”)性,判断的理由是(用离子方程式表示),若将该溶液蒸干,最终所得固体为(填化学式)。(2)、(NH4)2SO4溶液中,各离子浓度由大到小的关系为。(3)、室温下,在某NaHSO3、Na2SO3混合溶液中,、物质的量分数随的变化曲线如图所示,根据图示,的水解平衡常数Kh=。
28. 硫及其化合物在生产、生活中具有广泛的应用,根据所学知识,回答下列问题:(1)、Al2(SO4)3溶液显(填“酸”、“碱”或“中”)性,判断的理由是(用离子方程式表示),若将该溶液蒸干,最终所得固体为(填化学式)。(2)、(NH4)2SO4溶液中,各离子浓度由大到小的关系为。(3)、室温下,在某NaHSO3、Na2SO3混合溶液中,、物质的量分数随的变化曲线如图所示,根据图示,的水解平衡常数Kh=。 (4)、室温下,某浓度的(NH4)2SO3溶液中:
(4)、室温下,某浓度的(NH4)2SO3溶液中:①(NH4)2SO3为(填“强”或“弱”)电解质。
②(填“>”、“<”或“=”)。
③往(NH4)2SO3溶液中滴加少量的HClO溶液,发生反应的离子方程式为 , 此时所得溶液的pH(填“变大”、“变小”或“不变”)。
29. 醋酸和盐酸是日常生活中常见的酸。(1)、用化学用语表示醋酸显酸性的原因 , 该过程的0(填“>”“<”或“=”)(2)、25℃、常压下,在的稀醋酸溶液中,由水电离出的mol/L。下列方法中,可以使上述醋酸溶液的电离程度增大的是(填字母)。A.加入少量0.10mol/L的稀盐酸 B.加入少量氯化钠晶体
C.加入少量纯 D.加入少量0.10mol/L的NaOH溶液
(3)、将等质量的锌粉投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)V(醋酸)(填“>”、“<”或“=”)。(4)、25℃向体积为的醋酸溶液中滴加的NaOH溶液,溶液恰好呈中性,则与的关系是:(填“>”、“<”或“=”)。(5)、25℃将的盐酸和的氢氧化钠溶液混合,若混合后溶液呈中性,则盐酸与氢氧化钠溶液的体积比为。(6)、向aL溶液中加入bmol , 恢复至25℃,混合液呈中性,该溶液中离子浓度的大小排序为 , 混合溶液中mol/L(忽略溶液体积变化)。(7)、铜和盐酸的反应在通常状况下不能自发进行,可以利用电化学手段使其发生,在下面方框中画出装置示意图,标出电极材料和电解质溶液名称。 30. 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题:(1)、生活中明矾常作净水剂,其净水的原理是(用离子方程式表示)。(2)、某温度下,和的电离常数数值相等,物质的量浓度相同的溶液和氨水混合后,溶液中 , 则所加入溶液的体积(填“大于”“小于”或“等于”)氨水的体积。(3)、常温下,取溶液与溶液等体积混合,测得混合后溶液的。写出的电离方程式。(4)、含的废水毒性较大,某工厂废水中含的。为了使废水的排放达标,进行如下处理:
30. 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题:(1)、生活中明矾常作净水剂,其净水的原理是(用离子方程式表示)。(2)、某温度下,和的电离常数数值相等,物质的量浓度相同的溶液和氨水混合后,溶液中 , 则所加入溶液的体积(填“大于”“小于”或“等于”)氨水的体积。(3)、常温下,取溶液与溶液等体积混合,测得混合后溶液的。写出的电离方程式。(4)、含的废水毒性较大,某工厂废水中含的。为了使废水的排放达标,进行如下处理:①绿矾为 , 反应(Ⅰ)中与的物质的量之比为。
②常温下若处理后的废水中 , 则处理后的废水的。
31. 按要求回答下列问题:(1)、下列物质中属于强电解质的是(填标号,下同), 属于非电解质的是。①Cl2 ②熔融态的NaCl ③氨水 ④盐酸溶液 ⑤乙醇 ⑥BaSO4 ⑦H2O ⑧HF ⑨CO
(2)、若T℃时,醋酸的电离常数K =1.6×10-5 , 则该温度下0.01 mol/L的醋酸溶液的c(H+)约为mol/L。(3)、若T℃时,pH=2的醋酸溶液中由水电离出的c(H+)= 1×10-11 , 则该温度下水的离子积常数Kw= , 将此温度下Va L pH=1的HCl溶液与Vb L pH=11的NaOH溶液混合后pH=3,则Va:Vb=。32. 中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。(1)、Ⅰ.室温下,用的溶液分别滴定均为的溶液和醋酸溶液,滴定曲线如图所示。
在滴加过程中,稀醋酸溶液中水的电离程度(填“增大”、“减小”、“不变”、“先增大后减小”或“先减小后增大”)。
(2)、和醋酸的酸性强弱为:(填“强于”、“弱于”)。(3)、用等式表示滴定过程中曲线Ⅱ溶液中所有离子的浓度关系。(4)、Ⅱ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用'酸性 , 溶液滴定未知浓度的无色溶液。请完成下列问题:请写出酸性溶液与溶液反应的离子方程式:。
(5)、该滴定实验所需仪器为下列中的____(填字母)。A、酸式滴定管() B、碱式滴定管() C、量筒() D、锥形瓶 E、铁架台 F、滴定管夹 G、烧杯 H、白纸 I、胶头滴管 J、漏斗(6)、不用(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是。(7)、该实验选何种指示剂,说明理由:。(8)、滴定前平视溶液液面,刻度为 , 滴定后俯视液面刻度为 , 则比实际消耗溶液体积(填“大”或“小”)。根据计算得到的待测溶液浓度比实际浓度(填“大”或“小”)。33.(1)、Ⅰ. 现有下列物质:①NaHSO4固体②Ba(OH)2溶液 ③蔗糖 ④熔融 NaOH ⑤NH4Cl 固体 ⑥CO2 ⑦液氯 ⑧ CH3COOH溶液 ⑨水玻璃 ⑩液态氯化氢上述物质中能导电的是(填序号,下同);
(2)、属于强电解质的是 , 属于非电解质的是;(3)、将②加入①的水溶液中至刚好沉淀完全的离子方程式:。(4)、Ⅱ.已知实验室可以用KMnO4与浓HCl制取Cl2 , 其反应的化学方程式如下: KMnO4 + HCl(浓) =KCl + MnCl2+ Cl2↑+_①配平该方程式并用双线桥法分析上述反应的电子转移情况。
②标况下生成3.36L Cl2 , 被氧化的氯化氢的物质的量为 , 转移电子的数目为。
34. 按要求完成以下相关问题。(1)、已知①硫酸分子②二氧化碳③盐酸④氯化银⑤氨水⑥铜⑦乙醇⑧氯化钡溶液⑨氯气,其中属于强电解质的是(填写序号)。(2)、写出硫酸氢钠在熔融状态下的电离方程式。(3)、向硫化氢溶液中通入氯气至完全反应,溶液的导电性(用语言描述)。(4)、向Ba(OH)2溶液中逐滴加入 NaHSO4 溶液至混合液呈中性,写出此过程对应的离子反应方程式。(5)、向酸性高锰酸钾溶液中滴入草酸(H2C2O4 , 视为二元弱酸)溶液至过量,溶液的紫色会逐渐褪去,写出此过程对应的化学反应方程式。(6)、H2S+4O2F2=SF6+2HF+4O2 , 生成0.8mo1HF 时,转移的电子的数目为。(7)、P+CuSO4+H2O—Cu3P+H3PO4+H2SO4(未配平),生成5mo1Cu3P时,参加反应的 P的物质的量为。35. 25℃时,有关物质的电离平衡常数如下:化学式
CH3COOH
H2CO3
H2SO3
电力平衡常数K
K=1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=1.5×10-2
K2=1.02×10-7
(1)、电解质由强至弱顺序为(用化学式表示,下同)。(2)、常温下,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1 000 mL,稀释后溶液的pH,前者后者(填“>”、“<”或“=”)。(3)、下列离子CH3COO-、CO 、HSO 、SO 在溶液中结合H+的能力由大到小的顺序为。(4)、NaHSO3溶液显酸性的原因(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是。36. 现有以下物质:①NaCl晶体 ②稀盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜⑦CO2 ⑧冰醋酸 ⑨液氯 ⑩SO2 ⑪石墨(1)、以上物质中能导电的是。(2)、以上物质中属于电解质的是 , 属于非电解质的是。(3)、以上物质中属于弱电解质的是 , 属于强电解质的是。
-