高考二轮复习知识点:化学平衡的计算1
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 在恒温恒容密闭容器中发生反应2H2(g)+2NO(g) 2H2O(g) +N2(g),N2的瞬时生成速率v=k·cm(H2)c2 (NO)。控制NO起始浓度为0.5 mol/L,N2的瞬时生成速率和H2起始浓度的关系如图所示,下列说法正确的是( )
 A、由题可知,该反应的速率常数k为15 B、随着H2起始浓度增大,该反应平衡常数增大 C、达平衡后,H2和NO的浓度均增加一倍,则NO转化率减小 D、H2起始浓度0.2 mol/L,某时刻NO的浓度为0.4 mol/L,则N2的瞬时生成速率为0.24 mol/L2. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。在指定条件下,下列选项所示的物质间转化不能实现的是( )A、NH3·H2O(aq)NH4HSO4 B、HNO3(浓)NO2 C、NH4ClNH3 D、NON23. 精炼铜工业中阳极泥的综合利用具有重要意义,从中间产品分金渣(主要成分为:、、、)中获取高纯银的流程如下图所示。下列说法错误的是( )
A、由题可知,该反应的速率常数k为15 B、随着H2起始浓度增大,该反应平衡常数增大 C、达平衡后,H2和NO的浓度均增加一倍,则NO转化率减小 D、H2起始浓度0.2 mol/L,某时刻NO的浓度为0.4 mol/L,则N2的瞬时生成速率为0.24 mol/L2. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。在指定条件下,下列选项所示的物质间转化不能实现的是( )A、NH3·H2O(aq)NH4HSO4 B、HNO3(浓)NO2 C、NH4ClNH3 D、NON23. 精炼铜工业中阳极泥的综合利用具有重要意义,从中间产品分金渣(主要成分为:、、、)中获取高纯银的流程如下图所示。下列说法错误的是( )
已知:在上述反应的温度下
① , ;
②。
A、“分银”时与反应生成的离子方程式为 , 该反应的化学平衡常数为 B、“分银渣”的主要成分为 C、“沉银”时为防止产生污染性有毒气体,盐酸不宜过量 D、若“还原”时有生成,则该反应中氧化剂与还原剂的物质的量之比为4. 常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中分别加入NaOH固体,lg随加入NaOH的物质的量的变化情况如图所示。下列叙述不正确的是( ) A、a点由水电离出的=1×10-13mol/L B、HY溶液导电性先减弱后增强 C、当n(HY):n(NaY)=1:1混合配成溶液,pH=4 D、b点溶液中: =5. 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) ⇌ 2NO(g)+O2(g)△H>0。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
A、a点由水电离出的=1×10-13mol/L B、HY溶液导电性先减弱后增强 C、当n(HY):n(NaY)=1:1混合配成溶液,pH=4 D、b点溶液中: =5. 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) ⇌ 2NO(g)+O2(g)△H>0。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )容器编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A、容器Ⅱ中刚开始反应时v正<v逆 B、达平衡时,容器I与容器Ⅱ中的总压强之比为4∶5 C、达平衡时,容器Ⅲ中NO的体积分数大于50% D、当温度改变为T2时,若k正=k逆 , 则T2>T16. 一定条件下,在容积为2 L的刚性容器中充入1 mol (g) 和2 mol H2 , 发生反应
(g) 和2 mol H2 , 发生反应  (g)+2H2(g)
(g)+2H2(g)  (g) △H<0,反应过程中测得容器内压强的变化如图所示。下列说法正确的是( )
(g) △H<0,反应过程中测得容器内压强的变化如图所示。下列说法正确的是( )  A、升高温度可增大反应速率,提高环戊二烯的平衡转化率 B、0~20 min内,H2的平均反应速率为0.05 mol/(L·min) C、达到平衡时,环戊烷和环戊二烯的体积分数相同 D、该温度下平衡常数Kp=4.0 MPa-27. 温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5 , 发生反应:PCl5(g) PCl3(g)+Cl2(g) △H=a kJ·mol-l(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是( )
A、升高温度可增大反应速率,提高环戊二烯的平衡转化率 B、0~20 min内,H2的平均反应速率为0.05 mol/(L·min) C、达到平衡时,环戊烷和环戊二烯的体积分数相同 D、该温度下平衡常数Kp=4.0 MPa-27. 温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5 , 发生反应:PCl5(g) PCl3(g)+Cl2(g) △H=a kJ·mol-l(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是( )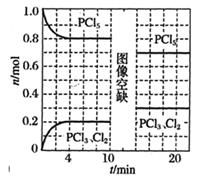 A、0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1 B、10 min时改变的条件是增加了一定量的PCl5 C、若起始时向该容器中充入2.0mol PCl3和2.0 mol Cl2 , 保持温度为T , 反应达平衡时放出的热量小于1.6a kJ D、温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10 mol Cl2 , 反应达到平衡前v正<v逆8. 相同温度下,甲、乙两个恒容密闭容器均进行反应:X(g)+Y(g) W(?)+2Z(g)△H<0.实验过程中部分数据如表所示。
A、0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1 B、10 min时改变的条件是增加了一定量的PCl5 C、若起始时向该容器中充入2.0mol PCl3和2.0 mol Cl2 , 保持温度为T , 反应达平衡时放出的热量小于1.6a kJ D、温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10 mol Cl2 , 反应达到平衡前v正<v逆8. 相同温度下,甲、乙两个恒容密闭容器均进行反应:X(g)+Y(g) W(?)+2Z(g)△H<0.实验过程中部分数据如表所示。容器
起始容积
物质的起始加入量
平衡时Z的物质的量浓度
甲
2L
1molX、1molY
0.6mol·L-1
乙
5L
2molW、4molZ
0.48mol·L-1
下列说法错误的是( )
A、该温度下W为非气态 B、适当降低乙容器的温度可能使c甲(Z)=1.5c乙(Z) C、该温度下反应的化学平衡常数K=9 D、平衡后正反应速率v正(X):甲>乙9. 温度 ℃,反应 中所有物质均为气态。在起始温度、体积相同( ℃、2L密闭容器)时,发生反应的部分数据见下表:反应条件
反应时间
反应Ⅰ:
恒温恒容
0
2
6
0
0
10
4.5
20
1
30
1
反应Ⅱ:
绝热恒容
0
0
0
2
2
下列说法正确的是( )
A、对反应I,前10 内的平均反应速率 B、在其他条件不变的情况下,若30 时只向容器中再充入1 和1 ,则平衡正向移动 C、对于反应I,进行30 时, 所占的体积分数为30% D、达到平衡时,反应I、II对比:平衡常数10. 在体积恒为1L的密闭容器中发生反应: 。测得不同条件下A的平衡转化率a(A)如下表。实验序号
实验温度
初始投料量
1
10
10
50
2
10
10
a
3
15
10
40
下列说法正确的是( )
A、当容器内压强不变时,反应达到化学平衡状态 B、 时,反应的化学平衡常数值为2 C、若 ,则 D、11. 某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K= 。该温度下,在①、②两个恒容密闭容器中投入H2(g)和CO2(g),起始浓度如下表。下列说法正确的是( )容器编号
起始浓度/mol·L−1
H2
CO2
H2O
CO
①
0.1
0.1
0
0
②
0.2
0.1
0.2
0.1
A、反应开始时,②中反应向逆反应方向进行 B、平衡时,①中c(CO2)=0.04mol·L−1 C、①中H2的平衡转化率为40% D、①、②均达平衡时,①中各组分浓度与②相同12. 工业上可用“丙烯氨氧化法”生产重要的化工原料丙烯腈(C3H3N)。①在催化剂存在下生成丙烯腈(C3H3N)的热化学方程式为C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
②得到副产物丙烯醛(C3H4O)的热化学方程式为C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
丙烯腈产率与反应温度的关系曲线如图所示。
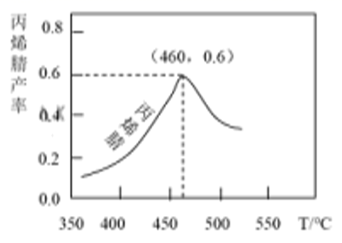
下列说法错误的是( )
A、反应①的平衡常数可表示为K= B、增大压强可以提高丙烯腈的平衡产率 C、温度低于460℃时,丙烯腈的产率不是对应温度下的平衡产率 D、C3H4O(g)+NH3(g)+ O2(g)=C3H3N(g)+2H2O(g) ΔH=-162 kJ/mol13. 在一定的温度下,将一定量的氢气和氮气的混合气体充入等压密闭容器中进行反应,达到平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为( )A、25% B、27.5 % C、30% D、37.5%14. 往恒容密闭容器中通入amolNO2气体,在一定温度下分解生成O2和NO,各物质的浓度随时间的变化如图所示。下列说法错误的是( ) A、X表示NO,Y表示O2 B、t1min时,NO2的正反应速率比逆反应速率大 C、t3min时,c(NO2)+c(NO)+c(O2)=1.5amol•L-1 D、t2min时,NO2在混合物中所占的物质的量分数为0.25
A、X表示NO,Y表示O2 B、t1min时,NO2的正反应速率比逆反应速率大 C、t3min时,c(NO2)+c(NO)+c(O2)=1.5amol•L-1 D、t2min时,NO2在混合物中所占的物质的量分数为0.25二、多选题
-
15. 工业上利用NaClO将废水中的As(III)氧化为As(V),然后经吸附、沉降而除去。As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。一般把10-1>Ka>10-4的酸称为中强酸,把Ka<10-4的酸称为弱酸,下列说法正确的是( )
 A、H3AsO4、H3AsO3都是中强酸 B、pH=10时,NaClO将As(III)氧化为As(V)的离子方程式:H2AsO+ClO-+OH-=HAsO+Cl-+H2O C、H2AsO+H2AsOHAsO+H3AsO3K=102.4 D、相同温度下,同浓度的Na3AsO4溶液与Na2HAsO3溶液,前者碱性强16. 臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)⇌N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
A、H3AsO4、H3AsO3都是中强酸 B、pH=10时,NaClO将As(III)氧化为As(V)的离子方程式:H2AsO+ClO-+OH-=HAsO+Cl-+H2O C、H2AsO+H2AsOHAsO+H3AsO3K=102.4 D、相同温度下,同浓度的Na3AsO4溶液与Na2HAsO3溶液,前者碱性强16. 臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)⇌N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡.反应过程中测定的部分数据见下表:t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
下列有关说法正确的是( )
A、反应在0~3 s内的平均速率v(NO2)=0.24 mol•L﹣1•s﹣1 B、24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L﹣1 , 则反应的△H<0 C、在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2 , 反应达到平衡时,压强为起始时的0.88倍 D、在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2 , 达到平衡时,N2O5的转化率大于20%17. 一定条件下,在的平衡体系中,X、Y、Z的浓度分别是2 mol/L,0.8 mol/L、2.4 mol/L,则X在起始时的浓度不可能是( )A、3 mol/L B、0.2 mol/L C、4.4 mol/L D、4.8 mol/L18. 在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)⇌C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )A、在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) B、5min时,容器内D的浓度为0.2mol/L C、当容器内压强保持恒定时,该可逆反应达到平衡状态 D、5min时容器内气体总的物质的量为3mol19. 在2L密闭容器中充入气体A和B,发生反应: , 所得实验数据如下表。下列说法错误的是( )实验编号
温度/℃
起始时物质的量/
平衡时物质的量/
①
300
0.40
0.10
0.090
②
500
0.40
0.10
0.080
③
500
0.20
0.05
a
A、该反应 B、平衡时物质B的体积分数:②① C、实验③中达到平衡时,a值小于0.040 D、500℃该反应的平衡常数K的数值为0.3220. 某兴趣小组在实验室控制X和Y初始投料比为1:2.2,在催化剂存在下,发生如下反应:。经过100s的相同反应时间测得如下实验数据:T(K)
催化剂
X转化率(%)
W选择性(%)
543
Ⅰ
12.3
42.3
543
Ⅱ
10.9
72.7
553
Ⅰ
15.3
39.1
553
Ⅱ
12.0
71.6
该反应存在副反应,且100s时未达到平衡;W选择性是指转化的X中生成W的百分比。根据表中数据,下列说法错误的是( )
A、温度和催化剂都能影响该反应的选择性 B、其他条件相同时,升高温度,生成W的量可能增大 C、使用催化剂Ⅱ有利于提高X转化为W的转化率 D、若起始X、Y混合气体的总浓度为3.2mol/L,则在553K,使用催化剂Ⅱ时,W的生成速率为三、非选择题
-
21. 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。(1)、Ⅰ.苯乙烯的制备
已知下列反应的热化学方程式:①
②
③
计算反应④的;
(2)、在某温度、下,向反应器中充入气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入水蒸气作为稀释气(计算时忽略副反应);(3)、在、下,以水蒸气作稀释气。作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 , 理由是;
 (4)、关于本反应体系中催化剂的描述错误的是____;A、X射线衍射技术可测定晶体结构 B、可改变乙苯平衡转化率 C、降低了乙苯脱氢反应的活化能 D、改变颗粒大小不影响反应速率(5)、Ⅱ.苯乙烯的聚合
(4)、关于本反应体系中催化剂的描述错误的是____;A、X射线衍射技术可测定晶体结构 B、可改变乙苯平衡转化率 C、降低了乙苯脱氢反应的活化能 D、改变颗粒大小不影响反应速率(5)、Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进(引发剂,X表示卤素)生成自由基 , 实现苯乙烯可控聚合。
引发剂中活性最高的是;(6)、室温下,①在配体L的水溶液中形成 , 其反应平衡常数为K;②在水中的溶度积常数为。由此可知,在配体L的水溶液中溶解反应的平衡常数为(所有方程式中计量系数关系均为最简整数比)。22. 硫酸工业在国民经济中占有重要地位。(1)、我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、和(填化学式)。 (2)、铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
(2)、铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
(3)、接触法制硫酸的关键反应为SO2的催化氧化:SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。
23. 纳米碗是一种奇特的碗状共轭体系。高温条件下,可以由分子经过连续5步氢抽提和闭环脱氢反应生成。的反应机理和能量变化如下: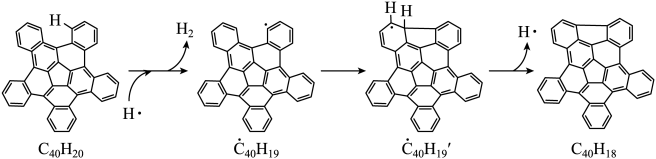
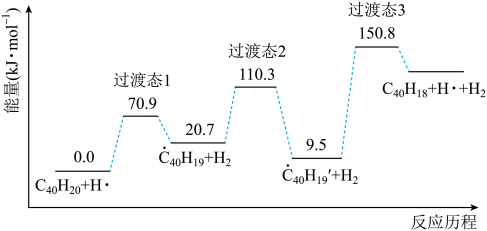
回答下列问题:
(1)、已知中的碳氢键和碳碳键的键能分别为和 , H-H键能为。估算的。(2)、图示历程包含个基元反应,其中速率最慢的是第个。(3)、 纳米碗中五元环和六元环结构的数目分别为、。(4)、1200K时,假定体系内只有反应发生,反应过程中压强恒定为(即的初始压强),平衡转化率为α,该反应的平衡常数为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(5)、 及反应的(为平衡常数)随温度倒数的关系如图所示。已知本实验条件下,(R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是。 (6)、下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是(填标号)。
(6)、下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是(填标号)。a.升高温度 b.增大压强 c.加入催化剂
24. 硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:(1)、在气氛中,的脱水热分解过程如图所示:
根据上述实验结果,可知 , 。
(2)、已知下列热化学方程式:则的。
(3)、将置入抽空的刚性容器中,升高温度发生分解反应:(Ⅰ)。平衡时的关系如下图所示。时,该反应的平衡总压、平衡常数。随反应温度升高而(填“增大”“减小”或“不变”)。 (4)、提高温度,上述容器中进一步发生反应(Ⅱ),平衡时(用表示)。在时, , 则 , (列出计算式)。25. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。
(4)、提高温度,上述容器中进一步发生反应(Ⅱ),平衡时(用表示)。在时, , 则 , (列出计算式)。25. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。 (2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
(2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
①图中压强由小到大的顺序为 , 判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、时,氮气的转化率。该温度时,反应的平衡常数(化为最简式)。
26. 兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含、 , 还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知: ,
(1)、“酸溶”过程中,发生反应的离子方程式为。(2)、“除杂”过程中加入除去发生的反应是: , 该反应的平衡常数。(3)、“沉镍”所得沉淀有多种组成,可表示为。为测定其组成,进行下列实验:称取干燥沉淀样品 , 隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(条件下加热,收集到的气体产物只有一种,以上残留固体为)。通过计算确定该样品的化学式。(写出计算过程) (4)、“浸出”是制备兰尼镍的关键步骤,溶液在“浸出”过程中的作用是。(5)、使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是。27. 重整技术是实现“碳中和”的一种理想的利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
(4)、“浸出”是制备兰尼镍的关键步骤,溶液在“浸出”过程中的作用是。(5)、使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是。27. 重整技术是实现“碳中和”的一种理想的利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。主反应:
副反应:
回答下列问题:
(1)、已知、和的燃烧热分别为、和 , 该催化重整主反应的。有利于提高平衡转化率的条件是(填标号)。A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)、在刚性密闭容器中,进料比分别等于1.0、1.5、2.0,且反应达到平衡状态。
①甲烷的质量分数随温度变化的关系如图甲所示,曲线对应的;
②反应体系中,随温度变化的关系如图乙所示,随着进料比的增加,的值(填“增大”、“不变”或“减小”),其原因是。
(3)、在、 时,按投料比加入刚性密闭容器中,达平衡时甲烷的转化率为 , 二氧化碳的转化率为 , 则副反应的压强平衡常数(计算结果保留3位有效数字)。(4)、我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气和 , 同时获得甘油醛。则催化电极为极,催化电极产生的电极反应式为。 28. 研发二氧化碳利用技术,已成为世界科学领域研究的热点。请回答下列问题:(1)、Ⅰ.二氧化碳催化加氢制甲醇,不仅有利于降低空气中二氧化碳含量,同时可以制备清洁能源,其总反应可表示为:。
28. 研发二氧化碳利用技术,已成为世界科学领域研究的热点。请回答下列问题:(1)、Ⅰ.二氧化碳催化加氢制甲醇,不仅有利于降低空气中二氧化碳含量,同时可以制备清洁能源,其总反应可表示为:。一定温度下,此反应的反应历程与体系能量变化关系如图1所示,则第二步反应的热化学方程式为。
 (2)、第一步反应的正反应速率方程为 , 逆反应速率方程为 , 其中、分别为正、逆反应的速率常数,只受温度影响。与(温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示的是。图中A、B、C、D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为时,第一步反应的化学平衡常数。
(2)、第一步反应的正反应速率方程为 , 逆反应速率方程为 , 其中、分别为正、逆反应的速率常数,只受温度影响。与(温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示的是。图中A、B、C、D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为时,第一步反应的化学平衡常数。 (3)、总反应在起始物质的量时,不同条件下达到平衡,设体系中甲醇的物质的量分数为 , 在时随压强(P)的变化及在时随温度(t)的变化如图所示。
(3)、总反应在起始物质的量时,不同条件下达到平衡,设体系中甲醇的物质的量分数为 , 在时随压强(P)的变化及在时随温度(t)的变化如图所示。
①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②时,当时,的平衡转化率为(保留小数点后一位)。
(4)、Ⅱ.我国科学家以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图所示,其中表示过渡态、数字表示微粒的相对总能量。
途径一,电还原经两步反应生成:第一步为(*表示微粒与的接触位点):第二步为。
(5)、电还原的选择性以途径一为主,理由是。29. 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
化合物
Cr(OH)3
Ca(OH)2
Mg(OH)2
SrCO3
Ksp近似值
1×10-31
5.5×10-6
1.8×10-11
5.6×10-10
回答下列问题:
(1)、气体A的电子式为。(2)、“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为(用离子方程式解释);“还原”时发生反应的离子方程式为。(3)、“滤渣1”的主要成分为(填化学式)。(4)、用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为。(5)、“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为。(6)、已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11 , 则“碳化”时,反应Sr2+(aq)+2HCO(aq)SrCO3(s)+H2CO3(aq)的平衡常数K=(保留两位有效数字)。(7)、“系列操作”中包含“200℃烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为 (填化学式)。30. 中国首次实现利用二氧化碳合成淀粉,合成过程的关键步骤是利用二氧化碳制备甲醇。CO2催化加氢制CH3OH的主要反应为CO2+3H2→CH3OH+H2O。(1)、已知H2(g)和CH3OH(g)的燃烧热分别是285.8kJ·mol-1和763.9kJ·mol-1 , H2O(1)的汽化热是40.8kJ·mol-1 , 则反应CO2(g)+3H2(g)→CH3OH(g)+H2O(g)的ΔH=。该反应在(填“高温”“低温”或“任何温度”)下可自发进行。(2)、CO2催化加氢制CH3OH的一种反应机理历程如下图所示(吸附在催化剂表面的物质用*标注,如CO2*表示CO2吸附在催化剂表面)
该反应历程中决速步反应的化学方程式为。
(3)、已知化学反应速率方程k正、k逆是正逆反应v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O)的速率常数,只受温度影响。如图表示速率常数的对数lgk与温度的倒数之间的关系,k正、k逆对应的曲线分别是、。 (4)、CO2和H2起始物质的量之比为1:3时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜能选择性分离出H2O)。有分子筛膜时,温度为210℃时甲醇平衡产率最高的原因是。(5)、一定条件下,向2L恒容密闭容器中充入2 molCO2和6molH2 , 发生反应CO2(g)+3H2(g) → CH3OH(g)+H2O(g)。已知容器内起始压强为320kPa,反应达平衡时容器内压强为200kPa,平衡时CH3OH(g)的分压为kPa,该温度下反应的标准平衡常数Kθ=。(该反应标准平衡常数的表达式为Kθ= , 其中p为分压,分压=总压×物质的量分数,pθ=100kPa)31. 氨气是重要的化工原料。据《科学)最新报道,我国科学家开发新型催化剂Li4RuH6或Ba2RuH6在温和(低温低压)条件下合成NH3 , 反应进程如图1、图2所示。
(4)、CO2和H2起始物质的量之比为1:3时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜能选择性分离出H2O)。有分子筛膜时,温度为210℃时甲醇平衡产率最高的原因是。(5)、一定条件下,向2L恒容密闭容器中充入2 molCO2和6molH2 , 发生反应CO2(g)+3H2(g) → CH3OH(g)+H2O(g)。已知容器内起始压强为320kPa,反应达平衡时容器内压强为200kPa,平衡时CH3OH(g)的分压为kPa,该温度下反应的标准平衡常数Kθ=。(该反应标准平衡常数的表达式为Kθ= , 其中p为分压,分压=总压×物质的量分数,pθ=100kPa)31. 氨气是重要的化工原料。据《科学)最新报道,我国科学家开发新型催化剂Li4RuH6或Ba2RuH6在温和(低温低压)条件下合成NH3 , 反应进程如图1、图2所示。
工业合成氨原理:N2(g)+3H2(g) 2NH3(g) △H。
(1)、已知:N≡N、H-H、N-H键的键能分别为945kJ·mol-1、436kJ·mol-1、391kJ·mol-1。工业合成NH3的△H=kJ∙mol-1。(2)、图2中与图1能量变化相符的是(填“曲线a”或“曲线b")。在某条件下,测得上述反应的E1=1250kJ∙mol-1 , 则E2=kJ∙mol-1。(3)、合成氨的速率方程为v(NH3)=k(N2)·(H2) (NH3)(k为速率常数,只与温度、催化剂有关,与浓度无关;、、为反应级数,可取整数、分数或小数)。测得在一定温度和催化剂作用下,速率与浓度的关系如下表所示:c(N2)/(mol∙L-1)
c(H2)/(mol∙L-1)
c(NH3)/(mol∙L-1)
速率
I
0.1
0.1
0.1
v
II
0.2
0.1
0.1
2v
III
0.2
0.4
0.1
16v
IV
0.4
0.9
0.2
54v
V
0.4
m
0.4
64v
则;;=;m=。
(4)、向密闭容器中充入ImolN2和2.6molH2 , 在一定条件下合成NH3 , 相同时间内测得体系中N2的物质的量(mol)与温度、压强的关系如图3所示。
①P(填">”、“<"或“=")1.8MPa。
②投料比一定时,随着温度升高,不同压强下N2的物质的量趋向相等,其主要原因是。
③在1.8MPa、373K时,平衡常数Kp=MPa—2。(提示:用分压计算的平衡常数为Kp , 分压=总压×物质的量分数)
32. 大气污染物( CO、N2O、NO等)的治理和“碳中和”技术的开发应用,成为化学研究的热点问题。(1)、某化工厂排出的尾气(含CO、N2O)治理的方法为:在密闭容器中发生如下反应:CO(g) + N2O(g) CO2(g) + N2(g),CO、N2O 在Pt2O+表面进行两步反应转化为无毒气体,其相对能量与反应历程的关系如下图。
①写出N2O在Pt2O+的表面上反应的化学方程式。
②第一步反应的速率比第二步的( 填“ 慢”或“快”)。两步反应均为热反应。
(2)、汽车尾气中含NO,处理NO的一种方法为: 2 CO(g) +2 NO(g)N2(g) +2 CO2(g)①已知该反应为自发反应,则该反应的反应热△H 0. (选填“>”或“<”或“=”)
②一定温度下,将2 mol CO、4 mol NO充入一恒压密闭容器。已知起始压强为11 MPa,达到平衡时,测得N2的物质的量为0. 5 mol ,则该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=MPa -1(分压=总压×物质的量分数)。
(3)、2021年3月5日,国务院政府工作报告中指出,扎实做好碳达峰碳中和各项工作。科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2 转化为HCOOH,实现碳中和的目标。如图所示:
①离子交换膜为离子交换膜。
②P极电极反应式为。
③工业上利用甲酸的能量关系转换图如图所示:

反应CO2(g) + H2(g) HCOOH(g)的焓变△H =kJ·mol-1。温度为T1℃时,将等物质的量的CO2和H2充入体积为1 L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2。 实验测得:v正=k正c(CO2)c(H2), v逆=k逆c(HCOOH), k正、k逆为速率常数。T1℃时,k逆= k正 ;温度为T2℃时,k正=1. 9k逆 , 则T2℃> T1℃,理由是。
33. 氨是最重要的氮肥,也是产量最大的化工产品之一、合成氨工艺是人工固氮的重要途径。回答下列问题:(1)、已知气态分子中1mol化学键解离成气态原子所吸收的能量, 叫做该化学键的键能(kJ·mol-1)。一些键能数据如表:化学键
键能E(kJ·mol-1)
946.0
436.0
390.8
反应N2(g)+3H2(g)⇌2NH3(g) ∆H=kJ/mol
(2)、化学家格哈德·埃特尔在哈伯研究所证实了部分参加反应的分子在固体催化剂表面合成氨的反应过程,模拟示意图如图:
 分别表示N2、H2、NH3
分别表示N2、H2、NH3i.图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,图②到图③的过程能量(填“吸收”或“放出”)。
ii.N2的吸附分解反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料N2和H2物质的量之比为1︰2.8,分析说明N2过量的理由是和。
iii.关于合成氨工艺,下列说法正确的是。
A.控制温度(773K)远高于室温,是为了提高平衡转化率和加快化学反应速率。
B.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于化学平衡向正反应方向移动。
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率。
D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(3)、在体积相同的密闭容器中按物质的量比 1︰3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g)分别在200℃、400℃、600℃条件下进行反应,平衡时NH3的物质的量分数随总压强的变化曲线如图所示:
i.M点和N点的平衡常数大小关系是KMKN(填“>”、“<”或者“=”)。
ii.M点的平衡常数Kp=MPa-2(计算结果保留到小数点后两位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
(4)、已知液氨中存在:2NH3(l)⇌NH+NH。用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是。34. 工业废气和机动车尾气排放的氮氧化物(NOx)是大气中细颗粒物(PM2.5)的主要前体物之一,还可产生光化学烟雾和硝酸型酸雨,严重危害人类生命健康和破坏生态环境。回答下列问题:
(1)、一种脱硝方法是利用臭氧将NOx氧化为高价态氮氧化物N2O5 , 然后溶解在液相中。氧化反应如下:
Ⅰ.NO(g)+O3(g) NO2(g)+O2(g) △H1=- 200.9 kJ·mol-1
Ⅱ.2NO2(g)+O3(g) N2O5(g)+O2(g) △OH2
①在298K,101kPa时,反应I的活化能为10.7kJ·mol-1 , 则其逆反应的活化能为kJ·mol-1
②在2L密闭容器中充入2molNO2和1molO3 , 在不同温度下,平衡时NO2的物质的量分数 (NO2)随温度变化的曲线如图甲所示。

ⅰ.反应Ⅱ的△H20(填“大于”“小于”或“等于”,下同),a点的V正b点的v正 , a点的v正 v逆。
ⅱ.图甲中,T2℃时,若考患2NO2(g) N2O4(g),平衡后,O2和N2O4的平衡分压相同,则反应Ⅱ以物质的量分数表示的平衡常数Kx=(保留两位小数,不考虑反应Ⅰ的影响)。
ⅲ.对反应体系无限加压,得平衡时a(O3)与压强的关系如图乙所示。压强增大至p1MPa之后,O3的平衡转化率a(O3)不再增大的原因是
(2)、一种Ce-Ti固溶体催化剂选择性催化还原NOx的原理如下。
①反应的化学方程式为。
②反应的催化剂为(填标号)。
35. 氢气选择性催化还原(H2-SCR)是目前消除NO的理想方法,备受研究者关注。H2-SCR法的主反应:
副反应:
回答下列问题:
(1)、已知:①
②提高主反应选择性的最佳措施是。
A.降低温度 B.增大压强 C.增大c(H2) D.使用合适的催化剂
(2)、H2-SCR在Pt-HY催化剂表面的反应机理如下图
①下列有关说法错误的是
A.Pt原子表面上发生反应有N+NO=N2O、N+N=N2等
B.H2解离为H原子,溢流至HY载体上,将吸附于载体的NO2还原
C.从Pt原子表面解吸的NH3 , 在HY载体上转化为
D.HY载体酸性越强,其吸附NO2能力越强,Pt催化活性越大
②已知在HY载体表面发生反应的NO、O2物质的量之比为4:1,补充并配平下列化学方程式: +NO+O2=N2+H2O+。
(3)、T℃, 时,恒容容器中发生上述反应,平衡体系中N2物质的量分数为10%,平衡压强与起始压强之比为3.6:4,则NO的有效去除率(转化为N2)为。(4)、一定条件下,恒温恒容容器中充入c(NO)=2.0×10-3mol·L-1、c(H2)=4.0×10-3mol·L-1 , 只发生反应 ,体系的总压强p随时间t的变化如下表所示:[已知该反应速率方程为υ=k·c(H2)·c2(NO)]t/min
0
10
20
30
40
p/kPa
24
22.6
21.6
21
21
①t=20min时,υ=mol·L-1·s-1(速率常数k=1.0×105mol-2·L2·s-1)
②用平衡分压代替平衡浓度可以得到平衡常数Kp , 则该条件下反应的平衡常数Kp=。