高考二轮复习知识点:等效平衡
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 恒容密闭容器中,与在不同温度下发生反应: , 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
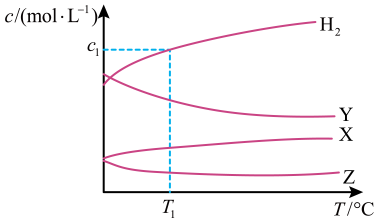
下列说法正确的是
A、该反应的平衡常数随温度升高而增大 B、曲线Y表示随温度的变化关系 C、提高投料比 , 可提高的平衡转化率 D、其他条件不变,与在℃下反应,达到平衡时2. 700℃时,向容积为 的恒容密闭容器中充入一定量的CO和 ,发生如下反应: ,反应过程中测定的部分数据见表:反应时间/min
0
0.30
0.60
20
0.10
30
0.20
下列说法正确的是( )
A、保持其他条件不变,升高温度,平衡时 ,则反应的 B、反应在 内的平均速率为 C、保持其他条件不变,再向平衡体系中同时通入 ,达到新平衡前v(正)<v(逆) D、相同温度下,若起始时向容器中充入 ,达到平衡时 转化率大于3. 已知2SO2 (g)+O2 (g)⇌2SO3 (g);△H=﹣197kJ•mol﹣1 . 向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3 . 恒温、恒容下反应达平衡时,下列关系一定正确的是( )A、容器内压强p:P甲=P丙>2P乙 B、SO3的质量m:m甲=m丙>2m乙 C、c(SO2)与c(O2)之比k:k甲=k丙>k乙 D、反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙4. 一定压强下,向10L密闭容器中充入 和 , 发生反应: 。 的消耗速率(v)、 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )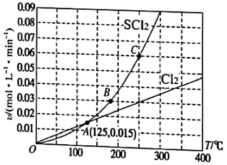 A、A,B,C三点对应状态下,达到平衡状态的是C B、温度升高,平衡常数K减小 C、若投料改为通入 和 , 的平衡转化率不变 D、125℃,平衡时 的消耗速率为0.0155. 某温度下,在甲、乙、丙三个恒容密闭容器中发生反应 , 体系中各物质浓度的有关数据如下。
A、A,B,C三点对应状态下,达到平衡状态的是C B、温度升高,平衡常数K减小 C、若投料改为通入 和 , 的平衡转化率不变 D、125℃,平衡时 的消耗速率为0.0155. 某温度下,在甲、乙、丙三个恒容密闭容器中发生反应 , 体系中各物质浓度的有关数据如下。容器
起始浓度
平衡浓度
甲
0.01
0.01
0
0.004
乙
0.01
0.02
0
a
丙
0.01
0.01
0.02
b
下列判断正确的是( )
A、甲中条件下,该反应的平衡常数 B、乙中的平衡转化率等于 C、丙中反应逆向进行 D、6. 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:容器编号
起始时各物质物 质 的量 /mol
平衡时反应中的能量变化
SO3
SO2
O2
①
2
0
0
吸收热量akJ
②
0
2
1
放出热 量 bkJ
③
4
0
0
吸收热量ckJ
下列叙述正确的是( )
A、达平衡时O2的体积分数:①>③ B、热量关系:a一定等于b C、①②③ 反应的平衡常数:③>①>② D、①中的密度不再改变时说明反应已达到平衡状态7. 温度为 时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO(g)和 ,发生反应: .数据如下,下列说法正确的是( )容器
甲
乙
反应物
CO
CO
起始时物质的量(mol)
1.2
0.6
2.4
1.2
平衡时物质的量(mol)
0.9
0.3
a
b
A、甲容器中,平衡时,反应放出的热量为13.2kJ B、 时,反应的平衡常数 C、乙容器中,平衡时CO的转化率为35% D、平衡时,乙中CO的浓度是甲中的2倍8. 一定压强下,向10 L密闭容器中充入1molS2Cl2(g)和1 molCl2 , 发生反应:S2Cl2(g)+Cl2(g)⇌2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( ) A、A,B,C,D四点对应状态下,达到平衡状态的是B,D B、正反应的活化能大于逆反应的活化能 C、达到平衡后再加热,平衡向逆反应方向移动 D、在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变9. 在温度均为T℃的密闭容器中发生反应: 2SO2(g) + O2(g) 2SO3(g) ΔH<0。下列说法正确的是( )
A、A,B,C,D四点对应状态下,达到平衡状态的是B,D B、正反应的活化能大于逆反应的活化能 C、达到平衡后再加热,平衡向逆反应方向移动 D、在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变9. 在温度均为T℃的密闭容器中发生反应: 2SO2(g) + O2(g) 2SO3(g) ΔH<0。下列说法正确的是( )容器编号
容器类型
初始体积
起始物质的量/mol
达平衡时SO3
物质的量/mol
达平衡需要的时间/min
SO2
O2
SO3
Ⅰ
恒温恒容
1.0 L
2
1
0
1.6
5
Ⅱ
恒温恒压
1.0 L
2
1
0
a
t
A、a < 1.6 t < 5 B、选择不同的催化剂,该反应的反应速率和平衡转化率都将不同 C、反应达到平衡时,装置Ⅱ中SO2平均反应速率v = 0.32 mol·L-1·min-1 D、若起始时向容器Ⅰ中充入1 mol SO2、0.2 mol O2和4 mol SO3 , 则反应不移动10. 相同温度下,甲、乙两个恒容密闭容器中均进行反应: △H<0。实验过程中部分数据如表所示。容器
起始容积
物质的起始加入量
平衡时W的物质的量
甲
5 L
、
0.6 mol
乙
5 L
、 、 、
a
下列说法错误的是( )
A、a>1.8 mol B、平衡时,两容器中Z的物质的量:n(乙)<3n(甲) C、平衡时,两容器内的压强:p(乙)<3p(甲) D、升高乙容器温度,能使甲、乙两容器中X的体积分数相等11. 恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) 2C(g)。一段时间后达到平衡,生成a mol C。下列说法错误的是( )A、起始时刻和达到平衡后容器中的压强比为1:1 B、物质A,B的转化率之比一定是1:2 C、若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C D、当v正(A)=v逆(B)时,可断定反应达到平衡12. 某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述错误的是( )A、m=2 B、两次平衡的平衡常数相同 C、X与Y的平衡转化率之比为1:1 D、第二次平衡时,Z的浓度为0.4 mol·L-113. 一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g) 2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是( )A、4 mo1SO2和2mol O2 B、4mol SO2、2mo1 O2和2mol SO3 C、4mol SO2 . 和4 mo1 O2 D、6mo1 SO2和4 mo1 O214. 臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡。反应过程中测定的部分数据见下表:t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
下列有关说法正确的是( )
A、反应在0~3 s内的平均速率v(NO2)=0.24 mol·L−1·s−1 B、在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2 , 反应达到平衡时,压强为起始时的0.88倍 C、24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L−1 , 则反应的ΔH>0 D、在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2 , 达到平衡时,N2O5的转化率大于20%15. 在容积不变的密闭容器中进行反应:X2(g)+3Y2(g) 2Z2(g),若X2、Y2、Z2的初始物质的量浓度分别为0.10mol·L-1、0.30mol·L-1、0.20mol·L-1 , 当反应达到平衡时Z2的物质的量浓度不可能是( )A、0.05mol·L-1 B、0.20mol·L-1 C、0.35mol·L-1 D、0.40mol·L-116. 4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时移走2.0mol PCl3和1.0mol Cl2 , 相同温度下再达到平衡时PCl5的物质的量是( )A、0.8 mol B、小于0.4 mol C、0.4 mol D、大于0.4 mol,小于0.8 mol17. 一定温度下在甲、乙、丙三个体积相等且恒容的密闭容器中发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。投入NO2和SO2 , 起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是( )起始浓度
甲
乙
丙
c(NO2)/(mol·L-1)
0.10
0.20
0.20
c(SO2)/(mol·L-1)
0.10
0.10
0.20
A、容器甲中的反应在前2min的平均速率v(NO)=0.05mol·L-1·min-1 B、容器乙中若起始时改充0.10mol·L-1NO2和0.20mol·L-1SO2 , 达到平时c(NO)与原平衡相同 C、达到平衡时,容器丙中SO3的体积分数是容器甲中SO3的体积分数的2倍 D、达到平衡时,容器乙中NO2的转化率和容器丙中NO2的转化率相同二、多选题
-
18. 一定温度下,在3个体积均为1.0L的容量密闭容器中反应2H2(g)+CO(g)⇌CH3OH(g) 达到平衡,下列说法正确的是( )
容器
温度/℃
物质的起始浓度/mol•L﹣1
物质的平衡浓度/mol•L﹣1
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
Ⅰ
400
0.20
0.10
0
0.080
Ⅱ
400
0.40
0.20
0
Ⅲ
500
0
0
0.10
0.025
A、该方应的正反应放热 B、达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 C、达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 D、达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大19. 在温度T1和T2时,分别将0.5molCH4和1.2molNO2充入体积为1L的密闭容器中,发生反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g),测得有关数据如表:时间/min
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
……
0.15
下列说法正确的是( )
A、T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1 B、T2时CH4的平衡转化率为70.0% C、保持其他条件不变,T1时向平衡体系中再充入0.3molCH4和0.80molH2O(g),平衡向正反应方向移动 D、保持其他条件不变,T1时向平衡体系中再充入0.5molCH4和1.2molNO2 , 与原平衡相比,达新平衡时N2的浓度增大20. 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2 , 发生反应:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是( ) A、T℃时,该反应的化学平衡常数为 B、图中c点所示条件下,v(正)>v(逆) C、向a点平衡体系中充入一定量的NO2 , 达到平衡时,NO2的转化率比原平衡大 D、容器内的压强:Pa:Pb>6:721. 在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
A、T℃时,该反应的化学平衡常数为 B、图中c点所示条件下,v(正)>v(逆) C、向a点平衡体系中充入一定量的NO2 , 达到平衡时,NO2的转化率比原平衡大 D、容器内的压强:Pa:Pb>6:721. 在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )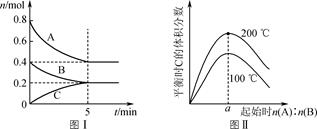 A、200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·(L·min)-1 B、图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的ΔH<0,且a=2 C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) D、200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.522. 温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
A、200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·(L·min)-1 B、图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的ΔH<0,且a=2 C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) D、200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.522. 温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是( )容器
物质的起始浓度(mol·L-1)
物质的平衡浓度
c(H2)
c(I2)
c(HI)
Ⅰ(恒容)
0.1
0.1
0
c(I2)=0.07 mol·L-1
Ⅱ(恒压)
0
0
0.6
A、反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3 B、两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ) C、温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K= 成立 D、达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆23.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:
N2(g)+3H2(g)⇌2NH3(g)△H=﹣192kJ•mol﹣1 . 向 M、N 中,都通入 xmol N2 和ymol H2的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
 A、若x:y=1;2,则平衡时,M中的转化率:N2>H2 B、若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% C、若x=1,y=3,则达到平衡时反应物的转化率N>M D、平衡时N2气体在两容器中体积分数可能相等24. 在固定容积的密闭容器中,充入2 mol A和1 mol B,发生反应如下:2A(g)+ B(g) ⇌XC(g),达到平街后,C的体积分数为w%。若维持容器体积和温度不变,按0.4 mol A,0.2 mol B和3.2 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值可能为( )A、1 B、2 C、3 D、425. 在恒压、SO2和O2的起始浓度一定的条件下,测得不同温度下SO2的平衡转化率如图所示。下列说法正确的是( )
A、若x:y=1;2,则平衡时,M中的转化率:N2>H2 B、若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% C、若x=1,y=3,则达到平衡时反应物的转化率N>M D、平衡时N2气体在两容器中体积分数可能相等24. 在固定容积的密闭容器中,充入2 mol A和1 mol B,发生反应如下:2A(g)+ B(g) ⇌XC(g),达到平街后,C的体积分数为w%。若维持容器体积和温度不变,按0.4 mol A,0.2 mol B和3.2 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值可能为( )A、1 B、2 C、3 D、425. 在恒压、SO2和O2的起始浓度一定的条件下,测得不同温度下SO2的平衡转化率如图所示。下列说法正确的是( ) A、若图中a点使用了催化剂,则b点没有使用催化剂 B、反应2SO2(g)+O2(g) 2SO3(g)的ΔH<0 C、若将起始n(SO2)和n(O2)变为原来的一半,图象发生改变 D、T1℃下,c起始(O2)=2.0×10-2 mol·L-1 , 则平衡常数K>5026. 在1L密闭容器中通入2mol氨气,在一定温度下,发生下列反应:2NH3 N2+3H2 , 达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )A、3molH2和1molN2 B、2molNH3和1molN2 C、2molN2和3molH2 D、0.1molNH3 , 0.95molN2和2.85molH2
A、若图中a点使用了催化剂,则b点没有使用催化剂 B、反应2SO2(g)+O2(g) 2SO3(g)的ΔH<0 C、若将起始n(SO2)和n(O2)变为原来的一半,图象发生改变 D、T1℃下,c起始(O2)=2.0×10-2 mol·L-1 , 则平衡常数K>5026. 在1L密闭容器中通入2mol氨气,在一定温度下,发生下列反应:2NH3 N2+3H2 , 达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )A、3molH2和1molN2 B、2molNH3和1molN2 C、2molN2和3molH2 D、0.1molNH3 , 0.95molN2和2.85molH2三、非选择题
-
27. 化学平衡是最重要的化学反应原理之一。(1)、现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g) C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
①在题干条件下,说明该反应已经达到平衡状态的有(填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是(填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=。
(2)、在一容积可变的密闭容器中充有10molCO和20molH2 , 发生CO(g)+2H2(g) CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①A、B、C三点的平衡常数KA、KB、KC的大小关系为。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为L。
(3)、以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为(填“A”或“B”),写出阳极的电极反应式。 28. 为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
28. 为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答: (1)、联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;;在图示转化过程中,太阳能除了储存在甲醇中,还储存在中(填化学式)。(2)、图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
(1)、联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;;在图示转化过程中,太阳能除了储存在甲醇中,还储存在中(填化学式)。(2)、图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJ•mo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJ•mol-1
△H =。
(3)、实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
①该反应适宜选用的催化剂为(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=;b、c点对应状态下反应物的有效碰撞几率bc(填“>”“<”或“=”),原因为。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=。 (KP为用分压表示的平衡常数)。
(4)、我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“•”标出,过渡态用TS表示。
四个过渡态中对反应速率影响最大的是 , 理由为;该步骤的化学方程式为。
29. 运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。(1)、CO还原NO的反应为 , 请回答下列问题:①已知该反应为自发反应,则该反应的反应热△H0(填“>”或“<”或“=”)
②已知:
则 △H =(用含a、b、c的表达式表示)。
③一定温度下,将2 mol CO、4 mol NO充入2 L密闭容器。5 min到达平衡,测得N2的物质的量为0.5 mol,则:
i.5min内v(NO)=。
ii.该条件下,可判断此反应到达平衡的标志是。
A.单位时间内,消耗2 mol CO同时形成1 mol N2
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
④某研究小组探究催化剂对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

i.由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为。
ii.若低于200℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因为。
(2)、用焦炭还原NO的反应为:。恒容恒温条件下,向体积均为1 L的甲、乙、两三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量n(NO)随反应时间(t)的变化情况如下表所示:容器
0
40
80
120
160
甲/400℃
2.00
1.5
1.10
0.80
0.80
乙/400℃
1.00
0.80
0.65
0.53
0.45
丙/T℃
2.00
1.45
1.00
1.00
1.00
①T400℃(填“>”或“<”)。
②乙容器达平衡时n(N2)=mol。
30. 二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:(1)、I:2SO2(g)+O2(g) 2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)为研究该反应,某同学设计了以下三种已装固体V2O5催化剂的密闭容器装置:

在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2进行投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为(用“甲、乙、丙”表示)。
(2)、在容器丙中,0.1 MPa条件下,在不同温度或不同投料方式下研究上述反应,得到数据如下表:实验序号
A组
B组
C组
反应温度
451℃
451℃
551℃
投料方式(按照SO2、O2、SO3的顺序)
2 mol 、1mol、0 mol
0mol 、0mol 、2mol
2mol 、1mol 、0mol
含硫化合物的转化
60%
b
c
反应的热量变化
放热a
吸热79.08kJ
放热
压强平衡常数(Kp)
Kp1
Kp1
Kp2
①表中:a= 。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=MPa-1。
③451℃时,若按0.4 mol SO2、0.4mol O2、0.4 mol SO3进行投料,则反应开始时v正(SO2)v逆(SO2)(填“>”、“<”或“=”)。
(3)、将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:Ⅱ:SO2(g)+NO2(g) SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g) 2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=;K3=(用含有K1、K2的表达式表示)。
31.(1)、Ⅰ.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行如下反应: A(g)+2B(g) 3C(g),已知起始时加入 3 mol A(g)和 2 mol B(g),达平衡后,生成 a mol C(g)。相同实验条件下,若在同一容器中改为开始加入 1.5 mol A 和 1 mol B,达平衡时 C 的 物质的量为mol(用含字母 a 的代数式表示),此时 C 在反应混合物中的体积分数 (填“增大”、“减小”或“不变”)。
(2)、相同实验条件下,若在同一容器中改为开始时加入 2 mol A 和 1 mol B,达平衡时,要 求 C 在混合物中体积分数与(1)相同,则开始时还需加入mol C。(3)、Ⅱ.向 BaSO4 中加入饱和 Na2CO3溶液,当溶液中 c(CO32-)=6 mol/L 时,有部分BaSO4转化成了 BaCO3 , 则此时 c(SO42-)=。(已知 Ksp(BaCO3)=2.6×10-9 , Ksp=(BaSO4)1.1×10-10)(4)、Ⅲ.25℃时,V1 L pH=2 的 HCl 和 V2 L pH=11 的 NaOH 溶液反应后 pH=9,则 V1∶V2= 。32. 甲醇是一种重要的有机原料,在催化剂的作用下,CO和H2反应可生成甲醇 (CH3OH) 和副产物CH4 , 反应如下:反应①CO(g)+2H2(g) CH3OH(g) △H1=-90.0kJ/mol
反 应②CO(g)+3H2(g) CH4(g) + H2O(g) △H2
反应③ CH4(g)+2H2O(g) CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
反应④CO(g)+ H2O(g) CO2(g) + H2(g) △H4=-25.0 kJ /mol
K1、K2、K3、K4分别表示反应①、②、③、④的平衡常数。
回答下列问题:
(1)、反应②的平衡常数的表达式为K2= , K2与K3和K4的关系为K2= , △H2=kJ/mol。(2)、图1中能正确表示反应①的平衡常数(lgK1) 随温度变化的曲线为(填曲线字母),其判断理由为。 (3)、恒温恒容的条件下,下列情况能说明反应①达到平衡状态的是__________________。A、2v正 (H2)=v逆(CH3OH) B、混合气体的密度不再改变 C、混合气体的平均摩尔质量不再改变 D、混合气体的压强不再改变(4)、为探究不同催化剂对CO和H2生成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1∶3进行实验,得到如下数据:
(3)、恒温恒容的条件下,下列情况能说明反应①达到平衡状态的是__________________。A、2v正 (H2)=v逆(CH3OH) B、混合气体的密度不再改变 C、混合气体的平均摩尔质量不再改变 D、混合气体的压强不再改变(4)、为探究不同催化剂对CO和H2生成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1∶3进行实验,得到如下数据:T/K
时间/min
催化剂种类
甲醇的含量(%)
450
10
CuO-ZnO
78
450
10
CuO-ZnO-ZrO2
88
450
10
ZnO-ZrO2
46

①由表1可知,反应①的最佳催化剂为 , 图2中a、b、c、d四点是该温度下CO平衡转化率的是。
②有利于提高CO转化为CH3OH的平衡转化率的措施有。
A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度
C.增大CO和H2的初始投料比 D.恒容下,再充入a molCO和3a mol H2
(5)、已知1000℃,反应CO(g)+ H2O(g) CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3mol•L-1、1mol•L-1、4mol•L-1、2mol•L-1 , 则此时上述反应的v正(CO)v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)= mol•L-1。33.有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
3A(g)+B(g)⇌2C(g)+D(g)
 (1)、达平衡时,a中A的浓度为M mol・L﹣1 , C的浓度为N mol・L﹣1 , b中A的浓度为m mol・L﹣1 , C的浓度为n mol・L﹣1 , 则Mm;Nn; (填“>”或“<”或“=”或“无法比较”)(2)、保持温度不变,按下列配比分别充入 a、b 两容器,达平衡后a中C的浓度为N mol・L﹣1的是 , b中C的浓度为n mol・L﹣1的是
(1)、达平衡时,a中A的浓度为M mol・L﹣1 , C的浓度为N mol・L﹣1 , b中A的浓度为m mol・L﹣1 , C的浓度为n mol・L﹣1 , 则Mm;Nn; (填“>”或“<”或“=”或“无法比较”)(2)、保持温度不变,按下列配比分别充入 a、b 两容器,达平衡后a中C的浓度为N mol・L﹣1的是 , b中C的浓度为n mol・L﹣1的是A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)、若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为Wmol・L﹣1 , C的浓度为Ymol・L﹣1 , 则W和M,Y和N之间的关系为WM、YN. (填>、<、=、无法比较)(4)、保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为R mol・L﹣1 , 则关系式正确的是A、R=2M B、R<M C、M<R<2M D、R>2M34. 工业上制备H2的一种重要方法是:CO(g)+H2O(g)⇌CO2 (g)+H2(g)△H=QkJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:时间/min
CO(g)
H2O(g)
CO2(g)
H2(g)
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
c1
c2
c3
c4
4
c1
c2
c3
c4
 (1)、Q0(填“>”、“=”或“<”).(2)、若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).(3)、上表中 c2为 mol/L,CO(g)的转化率为 .
(1)、Q0(填“>”、“=”或“<”).(2)、若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).(3)、上表中 c2为 mol/L,CO(g)的转化率为 .四、题目
-
35. 化学反应速率与限度在生产生活中的运用广泛。(1)、某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应生成的氢气(标准状况),实验记录如下表(累计值):
时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
在0~1 min、1~2 min、2~3min、3~4 min、4~5 min时间段中,反应速率最大的时间段是 , 原因为。
(2)、反应在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率(填“增大”、“不变”或“减小”,下同),保持体积不变,充入Ar使体系压强增大,其逆反应速率。(3)、一定温度下,将3 mol气体A和1 mol气体B通入一体积为2 L的恒容密闭容器中,发生反应:。1 min时,测得剩余1.8 mol A,C的浓度为0.4 mol/L。①x=。
②反应经2 min达到平衡,平衡时C的浓度(填“大于”、“小于”或“等于”)1 mol/L。
③达到平衡时,容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达到平衡时反应物A的转化率:。