高考二轮复习知识点:化学平衡状态的判断
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
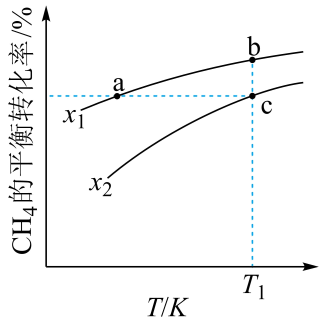 A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态2. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:
A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态2. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:, 测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
 A、实验①, , B、实验②,时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大3. 溶液与 溶液发生反应: ,达到平衡。下列说法错误的是( )A、加入苯,振荡,平衡正向移动 B、经苯2次萃取分离后,在水溶液中加入 ,溶液呈血红色,表明该化学反应存在限度 C、加入 固体,平衡逆向移动 D、该反应的平衡常数4. 在绝热恒容的容器中发生 , C的浓度变化如图所示,下列说法正确的是( )
A、实验①, , B、实验②,时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大3. 溶液与 溶液发生反应: ,达到平衡。下列说法错误的是( )A、加入苯,振荡,平衡正向移动 B、经苯2次萃取分离后,在水溶液中加入 ,溶液呈血红色,表明该化学反应存在限度 C、加入 固体,平衡逆向移动 D、该反应的平衡常数4. 在绝热恒容的容器中发生 , C的浓度变化如图所示,下列说法正确的是( ) A、当容器的压强不发生改变时,化学反应达到平衡状态 B、在10min时,的反应速度为 C、增加反应物A,可提高的转化率 D、不同时刻都存在 , 平衡常数为5. 煤气化的主要反应为: C(s)+ H2O(g)CO(g) + H2(g)下列有关叙述错误的是( )A、升高温度,可加快反应速率 B、将块状固体粉碎,可加快反应速率 C、平衡时,反应停止了 D、平衡时,CO的浓度不再改变6. 一定温度下,在三个体积均为 的恒容密闭容器中发生反应:
A、当容器的压强不发生改变时,化学反应达到平衡状态 B、在10min时,的反应速度为 C、增加反应物A,可提高的转化率 D、不同时刻都存在 , 平衡常数为5. 煤气化的主要反应为: C(s)+ H2O(g)CO(g) + H2(g)下列有关叙述错误的是( )A、升高温度,可加快反应速率 B、将块状固体粉碎,可加快反应速率 C、平衡时,反应停止了 D、平衡时,CO的浓度不再改变6. 一定温度下,在三个体积均为 的恒容密闭容器中发生反应:容器编号
温度( )
起始物质的量( )
平衡物质的量( )
①
387
0.20
0.080
0.080
②
387
0.40
③
207
0.20
0.090
0.090
下列说法正确的是( )
A、该反应的正反应为吸热反应 B、达到平衡时,容器①中的 体积分数比容器②中的小 C、若容器①中反应达到平衡时增大压强,则各物质浓度保持不变 D、若起始向容器①中充入 、 、 ,则反应将向正反应方向进行7. 一定温度下,在 的恒容密闭容器中发生反应 ,反应过程中的部分数据如下表所示。下列说法正确的是( )n/mol
t/min
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
A、物质B的平衡转化率为 B、该反应在 后才达到平衡 C、平衡状态时, D、 用A表示的平均反应速率为8. 硝基苯甲酸乙酯(O2NC6H4COOC2H5)在碱性条件下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH,两种反应物初始浓度均为0.05mol·L-1 , 测得O2NC6H4COOC2H5的转化率α随时间t变化曲线如下图所示(忽略溶液体积变化)。下列说法错误的是( ) A、t=700s时,反应达到平衡状态 B、t=600s时,硝基苯甲酸乙酯的浓度为0.015mol·L-1 C、达到平衡之前,随着反应的进行硝基苯甲酸乙酯水解速率逐渐减小 D、其他条件不变,提高c(OH-),可使该反应的化学平衡常数增大9. 一定温度下,在容积为1 L的恒容密闭容器中发生反应X(g)+2Y(g) Z(g) ΔH,各物质的物质的量随时间变化如表。
A、t=700s时,反应达到平衡状态 B、t=600s时,硝基苯甲酸乙酯的浓度为0.015mol·L-1 C、达到平衡之前,随着反应的进行硝基苯甲酸乙酯水解速率逐渐减小 D、其他条件不变,提高c(OH-),可使该反应的化学平衡常数增大9. 一定温度下,在容积为1 L的恒容密闭容器中发生反应X(g)+2Y(g) Z(g) ΔH,各物质的物质的量随时间变化如表。时间/ min
0
t
2t
3t
4t
n(X)/mol
2
0.4
n(Y)/mol
4
0.8
n(Z)/mol
0
1.4
下列说法正确的是( )
A、若升高温度,X(g)的转化率减小,则该反应的ΔH >0 B、0~3t min内,v(Z)= mol· L-1·min-1 C、单位时间内消耗X(g)和生成Z(g)的物质的量相等,说明该反应达到平衡 D、其他条件不变,增大Y(g)的浓度,平衡正向移动,该反应的平衡常数增大10. 研究NOx之间的转化对大气污染控制具有重要意义,已知:。如图所示,在恒容密闭容器中,反应温度为T1时,c(N2O4)和c(NO2)随t变化为曲线I、II,改变温度到T2 , c(NO2)随t变化为曲线III。下列判断正确的是( ) A、温度T1>T2 B、反应速率v(a)=v(b) C、在T1温度下,反应至t1时达平衡状态 D、在T1温度下,反应在0—t3内的平均速率为11. 焦炭还原二氧化硫对于烟气脱硫具有重要意义。该反应的化学方程式为2C(s)+2SO2(g)S2(g)+2CO2(g) ∆H<0。向1 L密闭容器中加入足量的焦炭和1 mol SO2发生上述反应。其他条件一定,在甲、乙两种催化剂作用下,反应相同时间,测得SO2(g)转化率与温度的关系如下图所示。下列说法正确的是( )
A、温度T1>T2 B、反应速率v(a)=v(b) C、在T1温度下,反应至t1时达平衡状态 D、在T1温度下,反应在0—t3内的平均速率为11. 焦炭还原二氧化硫对于烟气脱硫具有重要意义。该反应的化学方程式为2C(s)+2SO2(g)S2(g)+2CO2(g) ∆H<0。向1 L密闭容器中加入足量的焦炭和1 mol SO2发生上述反应。其他条件一定,在甲、乙两种催化剂作用下,反应相同时间,测得SO2(g)转化率与温度的关系如下图所示。下列说法正确的是( ) A、该反应的∆S<0 B、生成1molSO2同时消耗1molCO2 , 可判断反应到达平衡 C、若反应足够的时间,图中两条曲线可能会完全重合 D、该反应适宜的条件是选用甲催化剂,反应温度在500℃左右12. 在容积不变的密闭容器中,有反应:A(g)+B(g) 2C(g)+D(s),在一定温度下,能表明该反应达到平衡的是下列物理量中的( )A、混合气体的压强 B、混合气体的质量 C、混合气体的总物质的量浓度 D、混合气体的总物质的量13. 羰基硫(COS)是以煤、石油、天然气为原料生产的化工原料气中有机硫的主要形式。COS催化水解的反应为:COS(g)+H2O(g) CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如下图所示:
A、该反应的∆S<0 B、生成1molSO2同时消耗1molCO2 , 可判断反应到达平衡 C、若反应足够的时间,图中两条曲线可能会完全重合 D、该反应适宜的条件是选用甲催化剂,反应温度在500℃左右12. 在容积不变的密闭容器中,有反应:A(g)+B(g) 2C(g)+D(s),在一定温度下,能表明该反应达到平衡的是下列物理量中的( )A、混合气体的压强 B、混合气体的质量 C、混合气体的总物质的量浓度 D、混合气体的总物质的量13. 羰基硫(COS)是以煤、石油、天然气为原料生产的化工原料气中有机硫的主要形式。COS催化水解的反应为:COS(g)+H2O(g) CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如下图所示:
下列说法正确的是( )
A、N点为该反应达到平衡状态的点 B、正反应的平均反应速率:P>N>M C、任何温度下,γ-Al2O3的催化效果都比TiO2好 D、150℃时,用γ-Al2O3做催化剂,达到平衡时CO2的体积分数最大14. 一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入A和B,发生反应:3A(g)+B(g)⇌2C(g) ∆H>0,448 K时该反应的化学平衡常数K=1,反应体系中各物质的物质的量浓度的相关数据如下:容器
温度/K
起始时物质的浓度/(mol·L−1)
10分钟时物质的浓度/(mol·L−1)
c(A)
c(B)
c(C)
甲
448
3
1
0.5
乙
T1
3
1
0.4
丙
448
3
2
a
下列说法错误的是( )
A、甲中,10分钟内A的化学反应速率:υ(A)=0.075 mol·L−1·min−1 B、甲中,10分钟时反应已达到化学平衡状态 C、乙中,T1<448 K、K乙<K甲 D、丙中,达到化学平衡状态时A的转化率大于25%15. K2Cr2O7溶液中存在平衡: 。用K2Cr2O7溶液进行下列实验。下列说法错误的是( ) A、①中 和 浓度相等说明反应达平衡 B、①中溶液橙色加深,③中溶液变黄 C、②中 被C2H5OH还原为Cr3+ D、若向④中加入70%H2SO4溶液至过量,溶液变为绿色
A、①中 和 浓度相等说明反应达平衡 B、①中溶液橙色加深,③中溶液变黄 C、②中 被C2H5OH还原为Cr3+ D、若向④中加入70%H2SO4溶液至过量,溶液变为绿色二、多选题
-
16. 已知: ,向一恒温恒容的密闭容器中充入 和 发生反应, 时达到平衡状态I,在 时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
 A、容器内压强不变,表明反应达到平衡 B、 时改变的条件:向容器中加入C C、平衡时A的体积分数 : D、平衡常数K:17. 一定温度和压强下,在两个容积均为1L的密闭容器中,充入一定量的A和B,发生反应:。相关反应数据如下表所示(已知在、下,A、B、C、D都是气态)
A、容器内压强不变,表明反应达到平衡 B、 时改变的条件:向容器中加入C C、平衡时A的体积分数 : D、平衡常数K:17. 一定温度和压强下,在两个容积均为1L的密闭容器中,充入一定量的A和B,发生反应:。相关反应数据如下表所示(已知在、下,A、B、C、D都是气态)容器编号
压强
温度
起始物质的量/mol
10s时物质的量/mol
A
B
C
Ⅰ
0.2
0.2
0.05
Ⅱ
0.2
0.2
0.05
Ⅲ
0.2
0.2
0.05
下列说法正确的是
A、该反应的 B、在容器Ⅲ中,A,B中至少有一种呈非气态 C、10s时,容器Ⅱ中的反应一定处于平衡状态 D、若起始时,向容器II中充入、、和 , 反应将向正反应方向进行18. 在一定条件下的恒容密闭容器中发生可逆反应4X(g)3Y(g)+Z(s),下列能说明该反应达到化学平衡状态的是( )A、混合气体的密度不再变化 B、体系压强不再变化 C、X、Y、Z的物质的量之比为4:3:1 D、4v正(X)=3v逆(Y)19. 工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1mol CO2和3 mol H2 , 一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示。下列描述正确的是 ( ) A、达到平衡时,H2的转化率为75% B、3 min 时,CH3OH和CO2的浓度相等,达到了化学平衡状态 C、反应进行到10 min时,CO2的正逆反应速率相等,反应停止 D、反应开始到10 min,用CO2表示的反应速率为0.0375 mol·L-1·min-120. 在一定温度下的某恒容密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是( )A、体系压强不再发生变化 B、v正(CO)=v逆(H2O) C、生成 n molCO 的同时生成 n mol H2 D、1 mol H−H 键断裂的同时形成 2 mol H−O 键21. 一定温度下, 在2L的密闭容器内发生反应: H2(g)+I2(g)=2HI(g) △H>0。下列说法不能说明该反应达到平衡状态的是( )A、容器气体内颜色不再变化 B、v正(H2)=v逆(I2) C、容器内压强不再变化 D、单位时间内消耗H2(g)和I2(g)的物质的量相等22. 一定温度下,体积固定的密闭容器中发生反应:A(s)+3B(g) 2C(g)+2D(g),下列描述中不能说明该反应达到平衡状态的是( )A、容器中的压强不再变化 B、混合气体的密度不再变化 C、n(A)∶n(B)∶n(C)∶n(D)=1∶3∶2∶2 D、单位时间内生成a mol A,同时消耗2a mol D23. 一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( )
A、达到平衡时,H2的转化率为75% B、3 min 时,CH3OH和CO2的浓度相等,达到了化学平衡状态 C、反应进行到10 min时,CO2的正逆反应速率相等,反应停止 D、反应开始到10 min,用CO2表示的反应速率为0.0375 mol·L-1·min-120. 在一定温度下的某恒容密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是( )A、体系压强不再发生变化 B、v正(CO)=v逆(H2O) C、生成 n molCO 的同时生成 n mol H2 D、1 mol H−H 键断裂的同时形成 2 mol H−O 键21. 一定温度下, 在2L的密闭容器内发生反应: H2(g)+I2(g)=2HI(g) △H>0。下列说法不能说明该反应达到平衡状态的是( )A、容器气体内颜色不再变化 B、v正(H2)=v逆(I2) C、容器内压强不再变化 D、单位时间内消耗H2(g)和I2(g)的物质的量相等22. 一定温度下,体积固定的密闭容器中发生反应:A(s)+3B(g) 2C(g)+2D(g),下列描述中不能说明该反应达到平衡状态的是( )A、容器中的压强不再变化 B、混合气体的密度不再变化 C、n(A)∶n(B)∶n(C)∶n(D)=1∶3∶2∶2 D、单位时间内生成a mol A,同时消耗2a mol D23. 一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( ) A、t1时刻,υ(正)< υ(逆) B、t2时刻,υ(正)> υ(逆) C、t3时刻,υ(正)= υ(逆) D、t4时刻,υ(正)= υ(逆)24. 在一定温度下,反应 H2(g)+I2(g)⇌2HI(g)达到平衡的标志是( )A、单位时间内生成1 mol的H2 , 同时生成2 mol 的HI B、容器内的总压强不随时间的变化而变化 C、1mol I﹣I 键断裂的同时有2mol HI键形成 D、容器内气体颜色不再变化25. 在一定温度下,可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志是( )A、容器内的压强不随时间变化 B、A,B,C的浓度不再变化 C、单位时间内生成n mol A,同时消耗2n mol C D、A,B,C的分子数之比为1:3:2
A、t1时刻,υ(正)< υ(逆) B、t2时刻,υ(正)> υ(逆) C、t3时刻,υ(正)= υ(逆) D、t4时刻,υ(正)= υ(逆)24. 在一定温度下,反应 H2(g)+I2(g)⇌2HI(g)达到平衡的标志是( )A、单位时间内生成1 mol的H2 , 同时生成2 mol 的HI B、容器内的总压强不随时间的变化而变化 C、1mol I﹣I 键断裂的同时有2mol HI键形成 D、容器内气体颜色不再变化25. 在一定温度下,可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志是( )A、容器内的压强不随时间变化 B、A,B,C的浓度不再变化 C、单位时间内生成n mol A,同时消耗2n mol C D、A,B,C的分子数之比为1:3:2三、非选择题
-
26. S8在300℃左右会分解成S2 , 过程中吸收热量;烟气中的SO2可催化还原成硫蒸气,主要涉及以下反应:
①2SO2(g)+CH4(g) S8(g)+CO2(g)+2H2O(g)+Q1(Q1>0)
②2SO2(g)+CH4(g) S2(g)+CO2(g)+2H2O(g)+Q2(Q2>0)
在容积固定的2 L密闭容器中,通入2 mol SO2和1 mol CH4 , 一定条件下发生上述反应。完成下列填空:
(1)、Q1Q2(选填“>”或“<”)。能说明反应已达平衡状态的是。(选填编号)A.CO2物质的量浓度不变 B.气体密度不变
C.容器内压强不变 D.容器内SO2与CH4的物质的量之比不变
(2)、如图为相同时间内测得SO2的转化率随温度变化情况。
a点是否已达到化学平衡状态?(选填“是”或“否”)。随着温度升高,SO2转化率先升后降的原因是。
(3)、如图为某温度时,SO2和CH4的物质的量随时间变化情况。
0~2 h内,v(CH4)=。温度不变,若要提高SO2的平衡转化率可采取的措施是(任写一条)。
(4)、烟气中的SO2常用氨水吸收。向氨水中通入SO2 , 测得溶液的pH与各含硫组分物质的量分数的关系如图所示。溶液的pH=7时,n(SO)∶n(HSO)≈。氨水吸收烟气中SO2后,经O2催化氧化可得到硫酸盐。控制合适的温度,随着氧化的进行,溶液的pH(选填“增大” 或“减小”)。 27. CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。(1)、Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:
27. CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。(1)、Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:
液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=kJ/mol。
(2)、在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是A、增大CO2的浓度,有利于NH3的转化率增大 B、反应在任何温度下都能自发进行 C、当混合气体的密度不再发生改变时反应达平衡状态 D、充入He,压强增大,平衡向正反应移动(3)、Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2 , 加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为(保留2位有效数字)。
(4)、制备“合成气”反应历程分两步:步骤
反应
正反应速率方程
逆反应速率方程
反应①
CH4(g) C(ads)+2H2(g)
v正=k1·c(CH4)
v逆=k2·c2(H2)
反应②
C(ads)+CO2(g) CO(g)
v正=k3·c(CO2)
v逆=k4·c2(CO)
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
①反应速率快慢比较:反应①反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=(用k1、k2、k3、k4表示)。
(5)、制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随着进料比 的增加, 的值(填“增大”、“不变”或“减小”),其原因是。
28. 化学链燃烧是利用载氧体将空气中的氧传输至燃料的新技术。基于 载氧体的丙烷化学链燃烧技术原理如图所示。
空气反应器与燃料反应器中发生的反应分别如下:
反应1:
反应2:
反应3:
请回答下列问题:
(1)、反应1在(填“高温”、“低温”或“任意温度”)下能自发。(2)、反应2的平衡常数表达式 , 。(3)、一定温度下,在容积可变的密闭容器中加入足量 和适量的 发生反应1,达到平衡时测得气体压强为 。①温度不变,将容器体积扩大至原来的2倍且不再改变,达到新的平衡时,气体压强 。
②当 的质量不变时,(填“能”或“不能”)说明该反应达到平衡状态。
③若达到平衡之后,保持恒温恒容条件下再充入少量 ,平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡之后, 的平衡转化率(填“增大”、“减小”或“不变”)。
(4)、在一定温度下,总压强恒定为 ,在密闭容器中加入丙烷和氨气的混合气体以及足量 ,只发生上述反应2(氨气不参与反应),测得丙烷的平衡转化率与投料比 的关系如图所示。随着投料比 增大, 的平衡转化率减小的原因是。 29. 目前,大规模和低成本制取氢能实质上都是通过烃重整实现的,该过程主要是甲烷水蒸汽重整,包括以下两步气相化学催化反应:
29. 目前,大规模和低成本制取氢能实质上都是通过烃重整实现的,该过程主要是甲烷水蒸汽重整,包括以下两步气相化学催化反应:反应I:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206 kJ∙mol−1
反应II:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=−41 kJ∙mol−1
(1)、则反应:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=(2)、已知在某种催化剂的作用下,反应I的正反应的活化能为312 kJ∙mol−1 , 则该反应逆反应的活化能为。(3)、将2molCO和1molH2O充入某容积不变的绝热密闭容器中,发生反应II。①能判断反应:CO(g)+H2O(g) CO2(g)+H2(g)达到平衡的是。
A.CO的消耗速率等于CO2的消耗速率
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D.容器内气体压强不再变化
②达到平衡时,氢气的物质的量分数为20%,则CO的转化率为 , 计算该温度时反应的平衡常数K=。
(4)、下图表示反应时间均为6小时,甲烷水蒸汽重整法制氢气使用不同催化剂时氢气的产率与温度的关系。判断a点是否处于平衡状态:(填“是”或“否”),分析该反应750℃以后氢气的产率趋于相同的原因是。 30. 在起始温度相同(T℃)的条件下,分别向容积相同的密闭容器甲、乙、丙中加入等量NH4I(s),发生反应:NH4I(s)NH3(g)+HI(g) ΔH>0,2HI(g)I2(g)+H2(g) ΔH>0,容器如图所示。
30. 在起始温度相同(T℃)的条件下,分别向容积相同的密闭容器甲、乙、丙中加入等量NH4I(s),发生反应:NH4I(s)NH3(g)+HI(g) ΔH>0,2HI(g)I2(g)+H2(g) ΔH>0,容器如图所示。
回答下列问题:
(1)、在甲容器中,不能作为2HI(g)I2(g)+H2(g)达到平衡的依据是(填标号)。a.气体颜色不变 b.气体压强不变
c.气体温度不变 d.混合气体的平均相对分子质量不变
(2)、乙容器中反应达平衡后,再充入He,则反应2HI(g)I2(g)+H2(g)的平衡移动(填“正反应方向”“逆反应方向”或“不”)。(3)、在反应过程中,测得丙容器中HI、H2的物质的量(c)随时间(t)变化如图所示。
已知:在T℃时,2HI(g)I2(g)+H2(g)的平衡常数K=。
①曲线b代表的变化曲线(填化学式);
②2min内,用NH3表示的反应速率为 , HI的分解率为。
③T℃时,若在丙容器中加入I2(g)和H2(g)各1mol;反应达平衡后,放出7.6kJ的热量,则I2(g)与H2(g)反应的热化学方程式为。
(4)、甲、乙、丙三个容器中反应均达到平衡时,I2(g)的体积分数由大到小的顺序是。31. “十三五”期间,中国应对气候变化工作取得显著成效,并向国际社会承诺2030年前“碳达峰”,2060年前实现“碳中和”。CO2的回收及综合利用越来越受到国际社会的重视,故有效开发利用CO2成为科研热点。回答下列问题:(1)、CO2合成淀粉2021年9月23日,中国科学院召开新闻发布会,介绍我国科学家历时6年多科研攻关,世界上首次在实验室中实现从二氧化碳到淀粉分子的全合成。提纯含有氯化钠杂质的淀粉溶液的方法为。
(2)、CO2合成二甲醚存在反应:
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
II.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH2
①在一定条件下,仅发生反应II.在该条件下,向5L恒容密闭容器中充人物质的量之比为1:3的CO2和H2混合气体,在不同催化剂作用下合成二甲醚,相同时间内CO2的转化率随温度变化如图所示。

其中在催化剂(填“A”“B”或“C”)作用下,可使该反应的活化能最小。若忽略温度对催化剂的影响,则ΔH20(填“>”或“<”),理由是。
②一定温度下,向填充有催化剂的恒容密闭容器中充入等物质的量的CO2和H2 , 同时发生反应I和反应II,15min末反应达到平衡。测得反应前容器内压强为Po , 平衡时二甲醚气体的分压为P1 , 氢气的分压为P2.
(I)下列事实能说明容器内反应均达到平衡状态的是()。
A.氢氢键不再断裂 B.CO2与H2的个数之比不再改变
C.容器内气体的压强不再改变 D.容器内气体的密度不再改变
(II)二氧化碳的平衡转化率为(用含Po、P1、P2的代数式表示)。
(II)该温度下,反应II的平衡常数KP=(以分压表示,分压=总压×物质的量分数,用含P0、P1、P2的代数式表示)。
③二甲醚常用作燃料电池的燃料,若使用了1kg二甲醚,则理论上电路中通过的电量为库仑(保留两位有效数字,已知e=1.60x10-19C).
(3)、CO2制甲醇(MT)和二甲醚(DME)我国科研团队研究发现使用GaZrOx 双金属氧化物催化剂实现CO2加氢制甲醇(MT)和二甲醚(DME)的活性明显优于纯Ga2O3和ZrO2催化剂,其反应机理如图所示。下列有关叙述正确的是____。 A、步骤a→b有化学键的断裂和形成 B、中间体c可通过氢化等步骤得到甲醇(MT)和二甲醚(DME) C、反应过程中Ga的成键数目保持不变 D、氧空位用于捕获CO2 , 氧空位个数越多,速率越快32. SO2是一种污染性气体,减少SO2在大气中的排放是环境保护的重要内容回答下列问题:(1)、已知:S(s)+O2(g)=SO2(g) ∆H=-297.2kJ·mol-1 , CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ∆H=-295.9kJ·mol-1 , 若CH4(g)+2O2(g)=CO2(g)+2H2O(l)反应物的能量为E1 , 则生成物的能量E2是(2)、利用反应:C(s)+SO2(g)CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是反应(填“放热”、“吸热”),理由是。
A、步骤a→b有化学键的断裂和形成 B、中间体c可通过氢化等步骤得到甲醇(MT)和二甲醚(DME) C、反应过程中Ga的成键数目保持不变 D、氧空位用于捕获CO2 , 氧空位个数越多,速率越快32. SO2是一种污染性气体,减少SO2在大气中的排放是环境保护的重要内容回答下列问题:(1)、已知:S(s)+O2(g)=SO2(g) ∆H=-297.2kJ·mol-1 , CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ∆H=-295.9kJ·mol-1 , 若CH4(g)+2O2(g)=CO2(g)+2H2O(l)反应物的能量为E1 , 则生成物的能量E2是(2)、利用反应:C(s)+SO2(g)CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是反应(填“放热”、“吸热”),理由是。 (3)、恒温恒容条件下,下列事实不能说明反应C(s)+SO2(g)CO2(g)+S(g)达到平衡状态的是____(填字母)A、不变 B、v(CO2)正=v(SO2)逆 C、混合气体的总压强不再改变 D、混合气体的密度不再改变(4)、800℃,在1.0L的恒容密闭容器中投入1.0molSO2和120gC,容器中压强为p0kPa,发生反应C(s)+SO2(g)CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)kPa·min-1 , 800℃的化学平衡常数Kc=mol/L。(5)、用电化学原理吸收烟道气中SO2以减少其排放,其装置示意图。H2O2从口进入,电路中通过1mol电子时,正极区溶液的c(H+)将 , 负极区n(H2SO4)=。
(3)、恒温恒容条件下,下列事实不能说明反应C(s)+SO2(g)CO2(g)+S(g)达到平衡状态的是____(填字母)A、不变 B、v(CO2)正=v(SO2)逆 C、混合气体的总压强不再改变 D、混合气体的密度不再改变(4)、800℃,在1.0L的恒容密闭容器中投入1.0molSO2和120gC,容器中压强为p0kPa,发生反应C(s)+SO2(g)CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)kPa·min-1 , 800℃的化学平衡常数Kc=mol/L。(5)、用电化学原理吸收烟道气中SO2以减少其排放,其装置示意图。H2O2从口进入,电路中通过1mol电子时,正极区溶液的c(H+)将 , 负极区n(H2SO4)=。 33. 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:(1)、已知:
33. 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:(1)、已知:则H2(g)还原烟气中的SO2(g)的热化学方程式为。
(2)、在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应 。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)= mol/(L·s),平衡时,c(SO2)=mol/L;若平衡后升高温度,SO2的转化率将(填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=L/mol;平衡状态由A变到B,平衡常数K(A) (填“>”“<”或“=”)K(B)。

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是(填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
34. SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。(1)、上述四种气体中直接排人空气时会引起酸雨的有(填化学式)。(2)、已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-12NO(g)+O2(g) 2NO2(g) △H=-113.0 kJ·mol-1
①反应:NO2(g)+SO2(g) SO3(g)+NO(g)的△H=kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g) SO3(g)+NO(g),下列能说明反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变.
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
③测得②中反应达到平衡时NO与NO2的体积之比为37:13,则在该温度下反应:NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
(3)、CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器中充有10 molCO与20 mol H2 , 在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。下列说法正确的是 (填字母)。
 A、合成甲醇的反应为吸热反应 B、压强为p1>p2 C、A,B,C三点的平衡常数为KA=KB>KC D、若达平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积也为10L35. “加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题。工业生产产生的含 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。(1)、在一定条件下,肼( )与 反应能生成 和 。
A、合成甲醇的反应为吸热反应 B、压强为p1>p2 C、A,B,C三点的平衡常数为KA=KB>KC D、若达平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积也为10L35. “加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题。工业生产产生的含 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。(1)、在一定条件下,肼( )与 反应能生成 和 。已知:① ;
② ;
③ ;
则反应 的 。
(2)、在一恒容密闭容器中发生反应: 。当温度高于250℃时,正、逆反应速率分别为 分别为正、逆反应速率常数, 、 与该反应的平衡常数 之间的关系为。速率常数 随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数(填“>”、“<”或“=”) 增大的倍数。(3)、在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为 。向两个容积均为2L的恒容密闭容器中均分别充入 和 ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为 ,曲线II代表的体系平衡后气体的总压强为 。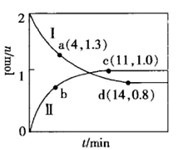
①代表220℃条件下的变化曲线为(填“I”或“II”);ad段 的平均反应速率为 。
②下列有关曲线II条件下的反应的说法正确的是(填标号)。
A.当体系中 与 的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
③图中a、c、d三点对应的逆反应速率由大到小的顺序为(用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp= (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。