高考二轮复习知识点:化学平衡移动原理2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 恒容密闭容器中, 在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )
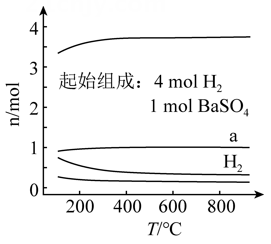 A、该反应的 B、a为 随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入 的平衡转化率增大2. 某温度下,在恒容密闭容器中加入一定量X,发生反应 ,一段时间后达到平衡。下列说法错误的是( )A、升高温度,若 增大,则 B、加入一定量Z,达新平衡后 减小 C、加入等物质的量的Y和Z,达新平衡后 增大 D、加入一定量氩气,平衡不移动3. 向2L容密闭容器中投入一定量的CO和 , 发生如下反应: , CO的平衡转化率与温度、投料比[]的关系如下图所示。( )
A、该反应的 B、a为 随温度的变化曲线 C、向平衡体系中充入惰性气体,平衡不移动 D、向平衡体系中加入 的平衡转化率增大2. 某温度下,在恒容密闭容器中加入一定量X,发生反应 ,一段时间后达到平衡。下列说法错误的是( )A、升高温度,若 增大,则 B、加入一定量Z,达新平衡后 减小 C、加入等物质的量的Y和Z,达新平衡后 增大 D、加入一定量氩气,平衡不移动3. 向2L容密闭容器中投入一定量的CO和 , 发生如下反应: , CO的平衡转化率与温度、投料比[]的关系如下图所示。( ) A、 B、投料比: C、在400K、条件下,反应Ⅰ的平衡常数的值为0.25 D、在500K、条件下,增大压强,CO的平衡转化率能从Y点到Z点4. 氢气是一种可再生的绿色能源,也是重要的化工原料,天然气在催化剂作用下热解可制得氢气,其反应如下:ΔH=+74.81kJ·mol-1 , 关于上述反应,以下叙述正确的是( )A、反应达平衡时,恒温恒压下通入惰性气体,会加快正反应速率,使平衡正向移动 B、反应达平衡时,恒温恒容下加入C(s),会加快逆反应速率,使平衡逆向移动 C、当H2(g)的生成速率是CH4(g)消耗速率的2倍时,说明反应达到了平衡状态 D、正反应活化能大于逆反应活化能5. 将铜片与足量浓盐酸混合加热,铜片溶解,有气泡产生,溶液呈无色。已知: Cu++3Cl-CuCl(无色) K=5.0×105; Ksp(CuCl)=1.2×10-6 , 下 列说法错误的是( )A、铜片表面产生的气体为H2 B、金属活泼性顺序是有一定前提条件的 C、将反应后的溶液稀释,无沉淀产生 D、铜不与稀盐酸反应主要因c(Cl-)不够大6. 和 存在平衡: 。下列分析正确的是( )A、 平衡混合气体中含N原子大于 B、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 C、恒容时,充入少量 ,平衡正向移动导致气体颜色变浅 D、断裂 中的共价健所需能量大于断裂 中的共价健所需能量7. 某温度下,改变0.1mol/L 溶液的pH时,各种含铬元素粒子及 浓度变化如图所示(已知 a是二元酸),下列有关说法正确的是( )
A、 B、投料比: C、在400K、条件下,反应Ⅰ的平衡常数的值为0.25 D、在500K、条件下,增大压强,CO的平衡转化率能从Y点到Z点4. 氢气是一种可再生的绿色能源,也是重要的化工原料,天然气在催化剂作用下热解可制得氢气,其反应如下:ΔH=+74.81kJ·mol-1 , 关于上述反应,以下叙述正确的是( )A、反应达平衡时,恒温恒压下通入惰性气体,会加快正反应速率,使平衡正向移动 B、反应达平衡时,恒温恒容下加入C(s),会加快逆反应速率,使平衡逆向移动 C、当H2(g)的生成速率是CH4(g)消耗速率的2倍时,说明反应达到了平衡状态 D、正反应活化能大于逆反应活化能5. 将铜片与足量浓盐酸混合加热,铜片溶解,有气泡产生,溶液呈无色。已知: Cu++3Cl-CuCl(无色) K=5.0×105; Ksp(CuCl)=1.2×10-6 , 下 列说法错误的是( )A、铜片表面产生的气体为H2 B、金属活泼性顺序是有一定前提条件的 C、将反应后的溶液稀释,无沉淀产生 D、铜不与稀盐酸反应主要因c(Cl-)不够大6. 和 存在平衡: 。下列分析正确的是( )A、 平衡混合气体中含N原子大于 B、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 C、恒容时,充入少量 ,平衡正向移动导致气体颜色变浅 D、断裂 中的共价健所需能量大于断裂 中的共价健所需能量7. 某温度下,改变0.1mol/L 溶液的pH时,各种含铬元素粒子及 浓度变化如图所示(已知 a是二元酸),下列有关说法正确的是( ) A、该温度下的 B、溶液中存在平衡 ,且该温度下此反应的平衡常数 C、E点溶液中存在: D、向 溶液中,加入一定量NaOH固体,溶液橙色加深8. 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领城,该反应的热化学方程式是2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH=mkJ·mol-1。理论计算表明,原料初始组成n(CO2):n(H2)=1:3。在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数随温度的变化如图所示。下列说法错误的是( )
A、该温度下的 B、溶液中存在平衡 ,且该温度下此反应的平衡常数 C、E点溶液中存在: D、向 溶液中,加入一定量NaOH固体,溶液橙色加深8. 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领城,该反应的热化学方程式是2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH=mkJ·mol-1。理论计算表明,原料初始组成n(CO2):n(H2)=1:3。在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数随温度的变化如图所示。下列说法错误的是( ) A、m<0 B、500K下反应达到平衡时,若增大压强(减小容器容积),则n(C2H4)增大 C、X点坐标为(440,39),则440K时反应的平衡常数Kp= (以分压表示,分压=总压×物质的量分数) D、实际反应往往伴随副反应,生成C3H6等。一定温度和压强条件下,使用合适催化剂可提高乙烯的选择性[ ×100%]9. 臭氧分解 的反应历程包括以下反应:
A、m<0 B、500K下反应达到平衡时,若增大压强(减小容器容积),则n(C2H4)增大 C、X点坐标为(440,39),则440K时反应的平衡常数Kp= (以分压表示,分压=总压×物质的量分数) D、实际反应往往伴随副反应,生成C3H6等。一定温度和压强条件下,使用合适催化剂可提高乙烯的选择性[ ×100%]9. 臭氧分解 的反应历程包括以下反应:反应①: (快)
反应②: (慢)
大气中的氯氟烃光解产生的氯自由基 能够催化 分解,加速臭氧层的破坏。下列说法正确的是( )
A、活化能:反应①<反应② B、 只参与反应①,改变 分解的反应历程 C、 分解为 的速率主要由反应①决定 D、 参与反应提高了 分解为 的平衡转化率10. 实验探究是化学学科的魅力所在。下列有关实验操作、现象和结论均正确的是( )选项
实验操作
实验现象
结论
A
向平衡体系2NO2 N2O4中加压
红棕色变浅
平衡正向移动
B
向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热
溶液中未观察到砖红色沉淀产生
淀粉没有水解
C
将大小相同的Al和Mg分别投入到相同浓度的NaOH溶液中
Al溶解有气泡产生,Mg无现象
Al的金属性强于Mg
D
向海带灰的浸取液中滴加适量氯水,再加入CCl4萃取
分层,下层出现紫红色
海带中含有碘元素
A、A B、B C、C D、D11. 110℃时,将某X固体置于真空恒温恒容容器中,存在平衡: ,反应达平衡时体系的总压为50kPa。下列说法正确的是( )A、加入X固体的量不影响平衡 B、若先通入Y(g)使初始压强为120kPa,再加入足量X(s),平衡时Z(g)的分压为5kPa C、若原容器中残留有空气,平衡时体系的总压仍为50kPa D、增大X(s)的表面积,正反应速率增大,平衡向正反应方向移动12. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。下列有关氨催化氧化反应的说法正确的是( )A、反应过程中分离出H2O(g),正反应速率增大 B、反应达到平衡时,相同时间内消耗NH3和NO的物质的量相等 C、平衡时向容器中继续通入O2 , 平衡正向移动,平衡常数增大 D、其他条件不变,起始时投入2molNH3、2.5molO2 , 平衡时NH3的转化率小于60%13. 利用CO2和CH4反应制备合成气(CO、H2)的原理是CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH>0。温度为T℃时,该反应的平衡常数为K。下列说法正确的是( )A、K越大,说明反应速率、CO2的平衡转化率越大 B、增大压强,平衡向逆反应方向移动,K减小 C、升高温度,反应速率和平衡常数K都增大 D、加入催化剂,能提高合成气的平衡产率14. T1℃时,向1L密闭容器中充入10molH2和3molSO2发生反应:3H2(g)+SO2(g)H2S(g)+2H2O(g) △H<0。部分物质的物质的量n(X)随时间t变化如图中实线所示。下列说法正确的是( ) A、实线a代表n(H2O)随时间变化的曲线 B、t1min时,v正(SO2)<v逆(H2S) C、该反应的平衡常数K=L•mol-1 D、若该反应在T2℃(T2<T1)时进行,则虚线b可表示n(SO2)的变化15. 下列说法错误的是( )A、趁热过滤时应快速将混合液倒入预热后的漏斗中,漏斗颈下端不能紧贴烧杯内壁 B、溶液蒸发或冷却速率越快,得到的晶体颗粒就越细小 C、实验室电器设备着火,可用二氧化碳灭火器灭火 D、向蓝色CoCl2溶液中逐滴加入浓盐酸并振荡,溶液的颜色会从蓝色逐渐变成粉红色16. 下列事实或数据不能用平衡移动原理解释的是( )
A、实线a代表n(H2O)随时间变化的曲线 B、t1min时,v正(SO2)<v逆(H2S) C、该反应的平衡常数K=L•mol-1 D、若该反应在T2℃(T2<T1)时进行,则虚线b可表示n(SO2)的变化15. 下列说法错误的是( )A、趁热过滤时应快速将混合液倒入预热后的漏斗中,漏斗颈下端不能紧贴烧杯内壁 B、溶液蒸发或冷却速率越快,得到的晶体颗粒就越细小 C、实验室电器设备着火,可用二氧化碳灭火器灭火 D、向蓝色CoCl2溶液中逐滴加入浓盐酸并振荡,溶液的颜色会从蓝色逐渐变成粉红色16. 下列事实或数据不能用平衡移动原理解释的是( )A
B
C
D
密闭容器中,氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
向新制氯水中滴加溶液,溶液由浅黄绿色变为无色

c(氨水)mol/L
0.1
0.01
pH
11.1
10.6
A、A B、B C、C D、D17. 已知反-2-丁烯转化为顺-2-丁烯反应如下, , 和随温度变化的曲线如图。下列有关该反应的说法正确的是( )
 A、反-2-丁烯与顺-2-丁烯互为位置异构体 B、温度变化对的影响程度小于对的影响程度 C、正反应的活化能大于逆反应的活化能 D、顺-2-丁烯比反-2-丁烯稳定18. 在一定温度下,将1molCO2和3molH2充入体积为1L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )A、平衡混合气体中C原子的物质的量是1mol B、该反应的反应物的总能量高于生成物的总能量 C、该反应的化学平衡常数K= D、其他条件相同时,若起始充入2molCO2和6molH2 , 达到平衡时CH3OH的物质的量分数大于25%19. 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: , 相关数据见下表。
A、反-2-丁烯与顺-2-丁烯互为位置异构体 B、温度变化对的影响程度小于对的影响程度 C、正反应的活化能大于逆反应的活化能 D、顺-2-丁烯比反-2-丁烯稳定18. 在一定温度下,将1molCO2和3molH2充入体积为1L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )A、平衡混合气体中C原子的物质的量是1mol B、该反应的反应物的总能量高于生成物的总能量 C、该反应的化学平衡常数K= D、其他条件相同时,若起始充入2molCO2和6molH2 , 达到平衡时CH3OH的物质的量分数大于25%19. 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: , 相关数据见下表。容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
Ⅰ
0.2
0.2
0.1
Ⅱ
0.2
0.2
0.12
下列说法不正确的是( )
A、 B、Ⅰ中反应达到平衡时,CO的转化率为50% C、达到平衡所需要的时间:Ⅱ>Ⅰ D、对于Ⅰ,平衡后向容器中再充入0.2mol CO和0.2mol , 平衡正向移动二、多选题
-
20. 在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) (正反应放热)。下列说法正确的是( )
容器编号
容器类型
初始体积
起始物质的量/mol
平衡时SO3物质的量/mol
SO2
O2
SO3
I
恒温恒容
1.0 L
2
1
0
1.6
II
绝热恒容
1.0 L
2
1
0
a
III
恒温恒压
0.5 L
0
0
1
b
A、a>1.6 B、b<0.8 C、平衡时v正(SO2):v(I)<v(II) D、若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0molSO3(g),则反应将向正反应方向进行21. 向容积为1.00L的密闭容器中通入一定量的N2O4和NO2的混合气体,发生反应:N2O4(g) 2NO2(g)ΔH>0,体系中各物质浓度随时间变化如图所示。下列有关说法正确的是( )
已知:NO2为红棕色气体,N2O4为无色气体
A、64s时,反应达到化学平衡状态 B、到达化学平衡前,混合气体的颜色逐渐变深 C、若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高 D、前100s内,用NO2浓度的变化表示的化学反应速率是0.008mol·L-1·s-122. 单质碘在水中的溶解度较小,且溶解较慢。实验室配制碘水时,往往将碘单质加入稀KI溶液中。该溶液中存在平衡: 。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是( ) A、向上述体系中加入CCl4 , 平衡不移动 B、25 ℃时,向上述体系中加入少量I2 , 平衡向右移动,平衡常数大于680 C、该反应的平衡常数表达式为 D、该反应的正反应为放热反应
A、向上述体系中加入CCl4 , 平衡不移动 B、25 ℃时,向上述体系中加入少量I2 , 平衡向右移动,平衡常数大于680 C、该反应的平衡常数表达式为 D、该反应的正反应为放热反应三、非选择题
-
23. 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:(1)、在一定温度下,向体积固定的密闭容器中加入足量的 和 ,起始压强为 时,发生下列反应生成水煤气:
Ⅰ.
Ⅱ.
①下列说法正确的是;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为 , 的物质的量为 。此时,整个体系(填“吸收”或“放出”)热量 ,反应Ⅰ的平衡常数 (以分压表示,分压=总压×物质的量分数)。
(2)、一种脱除和利用水煤气中 方法的示意图如下:
①某温度下,吸收塔中 溶液吸收一定量的 后, ,则该溶液的 (该温度下 的 );
②再生塔中产生 的离子方程式为;
③利用电化学原理,将 电催化还原为 ,阴极反应式为。
24. 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:(1)、在C和O2的反应体系中:反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
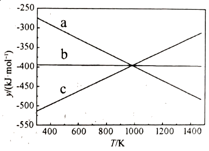
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
(2)、水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是。(3)、一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
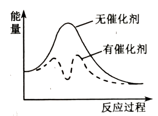
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。
25. 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:Ⅰ.主反应:
 (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g) ∆H1<0
(g) ∆H1<0Ⅱ.副反应:
 (g) ⇌
(g) ⇌  (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)、已知:Ⅲ.Ⅳ.2
 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4Ⅴ.
 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5则 (用 、 和 表示)。
(2)、有利于提高平衡体系中环己烷体积分数的措施有_______。A、适当升温 B、适当降温 C、适当加压 D、适当减压(3)、反应Ⅰ在管式反应器中进行,实际投料往往在 的基础上适当增大 用量,其目的是。(4)、氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当 中混有微量 或 等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为。 (5)、催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。
(5)、催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。 (6)、恒压反应器中,按照 投料,发生Ⅰ、Ⅱ反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。26. 3D打印对钛粉末的要求很高。熔盐电解精炼是制取钛粉的有效途径。精炼时一般采用等摩尔比的KCl-NaCl熔盐,其中含有一定浓度的低价氯化钛(TiClx , x=2、3)。(已知:①熔盐中Ti3+少,Ti2+多熔盐电解精炼制得的钛粉颗粒相对粗大;②钛的熔点为1668℃,TiCl4熔点-24. 1℃、沸点136. 4℃)。(1)、精炼时,粗品质的海绵钛、废钛材等做电解池的极。(2)、采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:
(6)、恒压反应器中,按照 投料,发生Ⅰ、Ⅱ反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。26. 3D打印对钛粉末的要求很高。熔盐电解精炼是制取钛粉的有效途径。精炼时一般采用等摩尔比的KCl-NaCl熔盐,其中含有一定浓度的低价氯化钛(TiClx , x=2、3)。(已知:①熔盐中Ti3+少,Ti2+多熔盐电解精炼制得的钛粉颗粒相对粗大;②钛的熔点为1668℃,TiCl4熔点-24. 1℃、沸点136. 4℃)。(1)、精炼时,粗品质的海绵钛、废钛材等做电解池的极。(2)、采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ.……… △H4
①反应ⅳ的化学方程式为。
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H13△H2(填“>”、“<”或“=”)。

③有助于制取低价钛离子的电解质熔盐的措施为。
(3)、向下图装置中加入海绵钛,从石英管中缓慢加入a mol TiCl4 , 恒温条件下进行反应。
①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为。
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=。
③若向此平衡体系中继续注入TiCl4 , 则再次平衡后 (填“增大”、“减小”或“不变”)
(4)、电解精炼制钛粉,偶尔会得到一些相对粗大的钛粉颗粒而影响产品质量,请分析产生的原因(写出1条原因,合理即可。)27. 三氧化二镍(Ni2O3)经常用于制造镍氢电池,也可用于镍粉的制造,工业上利用含镍废料(主要成分为镍、铝、铁及其氧化物、碳等)回收其中的镍并制备Ni2O3的工艺流程如下所示:
已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时(c=0.010mol/L)的pH
7.2
3.7
2.2
7.5
完全沉淀时(c=1.0×10-5mol/L)的pH
8.7
4.7
3.2
9.0
③反萃取的反应原理为NiR2+2H+ Ni2++2HR
(1)、“预处理”操作目的是除去镍废料表面的矿物油污,可选用试剂为___________(填标号)。A、酒精 B、纯碱溶液 C、NaOH溶液(2)、酸浸时镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是(从两个角度分析)。 (3)、“氧化”时主要反应的离子方程式是。(4)、利用上述表格数据,可计算出Fe(OH)3的Ksp=(用科学记数法表示,已知lg2=0.3),若“氧化”后的溶液中Ni2+浓度为0.1 mol/L,则“调pH”应控制的pH范围是。(5)、向有机相中加入 溶液能进行反萃取的原因为(用化学平衡移动原理解释)。(6)、资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
(3)、“氧化”时主要反应的离子方程式是。(4)、利用上述表格数据,可计算出Fe(OH)3的Ksp=(用科学记数法表示,已知lg2=0.3),若“氧化”后的溶液中Ni2+浓度为0.1 mol/L,则“调pH”应控制的pH范围是。(5)、向有机相中加入 溶液能进行反萃取的原因为(用化学平衡移动原理解释)。(6)、资料显示,硫酸镍结晶水合物的形态与温度有如下关系:温度
低于30.8℃
30.8℃-53.8℃
53.8℃-280℃
高于280℃
晶体形态
NiSO4·7H2O
NiSO4·6H2O
多种结晶水合物
NiSO4
从NiSO4溶液获得稳定的NiSO4·6H2O晶体的操作依次是。
(7)、有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为。28. 某学习小组为了探究 的还原性,按图示设计并进行实验(部分装置省略)。回答下列问题: (1)、仪器a的名称为 , 装置B的作用是。(2)、预测 与 溶液发生氧化还原反应的离子方程式为。(3)、往C中持续通入SO2至饱和,观察到溶液先变红色,5分钟后变黄,约9小时后变为浅绿色。
(1)、仪器a的名称为 , 装置B的作用是。(2)、预测 与 溶液发生氧化还原反应的离子方程式为。(3)、往C中持续通入SO2至饱和,观察到溶液先变红色,5分钟后变黄,约9小时后变为浅绿色。经查资料:红色物质可能是 与 、 形成的配合物,配合物可表示为: (A为 或 ,x为1或2,n+m=6,n越大配合物越稳定,溶液颜色越深)。室温下进行以下实验。
序号
操作
现象
实验1
向1mL 溶液中滴加3mL 溶液
溶液先变红,随后产生沉淀和刺激性气味气体。抽滤得到橙黄色沉淀。
实验2
向1mL 溶液中滴加3mL 溶液
溶液中滴溶液先变红,析出少量沉淀,加至2mL析出大量沉淀,加至3mL沉淀溶解,溶液颜色加深。
实验3[略,判断实验1抽滤得到的沉淀不是 ]
①通过计算说明实验1得到的沉淀为 ,而非 。
已知:[ 、 、 ]
②实验1生成沉淀和气体的离子方程式为。
实验4:为了进一步确定红色物质,利用分光光度仪(吸光度越大,溶液颜色越深)进行检测。将浓度均为 的 、 、 溶液按一定体积比配制,实验数据如表。
试验编号
V/mL
吸光度
1
0.5
4.0
0.0
0.412
2
0.5
3.2
a
0.331
3
0.5
1.6
2.4
0.118
4
0.5
0.0
4.0
0.018
③表中a为 , 红色物质可表示为。
④装置C中的溶液5分钟后变黄,约9小时后变为浅绿色,相关解释为。
29. 实验小组同学为探究Fe2+的性质,进行如下实验。【实验I】向2 mL0.1 mol·L-1FeSO4溶液中滴加几滴0.1 mol·L-1KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。
(1)、甲同学通过上述实验分析Fe2+具有(填“氧化”或“还原”)性。乙同学查阅资料发现Fe2+与SCN-也可发生反应,生成无色的配合物。为证实该性质,利用FeCO3进行如下实验。
(2)、FeCO3的制备:用过量NH4HCO3溶液与FeSO4溶液反应得到FeCO3 , 离子方程式为。(3)、【实验II】验证Fe2+与SCN-发生反应
通过实验b排除了的干扰。
(4)、从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是。丙同学设计实验进一步证明Fe2+可与SCN-反应。
(5)、[实验III]
上述实验中,d为c的对照实验。
①X为。
②实验能够证实Fe2+可与SCN-反应,则应观察到的现象是。
(6)、实验II中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低c(Fe3+)。30. 研究 等大气污染气体的处理方法具有重要意义。(1)、 是汽车尾气中的主要污染物之一、 能形成酸雨, 写出 转化为 的化学方程式:。(2)、氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:。标准状况下,3.36LCO还原至的整个过程中转移电子的数目为 , 放出的热量为(用含有a的代数式表示)。(3)、现将一定量 气体充入恒容密闭容器中, 控制反应温度为 , 下列可以作为反应达到平衡的判断依据是。D. 容器内气体的密度不变 E. 容器内颜色不变
(4)、反应温度 时, 随 (时间) 变化曲线如图, 画出 时段, 随 变化曲线。保持其它条件不变, 改变反应温度为 , 再次画出 时段, 随 变化趋势的曲线。 (5)、NO氧化反应:分两步进行:
(5)、NO氧化反应:分两步进行:I.
II. (Q1、Q2都大于0)
在恒容的密闭容器中充入一定量的 和 气体,保持其它条件不变, 控制反应温度分别为 和 , 测得(NO)随(时间)的变化曲线如图,转化相同量的NO,在温度(填 “ ” 或 “ ”)下消耗的时间较长,试结合反应过程能量图分析其原因。
 31. 汽车尾气中含有氮氧化合物和CO,减少它们在大气中的排放是环境保护的重要内容之一、(1)、已知:i.N2(g)+O2(g)=2NO(g) ΔH1=+180kJ·mol-1
31. 汽车尾气中含有氮氧化合物和CO,减少它们在大气中的排放是环境保护的重要内容之一、(1)、已知:i.N2(g)+O2(g)=2NO(g) ΔH1=+180kJ·mol-1ii.C(s)+O2(g)=CO2(g) ΔH2=-393kJ·mol-1
iii.2C(s)+O2(g)=2CO(g) ΔH3=-221kJ·mol-1
则NO与CO反应iv的热化学方程式:。
(2)、某研究小组在三个容积为2L的恒容密闭容器中,在三种不同实验条件分别充入4molNO和4molCO发生上述反应iv。反应体系保持各自温度不变,体系总压强随时间的变化如图1所示:
①温度:T1T2(①②③问均选(填“<”“=”或“>”)。
②CO的平衡转化率:IIIIII。
③反应速率:a点的v逆b点的v正。
④若该反应的速率v正=k正·p2(CO)·p2(NO)(kPa·min-1),v逆=k逆·p(N2)·p2(CO2)(kPa·min-1),k正与k逆仅与温度有关,p(M)表示M的分压,分压=总压×物质的量分数。
i.T1K下,NO的平衡转化率为 , 反应的平衡常数Kp=(kPa)-1(以分压表示)。已知T1K时k正=60(kPa)-3·min-1 , 则平衡时v逆=kPa·min-1。
ii.升高温度时,的比值。(选填“增大”“不变”或“减小”)。
(3)、反应iv在不同催化剂甲、乙条件下,NO的脱氮率在相同时间内随温度的变化如图2所示。在工业生产中应选用催化剂(填“甲”或“乙”),理由是。 32. 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟氧化结合溶液吸收法同时脱除和NO的过程示意图如下。
32. 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟氧化结合溶液吸收法同时脱除和NO的过程示意图如下。 (1)、气体反应器中的主要反应原理及相关数据如下表。
(1)、气体反应器中的主要反应原理及相关数据如下表。反应
平衡常数(25℃)
活化能/(kJ/mol)
反应a:
24.6
反应b:
3.17
反应c:
58.17
①已知: , 则。
②其他条件不变时,高于150℃,在相同时间内和NO的转化率均随温度升高而降低,原因是。
③其他条件不变,和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,和NO的转化率随的浓度的变化如图。结合数据分析NO的转化率高于的原因。
 (2)、其他条件不变,和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,与NO的物质的量之比对和NO脱除率的影响如图。
(2)、其他条件不变,和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,与NO的物质的量之比对和NO脱除率的影响如图。
①溶液显碱性,用化学平衡原理解释:。
②的浓度很低时,的脱除率超过97%,原因是。
③在吸收器中,与反应生成和的离子方程式是。
④在吸收器中,随着吸收过程的进行,部分被转化为 , 反应中和的物质的量之比为1:1,该反应的离子方程式是。
33. 我国提出争取在2030年前实现碳峰值、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。将CO2 转化为清洁能源是促进碳中和最直接有效的方法。(1)、H2 还原CO2 制取CH4的部分反应如下:①
②
③
反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=kJ/mol。
(2)、恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2 , 只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是____ (填字母。)A、利用合适的催化剂可增大该反应的平衡常数 B、容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态 C、用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1 D、其它条件不变,升高温度,CO的平衡转化率降低(3)、在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2 和ymolH2 , 发生反应:
①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线 (填“m” 或“n”),判断依据是。
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆 v(c) 逆(填“>”、<”或“=”);T2时,起始压强为2.5MPa,则Kp=MPa-2(保留二位小数;K p 为以分压表示的平衡常数,分压=总压×物质的量分数)。
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是(填“A”、“B”、“D”或“E”)。
34. 综合利用CO2对完成“碳中和”的目标有重要意义。(1)、合成乙醇:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) △H=akJ·mol-1.一定温度下,向容积均为2L的恒容密闭容器中分别通入1.0molCO2(g)和3.0molH2(g),在催化剂X、Y的催化下发生反应。测得5min时,CO2转化率与温度的变化关系如图甲所示。
①T1K时,点对应穼器在0~5min内的平均反应速率v(H2)=;b、c点对应状态下反应物的有效碰撞几率bc(填“>”“<”或“=”),原因为。
②T2K时,保持温度不变向容器中再充入0.2molCO2 , 0.6molC2H5OH(g),平衡将移动(填“向正反应方向”、“向逆反应方向”或“不”)。
③该反应适宜选用的催化剂为(填“X”或“Y”),高于T3K时,d点以后两条线重合的原因是。
(2)、合成二甲醚:反应Ⅰ:CO2(g)+H2(g)CO(g)+H2O(g) △H=+41.2kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H=-122.5kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图乙所示。其中:CH3OCH3的选择性=×100%

①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是。
②220℃时,起始投入3molCO2 , 6molH2 , 在催化剂作用下CO2与H2反应一段时间后,测得CO2平衡转化率为40%,CH3OCH3的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗H2的物质的量为mol。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有。
③合成二甲醚时较适宜的温度为260℃,其原因是。
35. 丙烯腈( )是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以3—羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以3—羟基丙酸乙酯( )为原料合成丙烯腈的主要反应如下:
)为原料合成丙烯腈的主要反应如下:I.
 (g)
(g)  (g) +H2O(g) ΔH1>0
(g) +H2O(g) ΔH1>0II.
 (g) +NH3(g)
(g) +NH3(g)  +H2O(g)+
+H2O(g)+  (g) ΔH2>0(1)、已知部分化学键键能如下表所示:
(g) ΔH2>0(1)、已知部分化学键键能如下表所示:化学键
C-O
C-C
C=C
C-H
O-H
C=O
键能(kJ·mol -1)
351
348
615
413
463
745
据此计算ΔH1 =。
(2)、在盛有催化剂TiO2、压强为100kPa的恒压密闭容器中按体积比2:15充入 (g)和NH3(g)发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如
(g)和NH3(g)发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如 的物质的量分数w%=
的物质的量分数w%= ×100%)。
×100%)。 
①随着温度的升高,
 (g)的平衡体积分数先增大后减小的原因为。
(g)的平衡体积分数先增大后减小的原因为。②科学家通过DFT计算得出反应II的机理如图2所示,其中第二步反应为
 (g)
(g)  (g)+H2O(g), 则第一步反应的化学方程式为 ;实验过程中未检测到
(g)+H2O(g), 则第一步反应的化学方程式为 ;实验过程中未检测到 (g)的原因可能为。
(g)的原因可能为。
③A点对应反应II的标准平衡常数= ( 保留两位有效数字)。[其表达式为用相对分压代替浓度平衡常数表达式中的浓度,气体的相对分压等于其分压(单位为kPa)除以p0(p0=100 kPa)]
④实际生产中若充入一定量N2 (不参与反应),可提高丙烯腈的平衡产率,原因为。
(3)、利用电解法由丙烯腈制备己二睛[NC(CH2)4CN]的装置如图3所示。
通电过程中,石墨电极2上的电极反应式为。