高考二轮复习知识点:化学平衡的调控
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 同位素示踪是研究反应机理的重要手段之一、已知醛与在酸催化下存在如下平衡:。据此推测,对羟基苯甲醛与10倍量的在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )A、
 B、
B、 C、
C、 D、
D、 2. NO2和N2O4存在平衡:2NO2(g)⇌N2O4(g) △H<0。下列分析正确的是( )A、1 mol平衡混合气体中含1 mol N原子 B、断裂2 mol NO2分子中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量 C、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 D、恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅3. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )
2. NO2和N2O4存在平衡:2NO2(g)⇌N2O4(g) △H<0。下列分析正确的是( )A、1 mol平衡混合气体中含1 mol N原子 B、断裂2 mol NO2分子中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量 C、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 D、恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅3. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )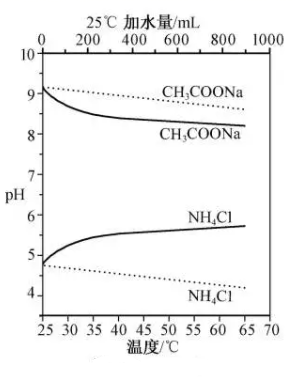 A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )4. 在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1 , N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是( )A、
A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )4. 在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1 , N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是( )A、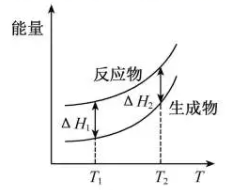 B、
B、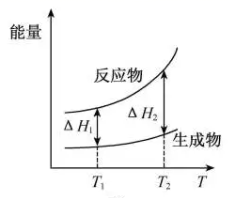 C、
C、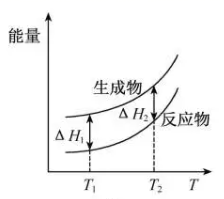 D、
D、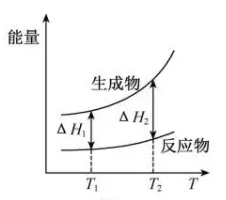 5. 接触法生产H2SO4中,将吸收塔上部导出的气体再次通入接触室,目的是( )A、提高SO2利用率 B、充分利用反应热 C、加快化学反应速率 D、防止催化剂中毒6. 异丁醇催化脱水制备异丁烯主要涉及以下2个反应。研究一定压强下不同含水量的异丁醇在恒压反应器中的脱水反应,得到了异丁烯的平衡产率随温度的变化结果如图。
5. 接触法生产H2SO4中,将吸收塔上部导出的气体再次通入接触室,目的是( )A、提高SO2利用率 B、充分利用反应热 C、加快化学反应速率 D、防止催化剂中毒6. 异丁醇催化脱水制备异丁烯主要涉及以下2个反应。研究一定压强下不同含水量的异丁醇在恒压反应器中的脱水反应,得到了异丁烯的平衡产率随温度的变化结果如图。
①
 (g)
(g)  (g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
(g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104②2
 (g)
(g)  (g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
(g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1下列说法错误的是( )
A、其他条件不变时,在催化剂的活性温度内,升高温度有利于异丁烯的制备 B、高于190℃时,温度对异丁烯的平衡产率影响不大的原因是K1>104、K2<0.1 C、190℃时,增大n(H2O):n(异丁醇),不利于反应②的进行 D、若只有异丁烯、水和二聚异丁烯生成,则初始物质浓度c0与流出物质浓度c之间存在:c0(异丁醇)=c(异丁烯)+2c(二聚异丁烯)7. 在体积均为的甲、乙两恒容密闭容器中加入足量相同的碳粉,再分别加入和 , 发生反应达到平衡。的平衡转化率随温度的变化如图所示。下列说法正确的是 ( ) A、反应的 B、曲线II表示容器甲中的平衡转化率 C、达平衡后,两容器中c(CO): D、其他条件不变时,在曲线I对应容器中加入合适的催化剂,可使的平衡转化率由P点达到S点I8. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如下;下列说法中不正确的是( )
A、反应的 B、曲线II表示容器甲中的平衡转化率 C、达平衡后,两容器中c(CO): D、其他条件不变时,在曲线I对应容器中加入合适的催化剂,可使的平衡转化率由P点达到S点I8. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如下;下列说法中不正确的是( ) A、上述过程的总反应是取代反应 B、反应前后碳原子的成键数目没有发生变化 C、若和参与,则可能生成和 D、控制甲醇浓度不变,提高硫化氢的用量,乙醇的转化率持续增大9. 烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g) NO(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3 , 测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
A、上述过程的总反应是取代反应 B、反应前后碳原子的成键数目没有发生变化 C、若和参与,则可能生成和 D、控制甲醇浓度不变,提高硫化氢的用量,乙醇的转化率持续增大9. 烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g) NO(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3 , 测得NO的体积分数随时间的变化如图所示。下列说法正确的是( ) A、高温有利于提高容器中NO的平衡转化率 B、T1时,反应在t min内的平均速率v(O2)= mol·L-1·min-1 C、T1时,NO(g)+O3(g) NO2(g)+O2(g)的k正<3k逆 D、T2时,向2 L密闭容器中充入0.6 mol NO、0.4 mol O3 , 到达平衡时c(NO2)小于乙容器中平衡时c(NO2)10. 根据下列实验操作和现象所得到的结论正确的是( )
A、高温有利于提高容器中NO的平衡转化率 B、T1时,反应在t min内的平均速率v(O2)= mol·L-1·min-1 C、T1时,NO(g)+O3(g) NO2(g)+O2(g)的k正<3k逆 D、T2时,向2 L密闭容器中充入0.6 mol NO、0.4 mol O3 , 到达平衡时c(NO2)小于乙容器中平衡时c(NO2)10. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作
现象
结论
A
蘸有浓氨水的玻璃棒靠近X
产生白烟
X一定是浓盐酸
B
向 溶液中滴入 溶液5~6滴,加 振荡,静置后取上层清液滴加KSCN溶液
溶液变红
与I-的反应有一定限度
C
将浓硫酸加入蔗糖中,产生的气体通入品红溶液
品红溶液褪色
浓硫酸具有强氧化性
D
将石蜡油蒸气通过炽热的碎瓷片分解,得到的气体通入溴的四氯化碳溶液
溴的四氯化碳溶液褪色
分解产物中一定含有乙烯
A、A B、B C、C D、D11. 可逆反应xH2S(g) xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )A、若恒容充入H2 , 则新平衡后H2S分解率下降 B、若增大压强,气体颜色变深,则Sx为有色气体 C、若恒容升温后,气体密度不变,说明达到了新平衡 D、若改变某一条件后,压强不能作为判断新平衡的标志,则Sx状态发生改变12. 电化学在化学实验、工业生产和生活中都有重要应用.下列说法正确的是( )A、实验室利用锌片和稀硫酸制H2时,在稀硫酸中滴加MgSO4溶液可以加快反应速率 B、将反应2FeCl3+Cu═2FeCl2+CuCl2设计为原电池,正极反应为Cu﹣2e﹣═Cu2+ C、利用电解法除去酸性废水中的CN﹣离子,CN﹣在阳极被还原为N2和CO2 D、利用电解法精炼铜,原粗铜中的杂质有以离子形式被除去,也有以单质形式被除去13. 在某温度下,将H2和I2各1mol的气态混合物充入1L的密闭容器中,发生反应:H2(g)+I2(g)⇌2HI(g)△H<0;5min后达到平衡状态,测得c(H2)=0.9mol•L﹣1 , 则下列结论中,不能成立的是( )A、平衡时H2、I2的转化率相等 B、从反应开始至平衡的过程中,v(HI)=0.04mol•L﹣1•min﹣1 C、其他条件不变再向容器中充入少量H2 , I2的转化率提高 D、若将容器温度提高,其平衡常数K一定增大二、多选题
-
14. 金属M的盐 ,溶液中存在平衡: 。分别在 恒温条件下,向 的 ,溶液中加入等量 固体,持续搅拌下用 传感器连续测量溶液的 ,得到实验图像,下列说法错误的是( )
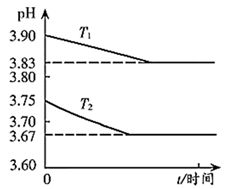 A、 B、 时平衡常数的数量级是 C、溶液中存在 D、 温度下,加入 ,固体再次达到平衡后, 减小15. 2019年9月,我国科研人员研制出双温区催化剂,其中区域和区域的温度差可超过100℃。双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是( )
A、 B、 时平衡常数的数量级是 C、溶液中存在 D、 温度下,加入 ,固体再次达到平衡后, 减小15. 2019年9月,我国科研人员研制出双温区催化剂,其中区域和区域的温度差可超过100℃。双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是( ) A、①②③在高温区发生,④⑤在低温区发生 B、该历程中能量变化最大的是 , 是氮分子中氮氮三键的断裂过程 C、在高温区加快了反应速率,低温区提高了氨的产率 D、使用双温区催化合成氨,会改变合成氨反应的反应热16. CH4与CO2重整生成H2和CO的过程中主要发生下列反应
A、①②③在高温区发生,④⑤在低温区发生 B、该历程中能量变化最大的是 , 是氮分子中氮氮三键的断裂过程 C、在高温区加快了反应速率,低温区提高了氨的产率 D、使用双温区催化合成氨,会改变合成氨反应的反应热16. CH4与CO2重整生成H2和CO的过程中主要发生下列反应CH4(g)+CO2(g) 2H2(g)+2CO(g) ∆H=+247.1 kJ·mol-1
H2(g)+CO2(g) H2O(g)+CO(g) ∆H=+41.2kJ·mol-1
恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
 A、曲线A表示CO2的平衡转化率随温度的变化 B、升高温度、增大压强均有利于提高CH4的平衡转化率 C、相同条件下,改用高效催化剂能使曲线A和曲线B相重叠 D、恒压、800K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值17. 下列叙述正确的是( )A、合成氨反应放热,采用低温可以提高氨的生成速率 B、常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低 C、反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0 D、在一容积可变的密闭容器中反应2SO2(g)+O2(g) 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动, 的值不变
A、曲线A表示CO2的平衡转化率随温度的变化 B、升高温度、增大压强均有利于提高CH4的平衡转化率 C、相同条件下,改用高效催化剂能使曲线A和曲线B相重叠 D、恒压、800K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值17. 下列叙述正确的是( )A、合成氨反应放热,采用低温可以提高氨的生成速率 B、常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低 C、反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0 D、在一容积可变的密闭容器中反应2SO2(g)+O2(g) 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动, 的值不变三、非选择题
-
18. 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)、 。(2)、一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为。(3)、不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为;图乙中T1温度时,三条曲线几乎交于一点的原因是。
(4)、为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。A、低温、高压 B、高温、低压 C、低温、低压 D、高温、高压19. 某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入香菇样品和水;锥形瓶中加入水、淀粉溶液,并预加的碘标准溶液,搅拌。
②以流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了碘标准溶液。
③做空白实验,消耗了碘标准溶液。
④用适量替代香菇样品,重复上述步骤,测得的平均回收率为95%。
已知: ,
回答下列问题:
(1)、装置图中仪器a、b的名称分别为、。(2)、三颈烧瓶适宜的规格为____(填标号)。A、 B、 C、(3)、解释加入 , 能够生成的原因:。(4)、滴定管在使用前需要、洗涤、润洗;滴定终点时溶液的颜色为;滴定反应的离子方程式为。(5)、若先加磷酸再通氮气,会使测定结果(填“偏高”“偏低”或“无影响”)。(6)、该样品中亚硫酸盐含量为(以计,结果保留三位有效数字)。20. 新能源氢气汽车,燃料中CO体积分数必须低于10 ×10-4%,否则会造成催化剂中毒。CO深度去除一般采用“CO优先氧化”或“CO选择性甲烷化”的方法。回答下列问题:
(1)、“CO优先氧化”是向氢气燃料中通入空气,CO优先于H2发生反应。该方法的缺点是降低了燃料的热值、(只答一条即可)。(2)、“CO选择性甲烷化”是通过CO加氢生成甲烷而实现CO的深度去除。反应过程:i.CO (g) +3H2(g) CH4(g)+H2O(g) △H1= - 206 kJ·mol-1
ii.CO2(g) + 4H2(g) CH4(g) + 2H2O(g) △H2
iii.CO2(g) +H2(g) CO(g) + H2O(g) △H3= + 41 kJ ·mol-1
①△H2 =kJ·mol-1;
②采用“CO选择性甲烷化”的方法消除CO,该方法最明显的缺点是。
③欲使CO体积分数必须低于10 ×10-4% ,应采取的措施是(填标号)。
A.升高温度 B.降低压强 C.使用CO加氢催化剂 D.使用CO2加氢抑制剂
(3)、有研究认为CO加氢甲烷化存在下列过程(如图所示),限速步骤是(填标号),从结构上给予解释:。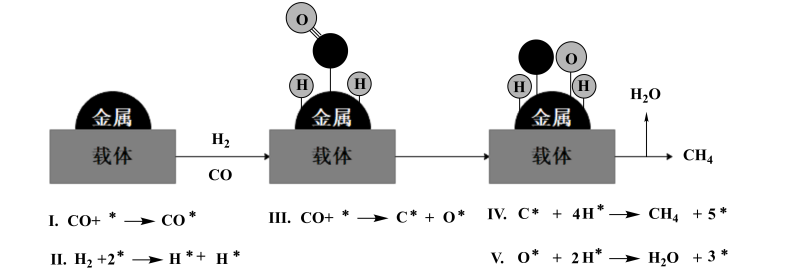
在某一条件下进行CO加氢甲烷化,发生i、ii和iii反应,相关数据如下:
体积/L
CO
CO2
H2
H2O
CH4
反应前
10
10
80
1.0 ×10-7
1.0 ×10-7
反应后
1.0 ×10-6
10
x
10
10
①x=(保留2位有效数字);
②此条件下反应iii的平衡常数K= 100,通过计算判断反应iii是否平衡。
21. 氮的氧化物在生产中具有重要作用。已知:①N2(g)+ 2O2(g2NO2(g) ΔH1= +66.36 kJ·mol-1
②N2(g)+ 2O2 (g) N2O4(g) ΔH2= +9.16 kJ·mol-1
③N2O4(g) 2NO2
请回答:
(1)、反应③是重要的平衡体系。①该反应在 下自发进行(填“高温”、“低温”、“任意温度”)。
②设v(N2O4) = k1c(N2O4), v(NO2) = k2c2(NO2), k1、k2为与温度相关的常数。在295K和315K条件下,v(N2O4)、v(NO2)与t关系如图所示。315K时,代表v(N2O4)的曲线是 (用“a”、 “b”、“c”、“d”表示),可能处于平衡状态的是 (用“A”、 “B”、“C”、“D”表示)

③在295K温度下,将一定量的气体充入一个带活塞的特制容器,通过活塞移动使体系达到平衡时总压恒为0.6 kPa.Kp(295K) =0.100,则该温度下体系达平衡时NO2的分压为
④与体系在恒容条件下温度从295K 升至315K的变化相比,恒压下体系温度升高,下列说法正确的是
A.平衡移动程度更大 B.平衡移动程度更小
C.平衡移动程度不变 D.三者均有可能
(2)、研究发现NO2在形成光化学烟雾的过程中起了关键作用。NO2自催化历程如图所示,写出相关化学方程式。
①NO2NO+ O
②
③
22. 以次氯酸盐为有效成分的消毒剂应用广泛。电解溶液制备溶液的装置示意如下。资料:i.次氯酸钠不稳定:a. b.
ii.将次氯酸盐转化为次氯酸能更好地发挥消毒功能,次氯酸具有更强的氧化性

[制备]
(1)、产生:①生成的反应包括:、、。
②测所得溶液 , 试纸先变蓝()后褪色,说明溶液具有的性质是。
(2)、相同温度下,在不同初始下电解溶液,对浓度的影响如下所示。
推测浓度在为3或13时较小的原因:
Ⅰ.时,阳极有放电
Ⅱ.时,的溶解度减小
Ⅲ.时,浓度增大,促使被氧化
①检验电解产物,推测Ⅰ成立。需要检验的物质是。
②根据化学平衡移动原理,推测Ⅱ合理。依据的化学平衡是。
③经检验,推测Ⅲ合理。用方程式解释:。
根据上述实验,电解法制备溶液,初始不宜过小或过大。
(3)、同样方法电解溶液制备 , 由于生成覆盖在电极表面,电解难以持续。[保存]
低温保存、加入、等物质能增强溶液的稳定性。
[测量]
(4)、取V1mL所得样液,加水稀释。依次加入溶液、稀。析出的用标准溶液滴定至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗溶液V2mL。(已知:),样液中。23. 在电池中有重要应用。以软锰矿(主要成分为)为原料制备粗二氧化锰颗粒的过程如下: (1)、浸出
(1)、浸出①用硫酸和可溶解软锰矿,请补全该反应的离子方程式:
□+□ +□ =□+□□
②浸出时可用代替硫酸和。下列说法正确的是(填序号)。
a.在反应中作氧化剂
b.用浸出可减少酸的使用
c.该法可同时处理烟气中的 , 减少大气污染
(2)、净化、分离①软锰矿浸出液中的、可通过加碱转化为沉淀去除,分离出清液的方法是。
②为减少碱用量,可以通过稀释浸出液除去 , 结合离子方程式解释原理:。
(3)、热解在一定空气流速下,相同时间内热解产物中不同价态的占比随热解温度的变化如图。热解过程中涉及如下化学反应:
i.
ii.
iii.

①为了增大产物中的占比,可以采用的措施是(答出两条)。
②温度升高,产物中的占比降低,可能的原因是。
24. 氮氧化物(NOx)是一类特殊的污染物,它本身会对生态系统和人体健康造成危害,必须进行治理或综合利用。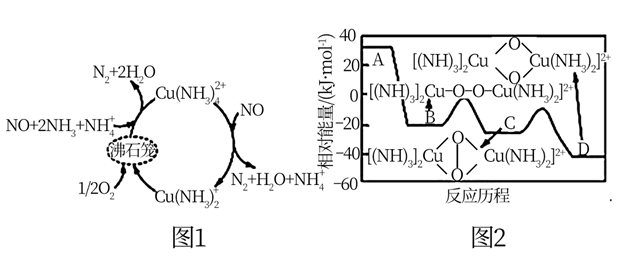 (1)、一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,A在沸石笼内转化为B、C、D等中间体的过程如图2所示。
(1)、一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,A在沸石笼内转化为B、C、D等中间体的过程如图2所示。①由A到B的变化过程可表示为。
②已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H1=-907.28kJ·mol-1
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H2=-1269.02kJ·mol-1
则图1脱除NO的总反应的热化学方程式为。
③关于该催化剂的说法正确的是(填标号)。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(2)、在温度500K时,向盛有食盐的恒容密闭容器中加入NO2、NO和Cl2 , 发生如下两个反应:Ⅰ.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)△H1
Ⅱ.2NO(g)+Cl2(g) 2ClNO(g)△H2
①关于恒温恒容密闭容器中进行的反应Ⅰ和Ⅱ的下列说法中,正确的是(填标号)。
a.△H1和△H2不再变化,说明反应达到平衡状态
b.反应体系中混合气体的颜色保持不变,说明反应Ⅰ达到平衡状态
c.同等条件下,反应Ⅰ的速率远远大于反应Ⅱ,说明反应Ⅰ的活化能小,△H1<△H2
d.达平衡后,向反应体系中再通入一定量ClNO(g),NO2(g)和NO(g)的百分含量均减小
②若向2L恒容密闭容器中加入0.2molNO和0.1molCl2发生反应Ⅱ,起始总压为p。10分钟后达到平衡,用ClNO(g)表示平均反应速率v平(ClNO)=0.008mol·L-1·min-1。则NO的平衡转化率α= , 该反应的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
③假设反应Ⅱ的速率方程为:v=k (1-nαt)式中:k为反应速率常数,随温度t升高而增大;α为NO平衡转化率,α′为某时刻NO转化率,n为常数。在α′=0.8时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线如图所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm , t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。
25. 工业上用合成气(主要成分为CO、H2)制备二甲醚(CH3OCH3),涉及的主要反应如下:Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
(1)、2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)△H3=kJ·mol-1。(2)、若在恒温恒容的密闭容器内只发生反应Ⅱ,可判断该反应已达到平衡状态的是 (填标号)。A、气体的平均摩尔质量保持不变 B、CH3OCH3浓度与H2O浓度相等 C、CH3OCH3的体积分数保持不变 D、2v(CH3OCH3)=v(CH3OH)(3)、T℃时,将2molCO和2molH2充入一恒容密闭容器内发生反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。起始时,容器内压强为2×106Pa,平衡时总压减少了25%,H2的转化率为 , 该反应的平衡常数Kp=Pa-4(保留2位有效数字)。达到平衡后﹐欲增加CO的平衡转化率,可采取的措施有(填标号)。A.再通入一定量的CO B.降低温度
C.及时移走CH3OCH3(g) D.通入氮气
(4)、当压强为p时,在一密闭容器中充入一定量的CO和H2 , 测得不同温度下CO的平衡转化率及催化剂的催化效率如图所示。
达到平衡后,增大压强,反应Ⅰ的平衡(填“向正反应方向”、“向逆反应方向”或“不”,下同)移动,反应Ⅱ的平衡移动,故工业上选择(填“高压”或“低压”)制备二甲醚。工业生产中不选择350℃的原因是。
26. 山西老陈醋是中国四大名醋之首,食醋的主要成分为醋酸。已知:25℃时CH3COOH的电离常数Ka=1.8×10-5。请回答:(1)、25℃时,pH=2的醋酸溶液中,c(H+);将其加水稀释, 的值将(填“增大”“减小”或“无法判断”)。(2)、醋酸钠溶液呈碱性的原因是(用离子方程式表示),溶液中各离子浓度由大到小的顺序为。(3)、已知25℃时,H2S的Ka1=1.3×10-7、Ka2=7.1×10-15、,则25℃时等浓度的CH3COONa、Na2S两种溶液的碱性较强的是。(4)、日常生活中可用醋酸除水垢,但工业锅炉的水垢中常含有硫酸钙,需先用Na2CO3溶液处理,最后再用NH4Cl溶液除去。已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6、,结合化学平衡原理解释加入Na2CO3溶液的原因:(用溶解平衡表达式和必要的文字叙述加以说明)。27. 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:(1)、Ⅰ.氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取氯气。装置中的离子膜为(A.阳离子交换膜 B.阴离子交换膜),b处逸出的气体是(填化学式)。 (2)、次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。(3)、II.CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(2)、次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。(3)、II.CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:CH4-CO2催化重整反应为:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH1= -75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH2= -394 kJ·mol−1
C(s)+ O2(g)=CO(g) ΔH3= -111 kJ·mol−1
该催化重整反应的ΔH= kJ·mol−1。
(4)、有利于提高催化重整反应中CH4平衡转化率的条件是_______。A、高温低压 B、低温高压 C、高温高压 D、低温低压(5)、在恒容绝热密闭容器中进行CH4-CO2催化重整反应,下列表示已达平衡状态的是_____。A、H2的反应速率是CO2反应速率的2倍 B、容器中的温度不再变化 C、容器中气体的密度不再变化 D、容器中的压强不再变化(6)、容器中分别通入1molCH4(g)和1molCO2(g),在等压下(p)发生上述反应,CO2(g)的平衡转化率为α。反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(7)、CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为3∶1,则消耗的CH4和CO2的体积比为。
28. 碳的氧化物的综合利用有着重要的研究意义。(1)、已知:①2H2(g)+O2(g)=2H2O(l) △H1=-571.6 kJ·mol-1②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H2=-1453 kJ·mol-1
则CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H3=。
(2)、一定温度下,在密闭容器中充入2 mol CO2(g)和6 mol H2(g)发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得平衡时CH3OH(g)的体积分数与温度、压强的关系如图1:
①根据图1可判断:p1(填“>”“=”或“<”)p2。
②A点时,用分压表示的平衡常数Kp=(分压=总压×物质的量分数)。
③甲醇燃料电池因具有能量转化率高、电量大的特点而被广泛应用,甲醇KOH碱性燃料电池负极的电极反应式为。
(3)、用CO和H2合成甲烷还伴随多个副反应:主反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H=-206 kJ·mol-1
副反应:①2CO(g) CO2(g)+C(s) △H=-171.7 kJ·mol-1
②CH4(g) C(s)+2H2(g) △H=+73.7 kJ·mol-1

①在合成气甲烷化过程中,经常使用Ni作为甲烷化的催化剂,但Ni基催化剂对硫、砷等很敏感,极少量的硫、砷也可能导致Ni基催化剂发生而失去活性。
②在高温条件下,导致积碳的主要原因是;不同的氢碳比(即H2、CO的物质的量之比)对CO转化率的影响如图2所示。CO的转化率随着氢碳比的变化而变化的原因是。由图2、图3可知,较为适宜的氢碳比为。
29. 水煤气法是工业制备氢气的重要方法之一。反应I:C(s)+H2O(g) CO(g)+H2(g)△H1
反应II:CO(g)+H2O(g) CO2(g)+H2(g)△H2
回答下列问题:
(1)、C(s)+2H2O(g) CO2(g)+2H2(g)∆H(用△H1和△H2表示)。改变条件,提高H2的产率,∆H(填“增大"“减小"或“不变")。(2)、在2L恒容密闭容器中充入足量炭粉和1molH2O(g),在-定温度下发生反应I和反应II,达到平衡时测得c(CO)=0.20mol·L-1 , c(H2)=0.40mol·L-1。①在该条件下,水蒸气的平衡转化率为。
②反应II的平衡常数Kp=。(用平衡体系中各组分的分压计算的平衡常数为Kp , 分压=总压×该组分体积分数)
(3)、在密闭容器中充入一定量的CO和水蒸气,加入适量催化剂,仅发生反应II。测得催化效率和CO转化率与温度关系如图所示。在600℃~750℃范围内影响CO转化率的主要因素是。 (4)、工业上常以水煤气(CO和H2)为原料合成甲醇。在一容积可变的密闭容器中充入1molCO与2molH2 , 在催化剂作用下发生反应CO(g)+2H2(g) CH3OH(g),△H<0,下列叙述不能说明反应已经达到化学平衡状态的是。
(4)、工业上常以水煤气(CO和H2)为原料合成甲醇。在一容积可变的密闭容器中充入1molCO与2molH2 , 在催化剂作用下发生反应CO(g)+2H2(g) CH3OH(g),△H<0,下列叙述不能说明反应已经达到化学平衡状态的是。A.H2的消耗速率是CH3OH生成速率的2倍
B.CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
为了提高H2的转化率,可采取的措施为(填两条即可)。
(5)、以水煤气(CO、H2体积比为1:2)为燃料的碱性(足量KOH为电解质)空气燃料电池,电池工作时CO发生反应的电极反应式为。30. SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。(1)、在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=。
(2)、在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示) ,该过程中部分物质的物质的量浓度随时间的变化关系如图2所示: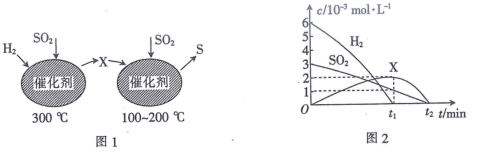
①由分析可知X为 (填化学式)。
②0~t1时间段的温度为。
(3)、燃煤烟气中可通过反应SO2(g)+2CO(g) 2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。①0~5min内,CO的反应速率是;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH(填“>”或“<”)0。
②T℃时,平衡常数Kp=Pa-1。
(4)、单质硫也可以生成多硫化物从而实现能量间的转化。①钠硫电池是一种新型高能电池,总反应为2Na+2S Na2S2 , 该电池工作时正极的电极反应式为;给该电池充电时,钠电极应与外电源的(填“正”或“负”)极相连接。
②在碱性溶液中,S 被BrO 氧化成SO ,BrO 被还原成Br-。该反应的离子方程式是。
31. 2021年4月29日,中国空间站的“天和”核心舱成功发射。通过化学方法,比如把H2O转化为O2、把CO2转化为O2 , 可以实现O2的部分自给。研究表明,CO2在一定条件下与H2O发生氧再生反应:(1)、已知:CH4的燃烧热 , 的蒸发热则氧再生反应的
(2)、恒压条件时,按 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
①若 ,则曲线代表CH4。
②350℃时,A点的平衡常数为 (填计算结果),为提高CO2的转化率,除改变温度外,还可采取的措施为。
③关于以上反应,下列说法正确的是(填字母)。
a.CH4和CO2浓度相等时可判断反应到达平衡状态
b.消耗1 mol CO2同时断裂4 mol C-H键可判断反应到达平衡状态
c.平衡后,按起始原料比再充入反应物,维持温度不变,再次达平衡时,甲烷的体积分数不变
d.若体系改为恒温恒容,反应物起始投料比不变,CO2的平衡转化率减小
(3)、氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:
①光催化CO2转化为CH4的阴极方程式为。
②催化剂的催化效率和CH4的生成速随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是。
32. 研究减少CO2排放是一项重要课题。CO2催化加氢生成乙烯等低碳烯烃,进而制取液态烃,作为低碳液态燃料。制取乙烯发生的主要反应有:i.2CO2(g)+6H2(g) ⇌C2H4(g)+4H2O(g)△H=-127.89kJ•mol-1
ii.CO2(g)+H2(g) ⇌H2O(g)+CO(g)△H=+41.2kJ•mol-1
(1)、CO2催化加氢制乙烯包括两个步骤:步骤I:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)+CO(g)△H=-49.5kJ•mol-1 , 写出步骤II由甲醇制乙烯的热化学方程式。
(2)、不同压强下CO2的平衡转化率与温度的关系如图:
①400~600℃,CO2的平衡转化率随着压强的升高而增大,B点v正A点v逆(填“>”“<”或“=”)。在A点给定的温度和压强下,提高CO2平衡转化率的方法有。(任写一种)
②在恒定压强下,随着温度的升高,CO2的平衡转化率先降低后升高。试分析可能原因。
③根据图像可知,为了获得更多乙烯等低碳烯烃,反应条件应控制在(填序号)。
A.压强0.1~1.0MPa B.温度300~400℃
C.压强2.0~3.0MPa D.温度900~1000℃
一定条件下,将H2和CO2[n(H2):n(CO2)=3]以一定的流速通过K—Fe—MnO/Al2O3催化剂进行反应,测得CO2的平衡转化率为50.0%,C2H4和CO的物质的量之比为2∶1,反应i的化学平衡常数Kp=(只列算式不计算)。不改变气体流速和温度,一定能提高C2H4选择性的措施有。(任写二种)
33. 实验室以天青石精矿(主要含SrSO4 , 还含有少量SiO2、CaSO4、BaSO4)为原料制取SrSO4 , 其实验流程如下: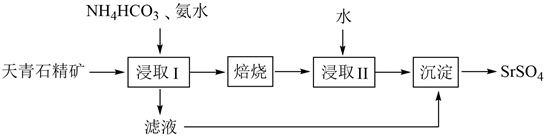 (1)、室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则反应的平衡常数为[Ksp(SrSO4)=3.2×10−7 , Ksp(SrCO3)=5.6×10−10]。(2)、浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是。“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,其原因是。(3)、“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:。(4)、“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为。(5)、将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(SrS)。
(1)、室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则反应的平衡常数为[Ksp(SrSO4)=3.2×10−7 , Ksp(SrCO3)=5.6×10−10]。(2)、浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是。“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,其原因是。(3)、“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:。(4)、“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为。(5)、将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(SrS)。①写出生成SrS的化学反应方程式:。
②设计以黑灰为原料,制取SrSO4的实验方案:。
(已知:SrS易溶于水,易水解。水浸时的浸取率随温度变化如下图。实验中锶元素需充分转化SrSO4 , 必须使用的试剂:蒸馏水、3mol·L-1H2SO4和NaOH溶液)。
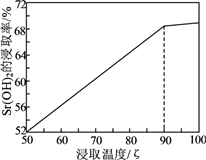 34. 用电镀锡渣(主要含 、 )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
34. 用电镀锡渣(主要含 、 )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
已知:① 易水解生成碱式氯化亚锡 ;②在水溶液中, 易被氧化为 。
请回答下列问题:
(1)、锡在周期表中的位置为。(2)、已知反应I得到的沉淀是 ,产生气体的结构式为 , 反应的化学方程式为。(3)、图中滤液的主要成分为、(写化学式)。(4)、酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:。(5)、电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为。35. “绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。(1)、亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为。相关化学键的键能如下表所示:
化学键
Cl—Cl
N O(NO气体)
Cl—N
N=O
键能/(kJ·mol-1)
243
630
200
607
(2)、燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1 , 对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:时间/min
浓度/mol·L-1
0
10
20
30
40
50
O2
1.00
0.79
0.60
0.60
0.64
0.64
CO2
0
0.42
0.80
0.80
0.88
0.88
①0~10min内,平均反应速率v(CO2)=mol·L-1·min-1;当升高温度,该反应的平衡常数K(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是 (填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)、NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ·mol-1 , 用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)、为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1 , 生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅降低温度,k正减小的倍数 (填“>”、“<”或“=”)k逆减小的倍数。②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则 =(计算结果用分数表示)36. 甲醇是一种重要的有机化工原料,需求量巨大.目前我国独创的联醇工艺的核心是采用一氧化碳加氢中压合成法.主要反应如下:CO(g)+2H2(g)═CH3OH(g);△H=﹣111.0kJ/mol另有副反应:2CO+2H2O═CO2+CH4 等;中压法操作:压力为10﹣15MPa,温度控制在513K﹣543K,所用催化剂是CuO﹣ZnO﹣Al2O3 . 合成甲醇的流程如图所示,
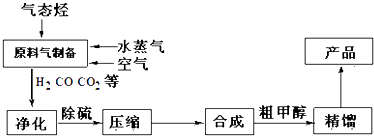
请回答:
(1)、实际生产中CO不能过量,以免生成羰基铁使催化剂失去活性,而氢气过量是有益的,指出两点理由:、 .(2)、采取10﹣15MPa压力的作用是;温度控制在513K﹣543K的原因是 .(3)、原料气中的H2S对铜催化剂影响甚重,故必先去除之,通常用生石灰除杂,该反应的化学方程式为:(4)、粗甲醇中含有二甲醚等副产物,在常压下蒸馏粗甲醇,首先获得的馏分是(写结构简式);获得的甲醇又可在银催化下氧化成甲醛,该反应的化学方程式为: .(5)、若CO的转化率为80%,当有22.4M3(标况)CO与过量H2充分反应(不计其它副反应),可制得纯度为96%的甲醇的质量为kg,同时获得热量kJ.