高考二轮复习知识点:化学平衡的影响因素3
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 在恒温恒容条件下,发生反应A(s)+2B(g)3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是( )
 A、从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率 B、从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率 C、在不同时刻都存在关系:2v(B)=3v(X) D、维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示2. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10﹣5 . 已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.
A、从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率 B、从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率 C、在不同时刻都存在关系:2v(B)=3v(X) D、维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示2. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10﹣5 . 已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
A、增加c(CO),平衡向正向移动,反应的平衡常数增大 B、第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ C、第二阶段,Ni(CO)4分解率较低 D、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)3.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g).设起始 =Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是( )
 A、该反应的焓变△H>0 B、图中Z的大小为a>3>b C、图中X点对应的平衡混合物中 =3 D、温度不变时,图中X点对应的平衡在加压后φ(CH4)减小4. 和存在平衡:。下列分析正确的是( )A、平衡混合气体中含N原子大于 B、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 C、恒容时,充入少量 , 平衡正向移动导致气体颜色变浅 D、断裂中的共价键所需能量大于断裂中的共价键所需能量5. 在一体积可变的密闭容器中加入足量的固体,并充入 , 发生反应。已知:与平衡分压比的自然对数值[]与温度的关系如图所示。下列说法正确的是( )
A、该反应的焓变△H>0 B、图中Z的大小为a>3>b C、图中X点对应的平衡混合物中 =3 D、温度不变时,图中X点对应的平衡在加压后φ(CH4)减小4. 和存在平衡:。下列分析正确的是( )A、平衡混合气体中含N原子大于 B、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 C、恒容时,充入少量 , 平衡正向移动导致气体颜色变浅 D、断裂中的共价键所需能量大于断裂中的共价键所需能量5. 在一体积可变的密闭容器中加入足量的固体,并充入 , 发生反应。已知:与平衡分压比的自然对数值[]与温度的关系如图所示。下列说法正确的是( ) A、平衡常数K值随着温度的升高而减小 B、缩小容器体积有利于提高的平衡转化率 C、X点反应达到平衡时,的转化率约为 D、向X点对应的平衡体系再充入和 , 平衡不移动6. 二甲醚催化制备乙醇主要涉及以下两个反应:
A、平衡常数K值随着温度的升高而减小 B、缩小容器体积有利于提高的平衡转化率 C、X点反应达到平衡时,的转化率约为 D、向X点对应的平衡体系再充入和 , 平衡不移动6. 二甲醚催化制备乙醇主要涉及以下两个反应:反应I:
反应II:
在固定的原料比及体系压强不变的条件下,同时发生反应I、II,平衡时部分物质的物质的量分数随温度的变化如图所示。

下列说法正确的是( )
A、反应一定可以自发进行 B、温度高于时,温度对反应I的影响大于对反应II的影响 C、由如图可知随着温度的升高,的平衡转化率先下降后升高 D、其他条件不变,延长反应时间或选用对反应II催化性能更好的催化剂都能提高平衡混合物中乙醇含量7. 一定温度下,在3个体积均为的恒容密闭容器中发生反应 , 相关数据如下表(已知:炭粉足量)。容器
T/℃
物质的起始浓度/()
物质的平衡浓度 ()
Ⅰ
1.00
0
0
0.85
Ⅱ
0
1.00
1.00
x
Ⅲ
2.00
0
0
1.60
下列说法错误的是( )
A、 B、达到平衡所需时间: C、 D、℃,该反应的化学平衡常数8. 在容积一定的密闭容器中,反应2X(?)⇌Y(g)+Z(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述错误的是( )A、正反应吸热 B、平衡常数增大 C、反应速率增大 D、X是气态9. 对于平衡体系 , 下列结论中错误的是( )A、若温度不变,且 , 将容器的体积缩小到原来的一半,达到新平衡时的浓度相比原来的浓度增大了 B、若平衡时,、的转化率相等,说明反应开始时,、的物质的量之比为 C、保持其它条件不变,升高温度,的体积分数增大说明该反应的 D、若 , 则向含有气体的平衡体系中再加入的气体,达到新平衡时,气体的总物质的量等于10. 柴油燃油车是通过尿素-选择性催化还原法处理氮氧化物。其工作原理为:将尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 , 生成的与富氧尾气混合后,在催化剂作用下,使氮氧化物得以处理。如图为在不同投料比[]时NO转化效率随温度变化的曲线。下列说法错误的是( ) A、投料比[]:曲线a大于曲线b B、使用催化剂可以提高NO的平衡转化率 C、图中温度升高,NO转化率升高的可能原因是氨气的释放速度加快,催化剂的活性增强 D、图中温度过高,NO转化率下降的的可能原因是发生反应11. 大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1 , T2)海水中CO浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq) 2HCO (aq),下列说法错误的是( )
A、投料比[]:曲线a大于曲线b B、使用催化剂可以提高NO的平衡转化率 C、图中温度升高,NO转化率升高的可能原因是氨气的释放速度加快,催化剂的活性增强 D、图中温度过高,NO转化率下降的的可能原因是发生反应11. 大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1 , T2)海水中CO浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq) 2HCO (aq),下列说法错误的是( ) A、T1>T2 B、海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO浓度降低 C、当大气中CO2浓度确定时,海水温度越高,CO 浓度越低 D、大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解12. 反应A(g)+B(g)3X,在其他条件不变时,通过调节容器体积改变压强,达平衡时c(A)如下表:
A、T1>T2 B、海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO浓度降低 C、当大气中CO2浓度确定时,海水温度越高,CO 浓度越低 D、大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解12. 反应A(g)+B(g)3X,在其他条件不变时,通过调节容器体积改变压强,达平衡时c(A)如下表:平衡状态
①
②
③
容器体积/L
40
20
1
c(A)( mol·L-1)
0.022a
0.05a
0.75a
下列分析错误的是( )
A、①→②的过程中平衡发生了逆向移动 B、①→③的过程中X的状态发生了变化 C、①→③的过程中A的转化率不断减小 D、与①②相比,③中X的物质的量最大13. 密闭真空容器中放入BaO2固体,发生反应2BaO2(s)2BaO(s)+O2(g) △H<0,并达到平衡状态Ⅰ;保持温度不变,缩小容器体积,达到平衡状态Ⅱ;平衡状态Ⅰ与Ⅱ不同的是( )A、平衡常数 B、反应速率 C、氧气浓度 D、BaO的量二、多选题
-
14. 反应物(S)转化为产物(P或 )的能量与反应进程的关系如下图所示:
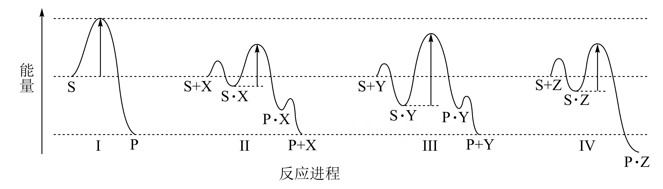
下列有关四种不同反应进程的说法正确的是( )
A、进程Ⅰ是放热反应 B、平衡时P的产率:Ⅱ>Ⅰ C、生成P的速率:Ⅲ>Ⅱ D、进程Ⅳ中,Z没有催化作用15. 已知反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( ) A、升高温度,K减小 B、减小压强,n(CO2)增加 C、更换高效催化剂,α(CO)增大 D、充入一定量的氮气,n(H2)不变16. 将BaO2放入密闭的真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )A、平衡常数减小 B、BaO量不变 C、氧气压强不变 D、BaO2量增加17.
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( ) A、升高温度,K减小 B、减小压强,n(CO2)增加 C、更换高效催化剂,α(CO)增大 D、充入一定量的氮气,n(H2)不变16. 将BaO2放入密闭的真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )A、平衡常数减小 B、BaO量不变 C、氧气压强不变 D、BaO2量增加17.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
 ⇌
⇌  +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:时间/min
0
10
20
30
40
n(乙苯)/mol
0.40
0.30
0.24
n2
n3
n(苯乙烯)/mol
0.00
0.10
n1
0.20
0.20
下列说法正确的是( )
A、反应在前20 min的平均速率为v(H2)=0.004mol•L﹣1•min﹣1 B、保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L﹣1 , 则a<0 C、保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% D、相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)18. 在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X,Y,Z的物质的量的变化如图所示.则下列有关推断正确的是 ( ) A、该反应的化学方程式为3X+2Y⇌2Z B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 D、若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应19.
A、该反应的化学方程式为3X+2Y⇌2Z B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 D、若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应19.一定条件下存在反应:2SO2(g)+O2 (g)═2SO3(g),其正反应放热.现有三个体积相同的密闭容器 I、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )
 A、容器Ⅰ、Ⅲ中平衡常数相同 B、容器Ⅱ、Ⅲ中正反应速率相同 C、容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ D、容器Ⅰ中SO2的转化率与容器 II中SO3的转化率之和小于120. 在某一密闭容器中,若反应2NO2(g)⇌N2O4(g)达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )A、容器内气体密度减小 B、平衡向正反应方向移动 C、二氧化氮的转化率增大 D、四氧化二氮的体积分数减小
A、容器Ⅰ、Ⅲ中平衡常数相同 B、容器Ⅱ、Ⅲ中正反应速率相同 C、容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ D、容器Ⅰ中SO2的转化率与容器 II中SO3的转化率之和小于120. 在某一密闭容器中,若反应2NO2(g)⇌N2O4(g)达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )A、容器内气体密度减小 B、平衡向正反应方向移动 C、二氧化氮的转化率增大 D、四氧化二氮的体积分数减小三、非选择题
-
21. 氨基钠()是重要的化学试剂,实验室可用下图装置(夹持、搅拌、尾气处理装置已省略)制备。

简要步骤如下:
Ⅰ.在瓶A中加入液氨和 , 通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入钠粒,反应,得粒状沉积物。
Ⅲ.除去液氨,得产品。
已知:几乎不溶于液氨,易与水、氧气等反应。
请回答:
(1)、的作用是;装置B的作用是。(2)、步骤Ⅰ,为判断密闭体系中空气是否排尽,请设计方案。(3)、步骤Ⅱ,反应速率应保持在液氨微沸为宜。为防止速率偏大,可采取的措施有。(4)、下列说法不正确的是____。A、步骤Ⅰ中,搅拌的目的是使均匀地分散在液氨中 B、步骤Ⅱ中,为判断反应是否已完成,可在N处点火,如无火焰,则反应已完成 C、步骤Ⅲ中,为避免污染,应在通风橱内抽滤除去液氨,得到产品 D、产品应密封保存于充满干燥氮气的瓶中(5)、产品分析:假设是产品的唯一杂质,可采用如下方法测定产品纯度。从下列选项中选择最佳操作并排序。准确称取产品→→→→计算
a.准确加入过量的水
b.准确加入过量的标准溶液
c.准确加入过量的标准溶液
d.滴加甲基红指示剂(变色的范围4.4~6.2)
e.滴加石蕊指示剂(变色的范围4.5~8.3)
f.滴加酚酞指示剂(变色的范围8.2~10.0)
g.用标准溶液滴定
h.用标准溶液滴定
i.用标准溶液滴定
22. 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:(1)、在C和O2的反应体系中:反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
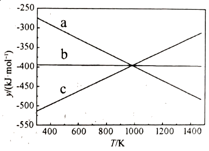
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
(2)、水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是。(3)、一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
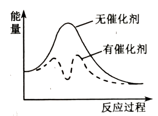
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。
23. 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):①称取 ,配成 溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以 的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
(1)、仪器a的名称是;使用恒压滴液漏斗的原因是。(2)、实验室制取 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为 , 对应的装置为(填标号)。可供选择的试剂: 、 、 、 、饱和 、饱和
可供选择的发生装置(净化装置略去):
 (3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。24. 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)、Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 .(2)、
(3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。24. 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)、Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 .(2)、CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0mol•L﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.

①用离子方程式表示Na2CrO4溶液中的转化反应 .
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).根据A点数据,计算出该转化反应的平衡常数为 .
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H(填“大于”“小于”或“等于”).
(3)、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl﹣ , 利用Ag+与CrO42﹣生成砖红色沉淀,指示到达滴定终点.当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5mol•L﹣1)时,溶液中c(Ag+)为mol•L﹣1 , 此时溶液中c(CrO42﹣)等于mol•L﹣1 . (已知Ag2 CrO4、AgCl的Ksp分别为2.0×10﹣12和2.0×10﹣10).(4)、+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+ , 反应的离子方程式为 .25. 催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣53.7kJ•mol﹣1 Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJ•mol﹣1和﹣285.8kJ•mol﹣1 .
②H2O(1)═H2O(g)△H3=44.0kJ•mol﹣1
请回答(不考虑温度对△H的影响):
(1)、反应I的平衡常数表达式K=;反应Ⅱ的△H2=kJ•mol﹣1 .(2)、有利于提高CO2转化为CH3OH平衡转化率的措施有 .A、使用催化剂Cat.1 B、使用催化剂Cat.2 C、降低反应温度 D、投料比不变,增加反应物的浓度 E、增大 CO2和H2的初始投料比(3)、表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 .(4)、在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图.
 (5)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .26. 我国提出力争在2030年前实现碳达峰,2060 年前实现碳中和。“双碳”战略倡导绿色、低碳的生产生活方式,加快降低碳排放的步伐,有利于引导绿色技术创新发展。(1)、①CH4— CO2催化重整反应包含积碳反应和消碳反应,生成CO和H2:
(5)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .26. 我国提出力争在2030年前实现碳达峰,2060 年前实现碳中和。“双碳”战略倡导绿色、低碳的生产生活方式,加快降低碳排放的步伐,有利于引导绿色技术创新发展。(1)、①CH4— CO2催化重整反应包含积碳反应和消碳反应,生成CO和H2:积碳反应: CH4(g) = C(s) + 2H2(g) ΔH= +75 kJ·mol-l
消碳反应: CO2(g) + C(s)= 2CO(g) ΔH= +172 kJ·mol-1
则CH4—CO2催化重整反应的热化学方程式为;
②反应中催化剂的活性会因积碳反应而降低,消碳反应则使积碳量减少。
催化剂
积碳反应活化能/kJ·mol-1
消碳反应活化能/kJ·mol-1
X
al
b1
Y
a2
b2
若催化剂X优于催化剂Y,则a1与a2 , b1与b2的最佳关系为a1 a2 , b1b2 (填“>”“<”或“=”)。
(2)、一定条件下CO2与H2可发生化学反应: CO2(g) + H2(g) CO(g) + H2O(g),化学平衡常数K与温度T的关系如下表所示:T/℃
700
800
850
1000
1200
K
0.6
0.9
1.0
1.7
2.6
①降低温度,化学平衡向 (填“正反应”或“逆反应”)方向移动,原因是;
②某温度下,平衡浓度符合如下关系: c(CO2) c (H2) = c (CO) c (H2O),在此温度下,若该容器中含有0.8 mol CO2、1.0 mol H2、1.2 mol CO、1.2 mol H2O(g),则此时v正v逆(填“>”“<”或“=”)。
(3)、一定条件下,工业上还可利用CO2来生产燃料甲醇。已知制备甲醇的化学反应为CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g)。某温度下,向容积为1L的密闭容器中,充入amolCO2和3amolH2 , tmin时反应达到平衡,此时CH3OH的产率为b,则从0~tmin, v(CO2) = mol·L-l·min-1 , 该温度下的反应平衡常数为(mol·L-1)-2。27. 将 和 两种引发温室效应的气体转化为合成气( 和 ),可以实现能量综合利用,对环境保护具有十分重要的意义。(1)、利用 在一定条件下重整的技术可得到富含 的气体,重整过程中的催化转化原理如图所示。
已知:i.
ii.
①过程I反应的化学方程式为。
②该技术总反应的热化学方程式为。
③反应i甲烷含量随温度变化如图1,图中 四条曲线中的两条代表压强分别为 时甲烷含量曲线,其中表示 的是
 (2)、甲烷的水蒸汽重整涉及以下反应
(2)、甲烷的水蒸汽重整涉及以下反应I.
II.
在一密闭体积可变容器中,通入 和 发生甲烷的水蒸汽重整反应。
①反应I的平衡常数的表达式为。
反应II平衡常数 (填“>”“<”或“=”)。
②压强为 时,分别在加 和不加 时,平衡体系 的物质的量随温度变化如图2所示。温度低于700℃时,加入 可明显提高混合气中 的量,原因是。
 28. 含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:(1)、利用工业尾气与反应制备新型硝化剂 , 过程中涉及以下反应:
28. 含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:(1)、利用工业尾气与反应制备新型硝化剂 , 过程中涉及以下反应:Ⅰ. 平衡常数K1
Ⅱ. 平衡常数
Ⅲ. 平衡常数K3
平衡常数K与温度T的函数关系为 , , , 其中x、y、z为常数,则反应Ⅰ的活化能Ea(正)Ea(逆)(填“>”或“<”),的数值范围是。
(2)、与作用分别生成、NO、的反应均为放热反应。工业尾气中的可通过催化氧化为除去。将一定比例的、和的混合气体以一定流速通过装有催化剂的反应管,的转化率、的选择在[]与温度的关系如图所示。
①其他条件不变,在范围内升高温度,出口处氮氧化物的量(填“增大”或“减小”),的平衡转化率(填“增大”或“减小”)。
②需研发(“高温”或“低温”)下的选择性高的催化剂,能更有效除去尾气中的。
(3)、在催化剂条件下发生反应:可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始时体系中气体分压且 , 测得反应体系中CO和N2的分压随时间变化情况如表所示。时间/min
0
30
60
120
180
200℃
物质a的分压/kPa
4
8.8
13
20
20
物质b的分压/kPa
48
45.6
43.5
40
40
300℃
物质a的分压/ kPa
100
69.0
48
48
48
物质b的分压/ kPa
10
25.5
36
36
36
该反应的0(填“>”或“<”),物质a为(填“CO”或“”),200℃该反应的化学平衡常数。
29. 乙烯是石油化工最基本原料之一。(1)、I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g)=C2H4(g)+H2(g) ΔH1>0。提高乙烷平衡转化率的措施有、。
(2)、一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2 , 初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为kPa,该反应的平衡常数Kp= kPa (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)、II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:a.2C2H6(g)+ O2(g)= 2C2H4(g) + 2H2O(g) △H2<0
b.2C2H6(g) + 5O2(g)= 4CO(g) + 6H2O(g) △H3<0
c.C2H4(g)+ 2O2(g)= 2CO(g) + 2H2O(g) △H4<0
根据盖斯定律,反应a的△H2= (写出代数式)。
(4)、氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应(选填“a、b、c”)的活化能。(5)、常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如下图所示。
①乙烯的物质的量百分数随温度升高而降低的原因是。
②在570~600℃温度范围内,下列说法正确的有(填字母)。
A.C2H4产率随温度升高而增大
B.H2O的含量随温度升高而增大
C.C2H6在体系中的物质的量百分数随温度升高而增大
D.此催化剂的优点是在较低温度下降低CO的平衡产率
③某学者研究了生成C2H4的部分反应历程如下图所示。写出该历程的总反应方程式。该历程的催化剂是。
 30. 乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应有:
30. 乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应有:I.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H1
II.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H2=+173kJ·mol-1
III.CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.2kJ·mol-1
IV.C2H5OH(g)+2H2(g)=2CH4(g)+H2O(g) △H4=-156.2kJ·mol-1
(1)、△H1=kJ·mol-1。(2)、压强为100kPa的条件下,图1是平衡时体系中各产物的物质的量分数与温度的关系,图2是H2的平衡产率与温度及起始时的关系。
①图1中c线对应的产物为(填“CO2”、“H2”或“CH4”)。
②图2中B点H2的产率与A点相等的原因是。
(3)、反应温度T℃、0.1MPa的恒压密闭容器中,充入1mol乙醇和xmolH2O(g),若只发生反应CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g),平衡时,乙醇转化率为α,CO2的压强为MPa,反应平衡常数Kp=(以分压表示,分压=总压×物质的量分数。列出计算式即可)(4)、CH3CH2OH(g)在催化剂Rh/CeO2上反应制取氢气的机理如图:
①出生成CO(g)步骤的化学方程式。
②下列措施可以提高CH3CH2OH在催化剂表面吸附率的有(填标号)。
a..减小乙醇蒸气的分压 b.增大催化剂的比表面积
31. 氢气是一种理想的二次能源,在石油化工、冶金工业、治疗疾病、航空航天等方面有着广泛的应用。以甲醇、甲酸为原料制取高纯度的H2是清洁能源的重要研究方向。回答下列问题:(1)、甲醇水蒸气重整制氢主要发生以下两个反应。主反应:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H=+49 kJ·mol-1
副反应:H2(g)+CO2(g)CO(g)+H2O(g) △H=+40 kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为 , 既能加快反应速率又能提高CH3OH平衡转化率的一种措施是。
②若上述副反应的活化能Ea1=w kJ·mol-1 , 则CO(g)+H2O(g)H2(g)+CO2(g)的活化能Ea2=kJ·mol-1。
③某温度下,将n(H2O)∶n(CH3OH)=1∶1的原料气分别充入密闭容器中(忽略副反应),设恒容下甲醇的平衡时转化率为α1 , 恒压条件下甲醇的平衡时转化率为α2 , 则α1α2(填“>”、“<”或“=”)。
(2)、工业上常用CH4与水蒸气在一定条件下来制取H2 , 其反应原理为:CH4(g)+H2O(g)CO(g)+3H2(g) △H=+203 kJ·mol-1 , 在容积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
压强为p1时,在N点:v正v逆(填“>”、“<”或“=”),N点对应温度下该反应的逆反应的平衡常数K= L2·mol-2。比较:p1p2(填“>”、“<”或“=”)。
(3)、HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图所示。
①HCOOD催化释氢反应除生成HD外,还生成(填化学式)。
②研究发现:其他条件不变时,HCOOK替代一部分HCOOH,催化释氢的速率增大,根据图示反应机理解释其可能的原因是。
32.(1)、I.联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。在25℃时,1.00gN2H4(l)与足量N2O4(1)完全反应生成N2(g)和H2O(1),放出19.14kJ的热量。写出该反应的热化学方程式。
(2)、 II.NO2是氮的常见氧化物,能自发发生如下反应:2NO2(g)⇌N2O4(g) =-57.20kJ/mol写出该反应的平衡常数表达式K=。已知:在一定温度下的密闭容器中,该反应已达到平衡。保持其他条件不变,下列措施能提高NO2转化率的是。
a.减小NO2的浓度 b.降低温度 c.增大压强 d.升高温度
(3)、III.Na2CO3俗称纯碱,是生活中的常用物质。某化学兴趣小组的同学对Na2CO3溶液显碱性的原因进行了探究,设计了如下实验方案进行操作并记录实验现象。实验操作
实验现象
取少量Na2CO3固体,加入无水酒精,充分振荡、静置
溶液为无色
取上层清液于试管中,滴加酚酞试剂
溶液为无色
在试管中继续加入少量水
溶液变为红色
向该红色溶液中滴加足量BaCl2溶液(中性)
红色褪去
①该实验表明,Na2CO3溶液显碱性的原因是(请结合化学用语,简要说明)。
②从形成盐的酸和碱的强弱角度看,Na2CO3属于盐。
③为了使Na2CO3溶液中的比值变小,可适量加入(或通入)的物质是。
a.CO2气体 b.KOH固体 c.HCl气体 d.Na2CO3固体
33. 中国化学工作者在《Science》刊文发表了甲烷在催化作用下脱氢制忆烯的相关论文,其反应如下 , 回答下列问题:(1)、已知、的的燃烧热如下表所示:物质
燃烧热
890.3
1411
285.8
.
(2)、时,向恒温恒容密闭容器中充入发生上述反应,达到平衡时,测得 , 则 . 此时将温度改变至 , 经tmin后再次达到平衡,测得 , 内的平均速率为 , 则(填“>”或“<”),t= .(3)、若改变外界反应条件,使甲烷平衡浓度减小,则除改变温度外还可能是(写一条即可)(4)、不同温度下,加入一定量的发生上上述反应,、的平衡分压随温度的变化如图所示.时,该反应的平衡常数(以分压代替平衡浓度计算). (5)、某温度下,在一恒压密闭容器中加入一定量的和进行反应,随时间(t)的变化,下列示意图错误的是(填标号).A.
(5)、某温度下,在一恒压密闭容器中加入一定量的和进行反应,随时间(t)的变化,下列示意图错误的是(填标号).A. B.
B. C.
C. D.
D. 34. 温室气体的利用是当前环境和能源领域的研究热点,合理利用燃料废气中的CO2 , 也是实现“碳中和”的途径之一。(1)、I.温室气体CO2转化为重要的工业原料甲酸是目前科学研究的热点。回答下列问题:
34. 温室气体的利用是当前环境和能源领域的研究热点,合理利用燃料废气中的CO2 , 也是实现“碳中和”的途径之一。(1)、I.温室气体CO2转化为重要的工业原料甲酸是目前科学研究的热点。回答下列问题:已知:①CO(g)+H2O(g) HCOOH(g) △H1=−72.6kJ·mol−1
②2CO(g)+O2(g) 2CO2(g) △H2=−566.0kJ·mol−1
则反应③的平衡常数表达式K= , 写出反应③的热化学方程式。
(2)、刚性绝热密闭容器中,等物质的量的CO2(g)和H2O(g)发生反应③,下列可判断反应达到平衡的是____(填标号)。A、CO2(g)和H2O(g)的物质的量之比不变 B、容器中气体平均摩尔质量不变 C、2υ正(CO2)= υ逆(O2) D、容器内温度不变(3)、在催化剂作用下CO2和H2也可以合成甲酸,主要涉及以下反应:i.СО2(g)+Н2(g) НСООН(g) △H3<0
ii.CO2(g)+H2(g) CO(g)+H2O(g) △H4
刚性密闭容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图所示。(选择性是指转化成目标产物的反应物在实际消耗的反应物中的占比)

①曲线a随温度升高而下降的原因是;为同时提高CO2的平衡转化率和平衡时HCOOH的选择性,应选择的反应条件为(填标号)。
A. 低温、低压 B.高温、高压 C.高温、低压 D.低温、高压
②240℃时,容器内压强随时间的变化如下表所示:
时间/min
0
20
40
60
80
压强/MPa
p0
0.91p0
0.85p0
0.80p0
0.80p0
反应i的速率可表示为υ=k·p(CO2)·p(H2)(p为气体分压,分压=总压×气体的物质的量分数, k为常数),则反应在60 min时υ=(用含p0、k的式子表示)。
(4)、Ⅱ.CO2−CH4催化重整对减少温室气体的排放、改善大气环境具有重要的意义。在密闭容器中通入物质的量均为0.2mol的CH4和CO2 , 在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4的平衡转化率与温度及压强的关系如图所示。

①由如图可知:压强p1p2(填“>”、“<”或“=”)。
②Y点:υ(正)υ(逆)(填“>”、“<”或“=”)。
35. 我国力争2060年前实现碳中和。CH4与CO2催化重整是实现碳中和的热点研究课题。该催化重整反应体系主要涉及以下反应:反应I:主反应CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1 Kp1
反应II:副反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 Kp2
反应III:积碳反应2CO(g)CO2(g)+C(s) ΔH3 Kp3
反应IV:积碳反应CH4(g)C(s)+2H2(g) ΔH4 Kp4
(1)、已知H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0lkJ·mol-1 , H2O(l)= H2O(g) ΔH5=+44kJ·mol-1 , 则反应II的ΔH2=kJ·mol-1。(2)、设Kp为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应III、IV的lgKp随(T表示温度)的变化如图所示。据图判断,反应I的ΔH10(选填“大于”、“小于”或“等于”),说明判断的理由。 (3)、下列关于该重整反应体系的说法正确的是____。A、在投料时适当增大的值,有利于减少积碳 B、在一定条件下建立平衡后,移去部分积碳,反应III和反应IV平衡均向右移 C、随着投料比的增大,达到平衡时CH4的转化率增大 D、降低反应温度,反应I、II、IV的正反应速率减小,逆反应速率增大;反应III的正反应速率增大,逆反应速率减小(4)、在一定条件下的密闭容器中,按照=1加入反应物,发生反应I(反应II、III、IV可忽略)。在不同条件下达到平衡,设体系中平衡状态下甲烷的物质的量分数为x(CH4),在T=800℃下的x(CH4)随压强p的变化曲线、在P=100kPa下的x(CH4)随温度T的变化曲线如图所示。
(3)、下列关于该重整反应体系的说法正确的是____。A、在投料时适当增大的值,有利于减少积碳 B、在一定条件下建立平衡后,移去部分积碳,反应III和反应IV平衡均向右移 C、随着投料比的增大,达到平衡时CH4的转化率增大 D、降低反应温度,反应I、II、IV的正反应速率减小,逆反应速率增大;反应III的正反应速率增大,逆反应速率减小(4)、在一定条件下的密闭容器中,按照=1加入反应物,发生反应I(反应II、III、IV可忽略)。在不同条件下达到平衡,设体系中平衡状态下甲烷的物质的量分数为x(CH4),在T=800℃下的x(CH4)随压强p的变化曲线、在P=100kPa下的x(CH4)随温度T的变化曲线如图所示。
①图中对应T=800℃下,x(CH4)随压强p的变化曲线是 , 判断的理由是。
②若x(CH4)=0.1.则CO2的平衡转化率为。