高考二轮复习知识点:化学反应速率2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 某温度下,在恒容密闭容器中发生反应 , 有关数据如下:
时间段/
产物Z的平均生成速率/
0~2
0.20
0~4
0.15
0~6
0.10
下列说法错误的是( )
A、时,Z的浓度大于 B、时,加入 , 此时 C、时,Y的体积分数约为33.3% D、时,X的物质的量为2. 捕获和转化可减少排放并实现资源利用,原理如图1所示。反应①完成之后,以为载气,以恒定组成的混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 , 在催化剂上有积碳。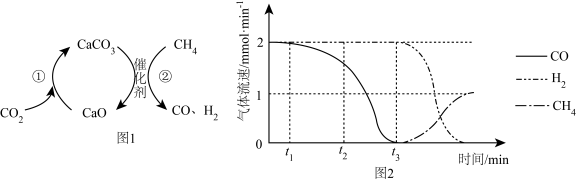
下列说法错误的是( )
A、反应①为;反应②为 B、 , 比多,且生成速率不变,可能有副反应 C、时刻,副反应生成的速率大于反应②生成速率 D、之后,生成的速率为0,是因为反应②不再发生3. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:, 测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
 A、实验①, , B、实验②,时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大4. 向体积均为 的两恒容容器中分别充入 和 发生反应: ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A、实验①, , B、实验②,时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大4. 向体积均为 的两恒容容器中分别充入 和 发生反应: ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
 A、 B、气体的总物质的量: C、a点平衡常数: D、反应速率:5. 在温度为500℃时,将通入2L恒容密闭容器中,恒温条件下发生反应 , 反应一段时间后,测得容器中部分组分的物质的量如表所示。下列有关描述正确的是
A、 B、气体的总物质的量: C、a点平衡常数: D、反应速率:5. 在温度为500℃时,将通入2L恒容密闭容器中,恒温条件下发生反应 , 反应一段时间后,测得容器中部分组分的物质的量如表所示。下列有关描述正确的是时间/s
20
30
40
1.0
0.8
0.6
A、反应到20s时,用表示的平均反应速率为 B、平衡后再向容器中加入 , 再达平衡时的转化率降低 C、该反应在30s时,分解=生成 D、若在600℃时反应,平衡常数 , 则该反应的正反应为吸热反应6. 在相同条件下研究催化剂Ⅰ、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图所示。下列说法正确的是 A、无催化剂时,反应不能进行 B、催化剂Ⅱ比催化剂Ⅰ效率更高 C、a曲线表示使用催化剂Ⅰ时A的浓度随t的变化 D、使用催化剂Ⅱ时,0~2min内,7. 在恒容密闭容器中,分别在、温度下 , 发生反应 , 反应体系中各物质的浓度c随时间t的部分变化曲线如图所示。下列说法正确的是
A、无催化剂时,反应不能进行 B、催化剂Ⅱ比催化剂Ⅰ效率更高 C、a曲线表示使用催化剂Ⅰ时A的浓度随t的变化 D、使用催化剂Ⅱ时,0~2min内,7. 在恒容密闭容器中,分别在、温度下 , 发生反应 , 反应体系中各物质的浓度c随时间t的部分变化曲线如图所示。下列说法正确的是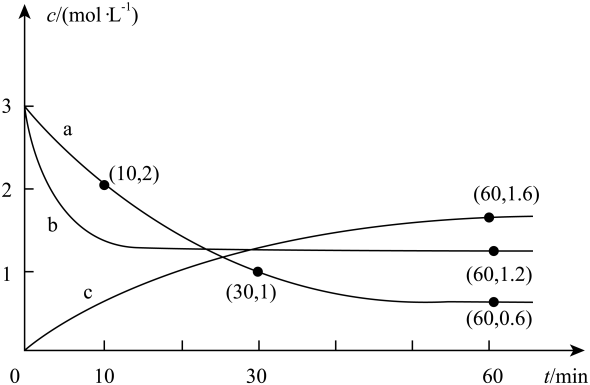 A、向密闭容器内充入He,平衡逆向移动 B、a曲线条件下,10~30min内 C、曲线b表示温度下,反应过程中物质A的浓度变化 D、在工业实际生产中,温度越低,越有利于提高生产效率8. 一种制备蓝氢的原理是。向一体积为1L的恒容密闭容器中充入1mol和2mol , 在一定条件下发生上述反应,测得的物质的量与时间的关系如表所示。下列叙述错误的是
A、向密闭容器内充入He,平衡逆向移动 B、a曲线条件下,10~30min内 C、曲线b表示温度下,反应过程中物质A的浓度变化 D、在工业实际生产中,温度越低,越有利于提高生产效率8. 一种制备蓝氢的原理是。向一体积为1L的恒容密闭容器中充入1mol和2mol , 在一定条件下发生上述反应,测得的物质的量与时间的关系如表所示。下列叙述错误的是t/min
0
5
10
15
20
25
/mol
0
0.5
0.75
0.85
0.9
0.9
A、0~10min, B、CO的体积分数不变时,反应达到平衡状态 C、上述反应中,的转化率大于的转化率 D、其他条件不变。若加入高效催化剂,则的转化率达到45%时所用时间小于20min9. 一定温度下,向容积为2L的恒容密闭容器中通入一定量N2O4 , 发生反应N2O4(g)2NO2(g) △H>0,反应起始时容器内气体的总压强为p,体系中各组分的物质的量随时间(t)的变化如表。t/s
0
20
40
60
80
n(N2O4)/mol
0.100
0.062
0.048
0.040
0.040
n(NO2)/mol
0
0.076
0.104
0.120
0.120
下列说法正确的是
A、20~60s内,NO2的平均反应速率υ=1.1×10−3 mol∙L−1∙s−1 B、N2O4的平衡转化率为40% C、该温度下,反应的压强平衡常数Kp=p D、80s时,再充入0.03molNO2、0.01molN2O4 , 平衡逆向移动10. T ℃时,在体积为2 L的恒温恒容密闭容器中充入4 mol CO和4 mol , 发生反应 , 测得和的物质的量随时间的变化如图所示。该反应的正、逆反应速率分别可表示为 , , 、分别为正、逆反应速率常数,只受温度影响。下列说法正确的是 A、从反应开始至达到平衡时,以表示的平均反应速率为 B、该反应在A、B两点的正反应速率之比为 C、当容器中混合气体的密度不随时间变化时,该反应达到平衡状态 D、T ℃时,该反应的平衡常数为11. 将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2 SO2(g)+ O2(g)
A、从反应开始至达到平衡时,以表示的平均反应速率为 B、该反应在A、B两点的正反应速率之比为 C、当容器中混合气体的密度不随时间变化时,该反应达到平衡状态 D、T ℃时,该反应的平衡常数为11. 将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2 SO2(g)+ O2(g) 2SO3(g) △H<0。得到如表中的两组数据:
2SO3(g) △H<0。得到如表中的两组数据:实验编号
温度/℃
平衡常数/mol-1·L
起始量/mol
平衡量/mol
达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
下列说法错误的是
A、实验1在前6min的平均反应速率υ(SO2)=0.2 mol·L-1·min-1 B、T1、T2的关系:T1 > T2 C、K1、K2的关系:K2>K1 D、x= 1.6,y=0.2 ,t<612. 高粱酿酒过程中部分操作如图所示。下列说法错误的是



“蒸粮”时加热
“拌曲”前摊晾
“堆酵”时升温
“馏酒”时控温
A、“蒸粮”时可适当鼓风加快燃烧速率 B、““拌曲”加入的酒曲在酿酒时起到催化作用 C、“堆酵”时升温是因为吸收环境中的热量 D、“馏酒”的原理即实验操作中的“蒸馏”13. 向1L的恒容密闭容器中加入1molX和3molY,发生反应X(g)+3Y(g)2Z(g),X的转化率随温度t的变化如图所示(不同温度下的转化率均为反应第10min数据)。下列说法正确的是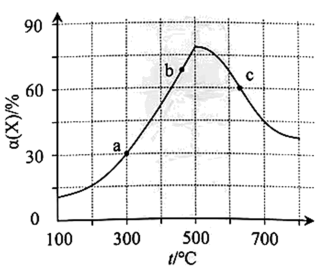 A、a点的反应速率 B、a、b、c点对应的大小关系为: C、c点时,每消耗的同时,消耗 D、若将容器体积扩大为2倍,则c点对应温度下的增大14. 研究催化剂对2NH3N2+3H2反应速率的影响。恒温、恒容时,c(NH3)随时间的变化如表。
A、a点的反应速率 B、a、b、c点对应的大小关系为: C、c点时,每消耗的同时,消耗 D、若将容器体积扩大为2倍,则c点对应温度下的增大14. 研究催化剂对2NH3N2+3H2反应速率的影响。恒温、恒容时,c(NH3)随时间的变化如表。时间/min
c(NH3)/(×10-3mol•L-1)
催化剂
0
20
40
60
80
催化剂I
2.40
2.00
1.60
1.20
0.80
催化剂II
2.40
1.60
0.80
0.40
0.40
下列说法错误的是
A、使用催化剂I,0~20min的平均反应速率v(N2)=1.00×10-5mol·L-1·min-1 B、使用催化剂Ⅱ,达平衡后容器内的压强是初始时的倍 C、相同条件下,使用催化剂Ⅱ可使该反应更快 D、相同条件下,使用催化剂Ⅱ可使该反应的化学平衡常数更大二、多选题
-
15. 恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①;②。反应①的速率 , 反应②的速率 , 式中为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的曲线。下列说法错误的是( )
 A、随的减小,反应①、②的速率均降低 B、体系中 C、欲提高Y的产率,需提高反应温度且控制反应时间 D、温度低于时,总反应速率由反应②决定16. T℃时,含等浓度的与的混合溶液中发生反应 , 时刻,改变某一外界条件继续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是
A、随的减小,反应①、②的速率均降低 B、体系中 C、欲提高Y的产率,需提高反应温度且控制反应时间 D、温度低于时,总反应速率由反应②决定16. T℃时,含等浓度的与的混合溶液中发生反应 , 时刻,改变某一外界条件继续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是
已知:T℃时,该反应的化学平衡常数K=1。
A、若时刻未改变外界条件,则此时该反应处于平衡状态 B、若时刻反应达到平衡,则时刻改变的条件可能为升温 C、若始终保持温度不变,则平均反应速率:(表示0~s内的平均反应速率,表示0~s内的平均反应速率) D、内的平均反应速率为17. 在容积为2L的恒容密闭容器中充入、 , 在不同温度下发生反应: , 测得的转化率与时间的关系如下图所示。下列说法正确的是 ( ) A、时,时的反应速率大于时,其中时 B、时的反应平衡常数 C、时,当容器中气体密度不再发生变化时,反应到达平衡状态 D、时,若起始向容器中加入催化剂,2s时,的转化率可能到达图中X点18. 在一恒温恒容密闭容器中充入和 , 一定条件下发生反应: , 测得和的浓度随时间变化如图所示。下列说法正确的是( )
A、时,时的反应速率大于时,其中时 B、时的反应平衡常数 C、时,当容器中气体密度不再发生变化时,反应到达平衡状态 D、时,若起始向容器中加入催化剂,2s时,的转化率可能到达图中X点18. 在一恒温恒容密闭容器中充入和 , 一定条件下发生反应: , 测得和的浓度随时间变化如图所示。下列说法正确的是( ) A、反应进行到3min时,该反应达到平衡状态 B、从反应开始到平衡,的转化率为75% C、 , 氢气的平均反应速率为 D、反应进行到10min时,该反应放出热量49.0kJ19. 某温度下,在2L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g)⇌cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中错误的是( )
A、反应进行到3min时,该反应达到平衡状态 B、从反应开始到平衡,的转化率为75% C、 , 氢气的平均反应速率为 D、反应进行到10min时,该反应放出热量49.0kJ19. 某温度下,在2L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g)⇌cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中错误的是( ) A、12s时,A的转化率为75% B、0-2s,D的平均反应速率为0.1mol/(L·s) C、化学计量系数之比b:c=1:2 D、图中两曲线相交时,A的消耗速率等于A的生成速率20. 在一体积为2 L的密闭容器中加入反应物N2、H2 , 发生如下反应:N2(g)+3H2(g) 2NH3(g)。反应过程中的部分数据如表所示,下列说法正确的是( )
A、12s时,A的转化率为75% B、0-2s,D的平均反应速率为0.1mol/(L·s) C、化学计量系数之比b:c=1:2 D、图中两曲线相交时,A的消耗速率等于A的生成速率20. 在一体积为2 L的密闭容器中加入反应物N2、H2 , 发生如下反应:N2(g)+3H2(g) 2NH3(g)。反应过程中的部分数据如表所示,下列说法正确的是( )
n(N2)
n(H2)
n(NH)3
0
1.0
1.2
0
2
0.9
4
0.75
6
0.3
A、0~2 min内,NH3的反应速率为0.05 mol·L-1·min-1 B、2 min时,H2的物质的量为0.3 mol C、4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0 D、4~6 min内,容器内气体的总物质的量不变21. 将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率 , 下列说法正确的是( )A、反应速率 B、该反应方程式中,x=2 C、2min时,A的物质的量为1.5mol D、2min时,A的转化率为60%22. 反应经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( ) A、a为c(X)随t的变化曲线 B、时, C、时,Y的消耗速率小于生成速率 D、后,23. 已知830℃时,可逆反应CO2(g)+H2(g)CO(g)+H2O(g)ΔH>0的平衡常数K=1。T℃下,在2L恒容密闭容器中,加入0.4mol CO2和0.8molH2 , 随着反应的进行,测得H2O(g)的物质的量浓度随时间变化如下表所示。
A、a为c(X)随t的变化曲线 B、时, C、时,Y的消耗速率小于生成速率 D、后,23. 已知830℃时,可逆反应CO2(g)+H2(g)CO(g)+H2O(g)ΔH>0的平衡常数K=1。T℃下,在2L恒容密闭容器中,加入0.4mol CO2和0.8molH2 , 随着反应的进行,测得H2O(g)的物质的量浓度随时间变化如下表所示。t/min
0
10
20
30
40
70
90
c/(mol·L-1)
0
0.04
0.07
0.09
0.10
0.12
0.12
关于该反应,下列说法正确的是( )
A、T<830 B、20~40min内,v(H2)=1.5×10-2mol·L-1·min-1 C、平衡后,仅增大压强,CO的体积分数将增大 D、若向容器中充入0.8 mol CO2和1.6molH2 , 反应达到平衡的时间小于70min24. 一定条件下,溶液的酸碱性对光催化染料R降解反应的影响如图所示。下列判断正确的是( ) A、50min时,pH=2和pH=7条件下,R的降解百分率不相等 B、其他条件相同时,溶液酸性越强,R的降解速率越大 C、其他条件相同时,R的起始浓度越小,R的降解速率越大 D、在0~5min内,pH=7条件下,R的平均降解速率为25. 温度为 , 容积为2L的恒容密闭容器中发生反应: , 反应过程中部分数据见下表:
A、50min时,pH=2和pH=7条件下,R的降解百分率不相等 B、其他条件相同时,溶液酸性越强,R的降解速率越大 C、其他条件相同时,R的起始浓度越小,R的降解速率越大 D、在0~5min内,pH=7条件下,R的平均降解速率为25. 温度为 , 容积为2L的恒容密闭容器中发生反应: , 反应过程中部分数据见下表:反应时间/min
0
4
2
0
5
1.5
10
2
15
1
下列说法错误的是( )
A、在0~5min内,的平均反应速率为 B、在10~15min内, C、温度为时,化学平衡常数 D、若温度升高到 , 则时化学平衡常数比时大三、非选择题
-
26. CH4-CO2重整反应[CH4(g)+CO2(g) 2CO(g)+2H2(g)-Q(Q>0)]以两种温室气体为原料生成了合成气,在“碳中和”的时代背景下,该技术受到更为广泛的关注。(1)、Ⅰ.完成下列填空:
某温度下,在体积2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,经过2min达到平衡状态时CO2的转化率为50%。此过程中以CH4表示的平均化学反应速率为。平衡常数的值为。达到平衡后,其他条件不变时向容器中充入CO2与CO各1mol,则化学平衡移动(选填“正向”“逆向”或“不”)。
(2)、Ⅱ.储能是指通过介质或设备把能量存储起来,在需要时再释放的过程。CH4-CO2重整反应也可用于高温废热的储能。800℃下,研究反应物气体流量、CH4与CO2物质的量比对CH4转化率(α)、储能效率(η)的影响,部分数据如下所示。序号
加热温度/℃
反应物气体流量/L•min-1
n(CH4)∶n(CO2)
α/%
η/%
ⅰ
700
4
2∶2
49.0
42.0
ⅱ
800
4
2∶2
79.6
52.2
ⅲ
800
6
3∶3
64.2
61.9
ⅳ
800
6
2∶4
81.1
41.6
已知储能效率η=Qchem/Qi , 其中,Qchem是通过化学反应吸收的热量,Qi是设备的加热功率。
解释为何可以用CH4-CO2重整反应进行储能。
(3)、对比实验(填序号),可得出结论:气体流量越大,CH4转化率。(4)、实验ⅳ中CH4转化率比实验ⅲ高,结合相关数据解释为何储能效率却低的原因(两次实验中设备的加热功率Qi不变)。27. 我国科学家利用Fe2Na3/红紫素催化剂实现CO2还原制备CO,利用可见光催化还原CO2 , 将CO2转化为增值化学原料(HCOOH、HCHO、CH3OH等) ,这被认为是一种可持续的CO2资源化有效途径。(1)、已知几种物质的燃烧热(ΔH)如表1所示:表1
物质
HCHO(g)
H2(g)
燃烧热(ΔH)/(kJ · mol-1)
-570. 8
-285. 8
已知:H2O(g)=H2O(l) ΔH =-44 kJ ·mol-1。
CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH =kJ·mol-1
(2)、在一定温度下,将1 mol CO2(g)和3 mol H2(g)通入某恒容密闭容器中,发生反应CO2(g)+H2(g) HCOOH(g) ,测得不同时刻容器中CO2的体积分数[φ(CO2)]如表2所示。表2
t/min
0
10
20
30
40
50
φ(CO2)
0.250
0.230
0.215
0.205
0.200
0.200
达到平衡时CO2的转化率为。
(3)、将n(CO2) : n(H2)=1 :4的混合气体充入某密闭容器中,同时发生反应1和反应2。反应1:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1= +41.2kJ·mol-1
反应2:CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH2<0。
在不同温度、压强下,测得相同时间内CO2的转化率如图1。0.1 MPa时,CO2的转化率在600 ℃之后随温度升高而增大的主要原因是 。
 (4)、在一定温度下,向容积为2 L的恒容密闭容器中充入1 mol CO2(g)和n mol H2(g) ,仅发生(3)中的反应2。实验测得CH3OH的平衡分压与起始投料比[]的关系如图2。
(4)、在一定温度下,向容积为2 L的恒容密闭容器中充入1 mol CO2(g)和n mol H2(g) ,仅发生(3)中的反应2。实验测得CH3OH的平衡分压与起始投料比[]的关系如图2。
①起始时容器内气体的总压强为8p kPa,若10 min时反应到达c点,则0~10 min内,v(H2)=mol·L-1· min-1。
②b点时反应的平衡常数Kp= (用含 p的表达式表示)(kPa)-2。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)
(5)、我国科学家开发催化剂,以惰性材料为阳极,在酸性条件下电解还原CO2制备HCHO,其阴极的电极反应式为。(6)、我国学者探究 了BiIn 合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图3所示(带“*”表示物质处于吸附态)。试从图3分析,采用BiIn合金催化剂优于单金属Bi催化剂的原因:;BiIn合金催化剂优于单金属In催化剂的原因:。 28. 2021年9月,中国科学院宣布在人工合成淀粉方面取得突破性进展,在国际上首次实现二氧化碳到淀粉的全合成,该技术未来有望促进碳中和的生物经济发展。(1)、人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示:
28. 2021年9月,中国科学院宣布在人工合成淀粉方面取得突破性进展,在国际上首次实现二氧化碳到淀粉的全合成,该技术未来有望促进碳中和的生物经济发展。(1)、人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示:
反应: 。
(2)、反应Ⅰ进行时,同时发生反应:在1L恒容密闭容器中充入和 , 一定温度下,达到平衡时, , , 物质的量分数为%。(计算结果保留1位小数)(3)、乙烯是合成工业的重要原料,一定条件下可发生反应:。①分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,经相同时间测得体积分数与温度的关系如图所示:

在催化剂甲作用下,图1中M点的速率(填“>”、“<”或“=”),根据图1所给信息,应选择的反应条件为。
②一定温度下,该反应正逆反应速率与、的浓度关系: , (、是速率常数),且或的关系如图所示,向恒容密闭容器中充入一定量 , 反应进行m分钟后达平衡,测得 , 该温度下,平衡常数K=(用含a、b的计算式表示,下同),用表示的平均反应速率为。
 29. SO2、H2S的捕捉与回收是环保研究的热点课题。(1)、天然气中H2S的捕捉原理如下:
29. SO2、H2S的捕捉与回收是环保研究的热点课题。(1)、天然气中H2S的捕捉原理如下:①NaOH(aq)+H2S(g)=NaHS(aq)+H2O(1) ΔH1=xkJ·mol-1
②Na2S(aq)+H2S(g)=2NaHS(aq) ΔH2=ykJ·mol-1
2NaOH(aq)+H2S(g)=Na2S(aq)+2H2O(l) ΔH=kJ·mol-1(用含x、y的代数式表示)。
(2)、H2S可用于制备合成除草剂的COS。已知:610K时,H2S(g)+CO2(g)COS(g)+H2O(g) ΔH=+35kJ·mol-1 , 实验测得:该反应的速率方程v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O)(k正、k逆为正、逆反应速率常数,只与温度、催化剂和固体接触面有关)。上述反应达到平衡后,升高温度,k正增大的倍数(填“大于”“小于”或“等于”,下同)k逆增大的倍数;加入催化剂,k正增大的倍数k逆增大的倍数。(3)、从废气中的SO2回收硫的原理是CH4(g)+2SO2(g)S2(g)+2H2O(g)+CO2(g)。①分别选取Fe2O3、NiO作催化剂,其他条件相同,反应相同时间时SO2的转化率随反应温度的变化如图1所示。选择Fe2O3作催化剂,最适宜温度大约为℃;选择NiO作催化剂,m点后SO2的转化率降低的原因是。
②某温度下,保持总压强为72kPa,向密闭容器中充入一定量的CH4和SO2 , 发生上述反应,测定SO2的平衡转化率与投料比[]的关系如图2所示。

该温度下。上述反应的平衡常数Kp=kPa。(提示:Kp为用气体分压计算的平衡常数,气体分压=总压×物质的量分数)
30. 工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放。(1)、O3氧化。O3氧化过程中部分反应的能量变化如图所示。
①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是。
(2)、NaClO2氧化。40 ℃时向一定量NaClO2溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。
①写出NO与ClO反应的离子方程式:。
②烟气中含有少量SO2 , 能提高NO的脱除率,可能原因是。
(3)、TiO2光催化。主要是利用TiO2光催化剂在紫外线作用下产生的高活性自由基(·OH、·O)和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。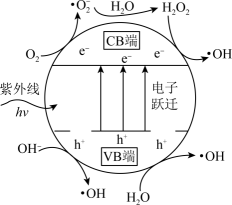
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是。
31. 高炉炼铁的基本反应之一如下:FeO(s)+CO(g)Fe(s)+CO2(g),反应的平衡常数K与温度T(单位:K)之间的关系如图所示。 (1)、1100℃时,某密闭容器中发生该反应。
(1)、1100℃时,某密闭容器中发生该反应。①能说明该反应已达平衡状态的是。
a.容器内固体质量保持不变 b.容器中气体压强保持不变
c.c(CO)=c(CO2) d.v正(CO)=v逆(CO2)
②若平衡后,保持温度不变,加入FeO后,c(CO2)将(填“增大”、“减小”或“不变”)。1100℃时K=0.263,测得高炉中c(CO2)=0.025mol•L-1、c(CO)=0.1mol•L-1 , 判断该反应是否处于平衡状态(填“是”、“否”),此时,化学反应速率是v正v逆(填“>”、“=”、“<”),其理由是。
(2)、温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比(填“增大”、“减小”或“不变”,下同),平衡常数K。指出两条提高CO的平衡转化率的措施。(3)、某实验小组在实验室模拟上述反应。一定温度下,在2L盛有FeO粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。0~5min内用CO的浓度变化表示的平均反应速率是。若将此时反应体系中的混合气体通入100mL0.60mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是。32. 含铁化合物是重要的基础材料。请问答:
(1)、已知: , 。。当时,正反应是自发的,此时的逆转温度为K。(2)、高炉炼铁中发生的基本反应之一为:①在1100℃时,K=0.263,若此时测得高炉中 , , 判断反应速率(正)(逆),理由是。
②下列说法错误的是。
A.须采用高温高压的反应条件使FeO还原为
B.粉碎FeO能增大接触面积从而提高反应速率
C.平衡时提高CO气体的分压有利于提高Fe的产量
D.加入CaCO3(s)后因分解产生CO2必使平衡逆向移动
③高炉炉体结构如图1所示,以铁矿石、焦炭、石灰石和空气为原料,由图2推测炉腹中发生的主要反应是(选填:a、b、c、d)。

④若将体积比为1:1的CO和H2混合煤气通入进风口,测得不同温度下FeO还原到后,还原剂剩余的物质的量n值如下:
还原剂
600℃
700℃
800℃
900℃
1000℃
1100℃
1200℃
H2
4.18
3.34
2.94
2.60
2.32
2.30
2.25
CO
1.66
2.50
2.90
3.24
3.52
3.54
3.59
请结合表格中的数据说明CO和H2分别还原FeO的倾向性大小是。
(3)、一定条件下,FeCl2或FeCl3都可以催化分解H2O2。总反应都是。请写出用FeCl3催化的离子方程式。①;②。33. 为应对全球气候问题、建设资源节约型、环境友好型社会,对温室气体二氧化碳的处理是化学工作者实现减排重点研究的课题。(1)、处理方案反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应1,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①请将a、b、c三点的逆反应速率va、vb、vc由大到小排序。
②在反应器中进行反应1,下列措施能提高CO2平衡转化率的是(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(2)、一种新的处理方案是用反应2:CO2(g)+2H2(g)⇌C(s)+2H2O(g)∆H代替反应1。I.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则∆H=kJ/mol。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热。)
②若要反应2自发进行,(填“高温”或“低温”)更有利。
③反应2必须在高温下才能启动,原因是。
II.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生反应2.若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如下表所示:
时间/min
0
10
20
30
40
50
60
压强
6.00P
5.60P
5.30P
5.15P
5.06P
5.00P
5.00P
①350℃时反应2的Kp=(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②反应2的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时, c2(H2O)/[c(CO2)·c2(H2)](填“>”“<”或“=”);
③反应2的lg 、lg 随温度变化的曲线如图所示,则(填“m”或“n”)表示lg 随温度变化的曲线。
 34. 汽车尾气中的NO和CO会对环境造成很大影响,我国科学家在以H2为还原剂清除NO、CO的研究方面取得了显著成果。回答下列问题:(1)、以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水可以制H2。
34. 汽车尾气中的NO和CO会对环境造成很大影响,我国科学家在以H2为还原剂清除NO、CO的研究方面取得了显著成果。回答下列问题:(1)、以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水可以制H2。已知:2H2O(l)=2H2(g)+O2(g) △H1=+571.0kJ•mol-1
2Fe3O4(s)=6FeO(s)+O2(g) △H2=+313.2kJ•mol-1
则3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H3=kJ•mol-1
(2)、H2还原NO的化学方程式为2NO(g)+2H2(g) N2(g)+2H2O(g) △H<0。①研究表明上述反应历程分两步:
Ⅰ.2NO(g)+H2(g) N2(g)+H2O2(1)(慢反应)
Ⅱ.H2O2(1)+H2(g) 2H2O(g)(快反应)
该总反应的速率由反应(填“Ⅰ”或“Ⅱ”)决定,反应Ⅰ的活化能比反应Ⅱ的活化能(填“高”或“低”)。
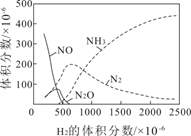
②该反应常伴有副产物N2O和NH3。以Pt作催化剂,用H2还原某废气中的NO(其他气体不反应),270℃时H2的体积分数对H2—NO反应的影响如图所示。随着H2体积分数的增大,N2的体积分数呈下降趋势,原因是。
 (3)、一定温度下,在容积恒为1L的容器中通入一定量N2O4 , 发生反应N2O4 2NO2△H<0,体系中各组分浓度随(t)的变化如表。
(3)、一定温度下,在容积恒为1L的容器中通入一定量N2O4 , 发生反应N2O4 2NO2△H<0,体系中各组分浓度随(t)的变化如表。t/s
0
20
40
60
80
c(N2O4)/(mol/L)
0.100
0.062
0.048
0.040
0.040
c(NO2)/(mol/L)
0
0.076
0.104
0.120
0.120
①0~40s,N2O4的平均反应速率为。
②反应达到平衡后再充入N2O4mol,才能使再次达到平衡时,NO2的浓度为0.24mol/L。
(4)、H2还原CO的化学方程式为CO(g)+2H2(g) CH3OH(g)△H<0,在密闭容器中,以浓度之比1:2通入CO和H2 , 反应经历相同时间,测得不同温度下CO的转化率如图所示,则160℃时,v正v逆(填“>”或“<”)。若起始时c(CO)=amol•L-1 , 则380℃时该反应的化学平衡常数K=(用含有a的式子表示)。 35. 研究氮的氧化物的性质对于消除城市中汽车尾气的污染具有重要意义。回答下列问题:(1)、 有较强的氧化性,能将 氧化成 ,自身被还原为NO,已知下列两反应过程中能量变化如图1、图2所示,则 氧化 生成 的热化学方程式为。
35. 研究氮的氧化物的性质对于消除城市中汽车尾气的污染具有重要意义。回答下列问题:(1)、 有较强的氧化性,能将 氧化成 ,自身被还原为NO,已知下列两反应过程中能量变化如图1、图2所示,则 氧化 生成 的热化学方程式为。 (2)、若将CO和NO按不同比例投入一密闭容器中发生反应: ,若反应达到平衡时,所得的混合气体中含 的体积分数随 的变化曲线如图3.
(2)、若将CO和NO按不同比例投入一密闭容器中发生反应: ,若反应达到平衡时,所得的混合气体中含 的体积分数随 的变化曲线如图3.
①a、b、c、d四点的平衡常数从小到大的顺序为。
②若 ,反应达平衡时, 的体积分数为20%,则NO的转化率为。
(3)、利用现代手持技术传感器探究压强对 平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的 气体后密封并保持活塞位置不变。分别在 、 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图4所示。
①B、E两点对应的正反应速率大小为 (填“大于”、“小于”或“等于”) 。
②E、F、G、H四点对应气体的平均相对分子质量最大的点为。
(4)、反应物分子一步直接转化为产物的反应称为基元反应,一个化学反应往往是由多个基元反应分步进行的,这个分步过程称为反应机理,机理中的快反应对整个反应速率的影响可以忽略不计。一定温度下,基元反应的化学反应速率与反应物浓度以其化学计量数的幂的连乘积成正比,如基元反应 的“速率方程”可表示为 (k为速率常数)。实验测得低温时某反应的速率方程为 ,其反应机理有如下两种可能。则该反应的化学方程式可表示为 , 以下机理中与其速率方程符合的反应机理是(填编号)。反应机理
第一步反应
第二步反应
①
(快反应)
(慢反应)
②
(慢反应)
(快反应)