高考二轮复习知识点:电解池工作原理及应用1
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 为阿伏加德罗常数的值。下列说法正确的是( )A、 , 完全反应转移的电子数为 B、用电解粗铜的方法精炼铜,当电路中通过的电子数为 时,阳极应有 转化为 C、常温下, 的 溶液中,水电离出的 数为 D、 浓度为 的 溶液中,阴离子数为2. 回收利用工业废气中的和 , 实验原理示意图如下。

下列说法不正确的是( )
A、废气中排放到大气中会形成酸雨 B、装置中溶液显碱性的原因是的水解程度大于的电离程度 C、装置中溶液的作用是吸收废气中的和 D、装置中的总反应为3. 葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
下列说法错误的是
A、溴化钠起催化和导电作用 B、每生成葡萄糖酸钙,理论上电路中转移了电子 C、葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 D、葡萄糖能发生氧化、还原、取代、加成和消去反应4. 能正确表示下列反应的离子方程式为A、新制氯水中加入少量CaCO3: 2Cl2+H2O+CaCO3=Ca2++2Cl-+CO2↑+2HClO B、硫酸铜溶液中滴入几滴氨水: Cu2++4NH3·H2O = [Cu(NH3)4]2++4H2O C、久置的H2S溶液变浑浊: 2S2-+ O2+4H+ = 2S↓+2H2O D、用铜电极电解硫酸铜溶液: 2Cu2+ +2H2O2Cu+O2↑+4H+5. 铁碳微电解技术是处理酸性废水的一种工艺,装置如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基;若上端口关闭,可得到强还原性中间体氢原子。下列说法正确的是 A、无论上端口是关闭还是打开,正极反应式均为: B、完全转化为羟基自由基时转移了电子 C、若处理含酚类的酸性废水,则上端口应关闭 D、若处理含的酸性废水,则上端口应打开并鼓入空气6. 一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中, Zn2+以存在]。电池放电时,下列叙述正确的是
A、无论上端口是关闭还是打开,正极反应式均为: B、完全转化为羟基自由基时转移了电子 C、若处理含酚类的酸性废水,则上端口应关闭 D、若处理含的酸性废水,则上端口应打开并鼓入空气6. 一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中, Zn2+以存在]。电池放电时,下列叙述正确的是 A、Ⅱ区的通过交换膜向I区迁移 B、Ⅲ区的K+通过交换膜最终向I区迁移 C、Zn电极反应:Zn+2e-+4OH-= D、电池总反应:Zn+4OH-+MnO2+4H+=+Mn2++2H2O7. 四川大学余达刚教授课题组发展了一种镍催化下用CO2制备苯乙酸的反应,反应原理如图所示。下列有关说法正确的是
A、Ⅱ区的通过交换膜向I区迁移 B、Ⅲ区的K+通过交换膜最终向I区迁移 C、Zn电极反应:Zn+2e-+4OH-= D、电池总反应:Zn+4OH-+MnO2+4H+=+Mn2++2H2O7. 四川大学余达刚教授课题组发展了一种镍催化下用CO2制备苯乙酸的反应,反应原理如图所示。下列有关说法正确的是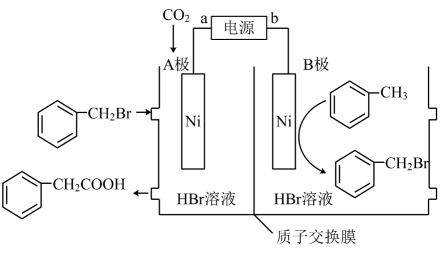 A、H+向B极移动 B、A极的电极反应式为
A、H+向B极移动 B、A极的电极反应式为 C、若使用铅蓄电池作电源,则每生成0.5mol苯乙酸,消耗49gH2SO4
D、该反应的原子利用率为100%,有利于实现碳中和
8. 利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2 , 装置如图所示。下列说法错误的是
C、若使用铅蓄电池作电源,则每生成0.5mol苯乙酸,消耗49gH2SO4
D、该反应的原子利用率为100%,有利于实现碳中和
8. 利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2 , 装置如图所示。下列说法错误的是 A、a极反应:CH4-8e-+4O2-=CO2+2H2O B、A、C膜均为阳离子交换膜,B膜为阴离子交换膜 C、阳极室有氯气产生,阴极室中有氢气产生且NaOH浓度增大 D、a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.2mol9. 使用石墨电极电解溶液,阴极产物为A、 B、Cu C、 D、10. 新型三步法氯碱工艺,具有清洁、低成本的特点,其工作原理如图所示,假定各装置中溶液体积均为(忽略反应过程中体积变化)。各步骤开始工作时,下列说法错误的是
A、a极反应:CH4-8e-+4O2-=CO2+2H2O B、A、C膜均为阳离子交换膜,B膜为阴离子交换膜 C、阳极室有氯气产生,阴极室中有氢气产生且NaOH浓度增大 D、a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.2mol9. 使用石墨电极电解溶液,阴极产物为A、 B、Cu C、 D、10. 新型三步法氯碱工艺,具有清洁、低成本的特点,其工作原理如图所示,假定各装置中溶液体积均为(忽略反应过程中体积变化)。各步骤开始工作时,下列说法错误的是 A、与传统方法相比,该方法可不需要离子交换膜 B、过程①中b极电极反应式: C、过程②外电路转移时,溶液物质的量浓度变为 D、过程③中溶液中向f极方向移动失去电子产生11. 2,5-呋喃二甲酸(FDCA)是一种重要的化工原料,可用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH- , 并在直流电场作用下分别向两极迁移。下列说法正确的是
A、与传统方法相比,该方法可不需要离子交换膜 B、过程①中b极电极反应式: C、过程②外电路转移时,溶液物质的量浓度变为 D、过程③中溶液中向f极方向移动失去电子产生11. 2,5-呋喃二甲酸(FDCA)是一种重要的化工原料,可用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH- , 并在直流电场作用下分别向两极迁移。下列说法正确的是 A、a为电源正极 B、双极膜中间层中的OH-在外电场的作用下移向铅电极 C、制得1mol FDCA,理论上消耗2 mol
A、a为电源正极 B、双极膜中间层中的OH-在外电场的作用下移向铅电极 C、制得1mol FDCA,理论上消耗2 mol D、负极区的电极反应为:
D、负极区的电极反应为: -6e-+2H2O=
-6e-+2H2O= +6H+
12. 某有色金属工业的高盐废水中主要含有、、、、和 , 利用如图电解装置可回收、并尽可能除去和 , 其中双极膜(BP)中间层的解离为和 , 并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法错误的是
+6H+
12. 某有色金属工业的高盐废水中主要含有、、、、和 , 利用如图电解装置可回收、并尽可能除去和 , 其中双极膜(BP)中间层的解离为和 , 并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法错误的是 A、BP膜中均向右侧溶液迁移,M膜为一价阴离子交换膜 B、溶液a的溶质主要为HF和HCl,溶液b的溶质主要为和 C、当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜 D、电解过程中,应控制高盐废水的pH不能过高13. 由乙烯制备2-氯乙醇(HOCH2CH2Cl)的原理为:CH2=CH2+HClO→HOCH2CH2Cl。用铂(Pt)作电极电解KCl溶液制备2-氯乙醇的装置如下图所示。下列说法错误的是( )
A、BP膜中均向右侧溶液迁移,M膜为一价阴离子交换膜 B、溶液a的溶质主要为HF和HCl,溶液b的溶质主要为和 C、当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜 D、电解过程中,应控制高盐废水的pH不能过高13. 由乙烯制备2-氯乙醇(HOCH2CH2Cl)的原理为:CH2=CH2+HClO→HOCH2CH2Cl。用铂(Pt)作电极电解KCl溶液制备2-氯乙醇的装置如下图所示。下列说法错误的是( ) A、Y连接电源的负极 B、电解时,K+通过阳离子交换膜从左侧移向右侧 C、理论上,制取1 mol 2-氯乙醇生成气体b的体积为11.2L (标准状况) 。 D、电解时,左侧溶液pH逐渐减小,右侧溶液pH逐渐增大14. Adv.Mater报道我国科学家耦合光催化/电催化分解水的装置如图,光照时,光催化电极产生电子和空穴。下列有关说法正确的是( )
A、Y连接电源的负极 B、电解时,K+通过阳离子交换膜从左侧移向右侧 C、理论上,制取1 mol 2-氯乙醇生成气体b的体积为11.2L (标准状况) 。 D、电解时,左侧溶液pH逐渐减小,右侧溶液pH逐渐增大14. Adv.Mater报道我国科学家耦合光催化/电催化分解水的装置如图,光照时,光催化电极产生电子和空穴。下列有关说法正确的是( ) A、光催化装置中溶液的减小 B、离子交换膜为阴离子交换膜 C、电催化装置阳极电极反应式: D、整套装置转移 , 光催化装置生成15. 生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用铁、石墨做电极,用电解法去除。电解时,如图1原理所示可进行除氮;翻转电源正负极,可进行除磷,原理是利用Fe2+将PO转化为Fe3(PO4)2沉淀。下列说法正确的是( )
A、光催化装置中溶液的减小 B、离子交换膜为阴离子交换膜 C、电催化装置阳极电极反应式: D、整套装置转移 , 光催化装置生成15. 生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用铁、石墨做电极,用电解法去除。电解时,如图1原理所示可进行除氮;翻转电源正负极,可进行除磷,原理是利用Fe2+将PO转化为Fe3(PO4)2沉淀。下列说法正确的是( ) A、图2中0~20min脱除的元素是氮元素,此时石墨做阴极 B、溶液pH越小、有效氯浓度越大,氮的去除率越高 C、图2中20~40min脱除的元素是磷元素,此时阳极的电极反应式为2Cl--2e-=Cl2↑ D、电解法除氮有效氯ClO-氧化NH3的离子方程式为3ClO-+2NH3=3Cl-+N2↑+3H2O16. 用氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )
A、图2中0~20min脱除的元素是氮元素,此时石墨做阴极 B、溶液pH越小、有效氯浓度越大,氮的去除率越高 C、图2中20~40min脱除的元素是磷元素,此时阳极的电极反应式为2Cl--2e-=Cl2↑ D、电解法除氮有效氯ClO-氧化NH3的离子方程式为3ClO-+2NH3=3Cl-+N2↑+3H2O16. 用氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( ) A、a极上发生氧化反应 B、b极上发生的反应为: C、d极上发生的反应为: D、铁片腐蚀速率:甲>乙
A、a极上发生氧化反应 B、b极上发生的反应为: C、d极上发生的反应为: D、铁片腐蚀速率:甲>乙二、多选题
-
17. 下列装置可分离废水中的Co2+和Ni2+。已知Ni2+和Co2+性质相似,Co2+和乙酰丙酮不反应。下列说法正确的是

 A、M电极接太阳能电池的P电极 B、通电一段时间后,I、IV室内溶液pH均减小 C、膜a、膜b分别为阳离子交换膜和阴离子交换膜 D、每生成1molSO , 理论上双极膜至少解离7molH2O18. 现有一种安全、高效的双极制氢系统,该系统能够从阳极低电压醛氧化和阴极析氢反应中得到氢气;其工作原理如图所示。下列说法正确的是( )
A、M电极接太阳能电池的P电极 B、通电一段时间后,I、IV室内溶液pH均减小 C、膜a、膜b分别为阳离子交换膜和阴离子交换膜 D、每生成1molSO , 理论上双极膜至少解离7molH2O18. 现有一种安全、高效的双极制氢系统,该系统能够从阳极低电压醛氧化和阴极析氢反应中得到氢气;其工作原理如图所示。下列说法正确的是( ) A、电压越高,阳极制氢速率越快 B、电解一段时间后,阴极室的pH不变 C、制得1mol氢气,理论上有1molOH-透过交换膜 D、阳极反应为2R-CHO+4OH--2e-=2R-COO-+H2↑+2H2O19. 应对新冠肺炎疫情时所采取的措施是对环境进行彻底消毒,二氧化氯( , 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备的原理如图所示,下列说法错误的是
A、电压越高,阳极制氢速率越快 B、电解一段时间后,阴极室的pH不变 C、制得1mol氢气,理论上有1molOH-透过交换膜 D、阳极反应为2R-CHO+4OH--2e-=2R-COO-+H2↑+2H2O19. 应对新冠肺炎疫情时所采取的措施是对环境进行彻底消毒,二氧化氯( , 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备的原理如图所示,下列说法错误的是 A、装置工作时,a与电源的正极连接,b极附近溶液pH逐渐减小 B、a极上发生的电极反应为 C、发生器内发生反应 D、当有0.3 mol阴离子通过离子交换膜时,理论上产生2.24 L(STP)20. 某工业碱性废水中含 , 利用下列装置可将其转化为FeS。下列说法正确的是
A、装置工作时,a与电源的正极连接,b极附近溶液pH逐渐减小 B、a极上发生的电极反应为 C、发生器内发生反应 D、当有0.3 mol阴离子通过离子交换膜时,理论上产生2.24 L(STP)20. 某工业碱性废水中含 , 利用下列装置可将其转化为FeS。下列说法正确的是 A、Fe棒连接电源的正极 B、b电极一定是惰性材料 C、阳极反应式为 D、气体X可能是21. 按下图装置进行电解(氯化钠足量),若乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述错误的是( )
A、Fe棒连接电源的正极 B、b电极一定是惰性材料 C、阳极反应式为 D、气体X可能是21. 按下图装置进行电解(氯化钠足量),若乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述错误的是( )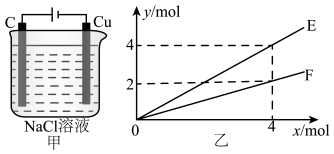 A、E表示生成金属钠的物质的量 B、E表示消耗水的物质的量 C、F表示溶解铜的物质的量 D、F表示生成氯气的物质的量
A、E表示生成金属钠的物质的量 B、E表示消耗水的物质的量 C、F表示溶解铜的物质的量 D、F表示生成氯气的物质的量三、非选择题
-
22. 尿素合成的发展体现了化学科学与技术的不断进步。(1)、十九世纪初,用氰酸银与在一定条件下反应制得 , 实现了由无机物到有机物的合成。该反应的化学方程式是 。(2)、二十世纪初,工业上以和为原料在一定温度和压强下合成尿素。反应分两步:
和生成;
分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是填序号。
活化能:反应反应
为放热反应,为吸热反应
(3)、近年研究发现,电催化和含氮物质等在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成 , 电解原理如图所示。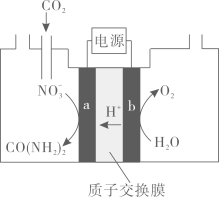
电极是电解池的极。
电解过程中生成尿素的电极反应式是。
(4)、尿素样品含氮量的测定方法如下。已知:溶液中不能直接用溶液准确滴定。

消化液中的含氮粒子是。
步骤中标准溶液的浓度和消耗的体积分别为和 , 计算样品含氮量还需要的实验数据有。
23. 超纯是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯方面取得了显著成果,工业上以粗镓为原料,制备超纯的工艺流程如下:
已知:①金属的化学性质和相似,的熔点为;
②(乙醚)和(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/
55.7
34.6
42.4
365.8
回答下列问题:
(1)、晶体的晶体类型是;(2)、“电解精炼”装置如图所示,电解池温度控制在的原因是 , 阴极的电极反应式为; (3)、“合成”工序中的产物还包括和 , 写出该反应的化学方程式:;(4)、“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是;(5)、下列说法错误的是____;A、流程中得到了循环利用 B、流程中,“合成”至“工序X”需在无水无氧的条件下进行 C、“工序X”的作用是解配 , 并蒸出 D、用核磁共振氢谱不能区分和(6)、直接分解不能制备超纯 , 而本流程采用“配体交换”工艺制备超纯的理由是;(7)、比较分子中的键角大小:(填“>”“<”或“=”),其原因是。24. 工业上常用甲烷和水蒸气催化重整制备H2 , 该工艺同时发生如下反应:
(3)、“合成”工序中的产物还包括和 , 写出该反应的化学方程式:;(4)、“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是;(5)、下列说法错误的是____;A、流程中得到了循环利用 B、流程中,“合成”至“工序X”需在无水无氧的条件下进行 C、“工序X”的作用是解配 , 并蒸出 D、用核磁共振氢谱不能区分和(6)、直接分解不能制备超纯 , 而本流程采用“配体交换”工艺制备超纯的理由是;(7)、比较分子中的键角大小:(填“>”“<”或“=”),其原因是。24. 工业上常用甲烷和水蒸气催化重整制备H2 , 该工艺同时发生如下反应:反应Ⅰ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
(1)、反应Ⅰ和反应Ⅱ以物质的量分数表示的平衡常数Kx与温度T变化关系如图甲所示,则ΔH1-ΔH20(填“>”“<”或“=”)。 (2)、恒容密闭容器中,按质量比为8:9加入CH4和H2O,下列说法正确的是____。A、达平衡时,CH4和H2O的转化率相等 B、反应Ⅰ在低温时容易自发进行 C、当压强不再发生改变时,反应Ⅰ和反应Ⅱ均达到了平衡 D、单位时间内,若有2molH-O键断裂,同时有3molH-H键断裂,则反应Ⅰ处于平衡状态(3)、某科研小组研究了反应I的动力学,获得其速率方程v正=k正·cm(CH4)·cn(H2O),k正为速率常数(只受温度影响),反应级数是反应的速率方程式中各反应物浓度的指数之和。在某温度下进行实验,测得各组分初始浓度和反应初始速率如下:
(2)、恒容密闭容器中,按质量比为8:9加入CH4和H2O,下列说法正确的是____。A、达平衡时,CH4和H2O的转化率相等 B、反应Ⅰ在低温时容易自发进行 C、当压强不再发生改变时,反应Ⅰ和反应Ⅱ均达到了平衡 D、单位时间内,若有2molH-O键断裂,同时有3molH-H键断裂,则反应Ⅰ处于平衡状态(3)、某科研小组研究了反应I的动力学,获得其速率方程v正=k正·cm(CH4)·cn(H2O),k正为速率常数(只受温度影响),反应级数是反应的速率方程式中各反应物浓度的指数之和。在某温度下进行实验,测得各组分初始浓度和反应初始速率如下:实验序号
1
2
3
CH4浓度/mol·L-1
0.1000
0.2000
0.2000
H2O浓度/mol·L-1
0.1000
0.1000
0.2000
速率/mol·L-1·s-1
3.75×10-4
1.50×10-3
3.00×10-3
若某时刻,测得c(CH4)=0.4000mol·L-1 , c(H2O)=0.4000mol·L-1 , 则此时的反应速率v正=。
(4)、在2.4MPa下,将CH4和H2O(g)按照1:3的比例通入反应器中。平衡时各组分的物质的量分数与温度的关系如图乙所示。
①600℃时,若经过tmin,反应达到平衡。该条件下,反应I的Kp=(MPa)2(列出计算式即可)。
②H2的含量在740℃左右出现峰值的原因为。
(5)、某工厂用电解原理除去H2中的杂质CH4、CO和CO2 , 其装置如图丙所示:
①CH4参与的电极反应为。
②经测定,原料气中各气体的体积分数为:
气体
H2
CH4
CO
CO2
体积分数
82%
3%
5%
10%
若电解过程中消耗了100m3的原料气,则可得到相同条件下纯净H2m3。
25. 金山银山不如绿水青山,实现碳达峰碳中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。(1)、二甲醚(CH3OCH3)被誉为“21 世纪的清洁燃料,以CO2、H2 为原料制备二甲醚涉及的主要反应如下:I.2CO2 (g) +6H2(g)CH3OCH3(g) +3H2O(g) ΔH1= - 122. 5kJ/mol
Ⅱ.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=)

其中表示平衡时CH3OCH3的选择性的曲线是(填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是。
②对于反应Ⅱ的反应速率v=v正- v逆=k 正p(CO2)·p(H2) - k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压 ×物质的量分数)。
a.降低温度,k正- k逆(填 “增大”“减小”或”不变”);
b.在一定温度和压强下的反应Ⅱ,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时 v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=。
(2)、石化工业,常采用碳酸钠溶液作为脱硫吸收剂。已知: 25℃,H2CO3 Ka1=4.5×10-7 Ka2=4.7 ×10-11; H2S Ka1=1.1 ×10-7 Ka2=1.3 ×10-13。请写出H2S与足量碳酸钠溶液反应的离子方程式:。
(3)、化工废水中常常含有以二甲胺(CH3)2NH)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
反应原理是:(i) Cl- 在阳极转化为Cl2;
(ii) Cl2在碱性溶液中歧化为ClO-;
(iii) ClO-将二甲胺氧化为N2 , 和H2O。
①写出电解池中阴极发生反应的方程式。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是。
③当阴极区收集到6.72L (标况下) H2时,阳极区收集到N2的体积(标况下)是L。
26. 为加快实现“双碳”目标,有效应对全球气候变化、构建低碳社会,CO₂资源化利用受到越来越多的关注。(1)、I.Sabatier反应可实现CO₂甲烷化:反应1 CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) ΔH=-165kJ⋅mol⁻¹
同时还发生的反应如下:
反应2 CO₂(g)+H₂(g) CO(g)+H₂O(g) ΔH=+41kJ⋅mol⁻¹
已知键能是指气态原子形成1mol化学键释放的能量,上述反应中相关的化学键键能数据如下:
化学键
O-H
C-H
C=O
H-H
键能/(kJ·mol⁻¹)
463
414
802
436
则C(g)+O(g)=CO(g) ΔH=kJ⋅mol⁻¹。
(2)、向某恒压密闭容器中充入5molCO₂和20molH₂,在不同温度下达到平衡时各含碳元素物质的物质的量n(X)与温度T的关系如下图所示。
①当反应1和反应2均达到化学平衡状态时,维持温度不变,增大容器体积,则反应2的平衡移动方向(填“正向移动”“逆向移动”或“不移动”),反应2的平衡常数(填“增大”“减小”或“不变”)。
②曲线Y表示的是(填含碳元素物质的化学式)的物质的量与温度的关系,曲线Z所表示的物质在800K~1100K之间物质的量增大的原因是。
③800K时,反应2的压强平衡常数Kp=(计算结果保留两位有效数字,用分压代替浓度,分压=物质的量分数×总压)。
(3)、 Ⅱ.一种从高炉气回收CO₂制储氢物质HCOOH的综合利用示意图如下:
铂电极上生成HCOOH的电极反应式为;电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移1mole⁻时,阴极室溶液的质量增加g(CO₂溶解量不计)[B的电解效率=]。
27. 赤泥硫酸铵焙烧浸出液水解制备偏钛酸[TiO(OH)2]可回收钛。已知:
i.一定条件下,Ti4+水解方程式:
ii.一定温度下:;
I.赤泥与硫酸铵混合制取浸出液。
(1)、用化学用语表示(NH4)2SO4溶液呈酸性的原因。II.水解制备偏钛酸:浸出液中含Fe3+、Ti4+等,先向其中加入还原铁粉,然后控制水解条件实现Ti4+水解制备偏钛酸。
(2)、浸出液(pH=2)中含有大量Ti4+ , 若杂质离子沉淀会降低钛水解率。从定量角度解释加入还原铁粉的目的。(3)、一定条件下,还原铁粉添加比对钛水解率的影响如图所示。当还原铁粉添加比大于1时,钛水解率急剧下降,解释其原因。
备注:还原铁粉添加比=;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。
(4)、一定条件下,温度对钛水解率的影响如图所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因。 (5)、III.电解制备钛:偏钛酸煅烧得到二氧化钛(TiO2),运用电化学原理在无水CaCl2熔盐电解质中电解TiO2得到海绵钛,装置如图所示。
(5)、III.电解制备钛:偏钛酸煅烧得到二氧化钛(TiO2),运用电化学原理在无水CaCl2熔盐电解质中电解TiO2得到海绵钛,装置如图所示。
电极X连接电源(填“正”或“负”)极。
(6)、写出电极Y上发生的电极反应式。28. 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研究利用和减少碳的排放。(1)、“神十三”中航天员们呼吸产生的CO2用一种循环方案处理,即CO2(g) +2H2(g) C(s)+2H2O(g) ΔH,然后电解水又得氢气和氧气。在温度为T,向一恒容密闭容器中,按物质的量之比2:1通入H2和CO2 , 测得反应过程中压强(p)随时间(t)的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强p随时间t的变化如图中b所示。
①能说明容器中的反应均已达到平衡状态的是。
A.容器内气体的平均相对分子质量不变
B. CO2和H2的转化率相等
C. H2(g)与C(s)的物质的量之比保持不变
D.v(H2)=v( H2O)
②ΔH0( 填“>”“<”或“不确定”) ;理由是。
③改变的条件是。
(2)、CO2经催化加氢可以生成低碳有机物,主要有以下反应:反应I :CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH =-49.6 kJ ·mol-1
反应II :2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH =-23.4 kJ·mol-1
反应III :2CO2(g) +6H2(g) CH3OCH3 (g) +3H2O(g)
①反应III的活化能Ea(正)Ea(逆)(填“>”“<”或“=”)。
②在T1温度下,将6molCO2和14molH2充入2L的恒容密闭容器中发生反应I和III,达到平衡状态时CH3OH( g)和CH3OCH3( g)的物质的量分别为2 mol和1 mol。则T1温度时反应I的平衡常数K=。
(3)、工业上利用废气中的CO2、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的装置使用了阳离子交换膜。
①B中发生的总反应的离子方程式为。
②若某废气中含有的CO2和CO的体积比为1:1,废气中CO2和CO体积分数共为13. 44%。假设A中处理了标准状况下10 m3的废气,其中CO2和CO全部转化成CH3OH ,理论上可制得C2H4Cl2 kg。
29. 我国力争实现2030年前碳达峰、2060年前碳中和的目标,研究碳的化合物对减少CO2在大气中累积及实现可再生能源的有效利用具有重要意义。(1)、已知CO2和H2在一定条件下能发生反应 , 反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=kJ/mol(用含Ea1和Ea2的代数式表示)。 (2)、恒温恒容条件下,为了提高反应中CO2的平衡转化率,可采取的措施为(任写一项)。下列不能说明该反应达到平衡状态的是(填字母)。
(2)、恒温恒容条件下,为了提高反应中CO2的平衡转化率,可采取的措施为(任写一项)。下列不能说明该反应达到平衡状态的是(填字母)。A.v(CO2)正=v(H2)逆
B.HCOOH的体积分数不再变化
C.混合气体的密度不再变化
D.c(CO2):c(H2):c(HCOOH)=1:1:1
(3)、一定温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2此时容器的压强为48kPa,发生反应 , 6min时达到平衡,此时容器压强为36kPa,则0~6min内用H2分压表示的化学反应速率为kPa/min。相同温度下,该反应的逆反应平衡常数Kp=kPa(Kp是平衡分压代替平衡浓度计算的平衡常数)。(4)、除合成甲酸(HCOOH)外,有科学家以CO2、H2为原料合成CH3OH达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:I.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.5kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5kJ·mol-1
不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图所示:

压强p1、P2、P3由小到大的顺序是。压强为P1时,温度高于300℃后,CO2的平衡转化率随温度升高而升高的原因是。
(5)、近年来,有研究人员用CO2通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图所示:
请写出Cu电极上产生HCOOH的电极反应式。
30. 《自然》杂志报道,科学家设计出了“空气燃料实验系统”,其过程分三步:第一步,利用太阳能收集空气中的和;
第二步,在太阳能作用下将和转化成合成气(CO、);
第三步,利用合成气合成液态烃和甲醇。
Ⅰ模拟制备合成气的装置如图1所示。
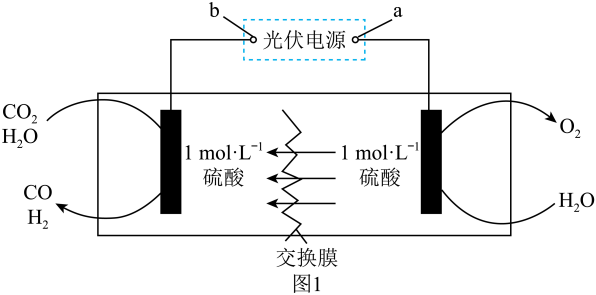
回答下列问题:
(1)、交换膜是(填“阴离子”或“阳离子”)交换膜。b极是(填“正极”或“负极”)。(2)、Ⅱ利用合成气合成甲醇:已知: , 表示的摩尔生成焓,其余类推。
时,、、的摩尔生成焓分别为、0、 , 则上述反应的。
(3)、某温度、催化剂作用下,该反应的速率方程为(k为速率常数,与温度、催化剂有关,与浓度无关)。测得速率与CO、的浓度关系如下表所示:实验
速率
Ⅰ
0.10
0.10
v
Ⅱ
0.20
0.10
2v
Ⅲ
0.20
0.20
8v
Ⅳ
0.40
x
36v
计算x=。
(4)、某温度下,向容积为的密闭容器中加入和 , 发生上述反应,CO转化率随时间的变化如图2所示:
该温度下反应的平衡常数为;若起始压强为 , 则时容器中的压强为MPa;若保持其他条件不变,起始时加入和 , 达到平衡,相应的点可能是图中A、B、C、D中的。
(5)、若只改变反应的一个条件,能使平衡体系中增大的措施有(答出一点即可)。(6)、若投料时CO与的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图3所示,图中X点的v(逆) Y点的v(正)(填“>”“<”或“=”),理由是。 31. 金属锌具有储量丰富、电池理论容量高、氧化还原电位低、对环境友好等诸多优势;锌的化合物在防腐、电镀、医学、纺织等领域有诸多应用。(1)、一种水性电解液离子选择双隔膜电池如图所示。放电结束后对左侧电极片进行紫外测试,可观测到在765nm处有一个较强的吸收峰,在615nm处有一个肩峰,与标准图像吻合。(注:可溶于水,强碱性环境下最终转化为)。
31. 金属锌具有储量丰富、电池理论容量高、氧化还原电位低、对环境友好等诸多优势;锌的化合物在防腐、电镀、医学、纺织等领域有诸多应用。(1)、一种水性电解液离子选择双隔膜电池如图所示。放电结束后对左侧电极片进行紫外测试,可观测到在765nm处有一个较强的吸收峰,在615nm处有一个肩峰,与标准图像吻合。(注:可溶于水,强碱性环境下最终转化为)。
①该电池中b膜为离子交换膜。(填“阴”或“阳”)
②该电池正极的电极反应式为;当电路中转移1mol电子时,电极质量减少g。
(2)、的浓溶液可形成配合酸 , 因此浓溶液常用作除锈剂。的溶液的酸性就相当千的酸。根据以上信息,请写出的浓溶液除铁锈的化学方程式。(3)、已知难溶于水,在强碱溶液中发生反应 , 下图是二价锌在水溶液中的存在形式与pH的关系,其中c为或浓度的值。
①。
②向的溶液中加入等体积的HCl后,体系中的Zn元素主要以(写微粒符号)形式存在。
32. 丙烯是重要的有机化工原料之一,丙烷直接脱氢制丙烯是一条绿色生产丙烯的途径。主反应:
副反应:
(1)、恒压下,主反应的随温度变化如图1所示,0(填”、“<”或=”),判断的理由是。 (2)、恒压下,在不同温度下的平衡体积分数如图2所示,图中表示的体积分数的曲线为(填“a”或“b”),时,的体积分数为。
(2)、恒压下,在不同温度下的平衡体积分数如图2所示,图中表示的体积分数的曲线为(填“a”或“b”),时,的体积分数为。 (3)、下列关于工艺说法正确的是A、的物质的量分数不再改变,反应体系已达平衡 B、采用合适的催化剂能提高主反应的平衡转化率,促使丙烯的产率提高 C、反应达到平衡后,增加压强,不变 D、升高温度,生成的速率加快,生成其他副产物的速率减慢(4)、丙烷氧化脱氢制丙烯 , 相比 , 该途径生产丙烯的好处是。(5)、用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。
(3)、下列关于工艺说法正确的是A、的物质的量分数不再改变,反应体系已达平衡 B、采用合适的催化剂能提高主反应的平衡转化率,促使丙烯的产率提高 C、反应达到平衡后,增加压强,不变 D、升高温度,生成的速率加快,生成其他副产物的速率减慢(4)、丙烷氧化脱氢制丙烯 , 相比 , 该途径生产丙烯的好处是。(5)、用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。
①Y极与电源(填“正”或“负”)极相连。
②X极的电极反应式为。
③理论上,。
33. 除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。(1)、金属除Cr(Ⅵ)法:其他条件相同时,用等量的Zn粉、Zn-Cu粉分别处理酸性含Cr(Ⅵ)废水。Cr(Ⅵ)的残留率随时间的变化如下图所示,图1中b方法选用的金属粉处理效果更快的原因是。 (2)、与熟石灰除Cr(Ⅵ)法:向酸性废水中加入 , 再加入熟石灰,使沉淀(常温下;设时沉淀完全)。
(2)、与熟石灰除Cr(Ⅵ)法:向酸性废水中加入 , 再加入熟石灰,使沉淀(常温下;设时沉淀完全)。①实验中的作用是。
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当pH>12时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为。

③为使沉淀完全,调控溶液的pH最小值为。
(3)、离子交换法除铬(Ⅵ):Cr(Ⅵ)去除率与pH关系如图所示。已知:强碱性树脂(ROH)与废水中的、离子能发生交换均生成(s)。其反应可表示为(以发生交换为例)。
①写出发生交换反应的平衡常数表达式,。
②当pH>4时,Cr(Ⅵ)去除率下降的原因是。
(4)、电解除铬(Ⅵ)法:一般采用在直流电作用下铁板做阳极和阴极[忽略Cr(Ⅵ)在阴极放电],可将酸性废水中的Cr(Ⅵ)转化为 , 再加碱沉淀为。已知:。①酸性废水中的Cr(Ⅵ)离子存在的主要形式为。
②当沉淀出2mol 时,阳极至少消耗mol Fe。
34. 镍钛钯废靶材含钛55%、镍25%、钯18%和杂质铝2%。从镍钛钯废靶材回收有关金属的工艺流程如下:
已知:I.常温下,钛与钯均不溶于盐酸。
II.PdCl在溶液中存在配位平衡:PdCl(aq)PdCl4(aq)+2Cl-(aq) △H>0
回答下列问题:
(1)、“调pH”除铝、钛时,pH对溶液中金属离子质量浓度影响如下表,根据表中数据判断除铝、钛时pH应调节至为宜。pH
溶液中金属离子质量浓度(mg·L-1)
Al3+
Ni2+
Ti4+
1.1
6100
7780
46
2.1
5960
7430
3
3.4
212
6080
1
4.2
125
5870
1
5.2
107
3720
1
(2)、“酸溶”所得溶液,经电积可得单质镍,电积沉镍装置如图所示。电积装置中,交换膜b应为离子交换膜(填“阳”或“阴”)。电解时浓缩室溶液体积保持不变,当浓缩室得到1L 0.6mol·L-1的盐酸时,阴极得到Ni的质量小于14.75g,其原因为。 (3)、“氧化浸出”时,钯(Pd)被氧化生成配位离子PdCl的离子方程式为。(4)、“沉钯”时,温度保持在55~65℃,温度不易过高,其原因除防止铵盐分解外,还有。“沉钯”时,铵盐最好选用(填化学式),有利于钯的沉淀。(5)、氯钯酸铵[(NH4)2PdCl6]在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在操作中循环使用(填操作单元名称)。35. 铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:(1)、基态Cu原子价层电子排布式为。(2)、晶体中S原子的杂化方式为 , 的立体构型为。(3)、向溶液中加入过量氨水,可生成 , 其配体的电子式为;下列有关说法正确的是。
(3)、“氧化浸出”时,钯(Pd)被氧化生成配位离子PdCl的离子方程式为。(4)、“沉钯”时,温度保持在55~65℃,温度不易过高,其原因除防止铵盐分解外,还有。“沉钯”时,铵盐最好选用(填化学式),有利于钯的沉淀。(5)、氯钯酸铵[(NH4)2PdCl6]在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在操作中循环使用(填操作单元名称)。35. 铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:(1)、基态Cu原子价层电子排布式为。(2)、晶体中S原子的杂化方式为 , 的立体构型为。(3)、向溶液中加入过量氨水,可生成 , 其配体的电子式为;下列有关说法正确的是。A.氨气极易溶于水,原因之一是分子和分子之间形成氢键
B.分子和分子空间构型不同,氨分子的键角小于水分子的键角
C.所含有的化学键有离子键、极性共价键和配位键
D.组成元素中电负性最大的是氮元素
(4)、金铜合金的一种晶体结构为立方晶型,如图所示:
①该合金的化学式为。
②已知该合金的密度为 , 阿伏加德罗常数值为NA , 则该晶胞的棱长为cm。
(5)、以情性电极电解足量的溶液。阳极上的电极反应式为: , 若该电极产生气体的物质的量为0.01mol,则析出铜的质量为g。