高考二轮复习知识点:铁的吸氧腐蚀
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列图示装置不能达到实验目的的是( )
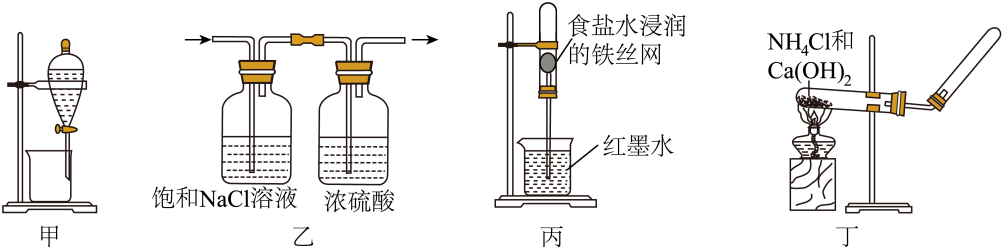 A、装置甲用CCl4萃取溴水中的Br2 B、装置乙除去Cl2中的HCl并干燥 C、装置丙验证铁的吸氧腐蚀 D、装置丁实验室制备少量NH32. 下列实验装置(部分夹持装置略)或现象错误的是( )
A、装置甲用CCl4萃取溴水中的Br2 B、装置乙除去Cl2中的HCl并干燥 C、装置丙验证铁的吸氧腐蚀 D、装置丁实验室制备少量NH32. 下列实验装置(部分夹持装置略)或现象错误的是( )


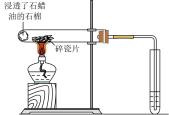
A.滴入酚酞溶液
B.吸氧腐蚀
C.钠的燃烧
D.石蜡油的热分解
A、A B、B C、C D、D3. 下列说法错误的是( )A、 会破坏铝表面的氧化膜 B、 的热稳定性比 强 C、 具有氧化性,其稀溶液可用于消毒 D、钢铁在潮湿空气中生锈主要是发生了电化学腐蚀4. 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( ) A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀5. 利用下列装置(夹持部分略)和试剂进行实验,能达到实验目的的是A、
A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀5. 利用下列装置(夹持部分略)和试剂进行实验,能达到实验目的的是A、 制备SO2
B、
制备SO2
B、 制备并收集少量NO
C、
制备并收集少量NO
C、 配制NaCl溶液
D、
配制NaCl溶液
D、 观察铁的析氢腐蚀
6. 下列实验操作能够达到目的的是
观察铁的析氢腐蚀
6. 下列实验操作能够达到目的的是



A.验证铁钉的吸氧腐蚀
B.比较和对的催化效果
C.测定中和反应的反应热
D.用酸性高锰酸钾溶液滴定硫酸亚铁溶液
A、A B、B C、C D、D7. 如图实验,一段时间后,玻璃管口有气泡产生,下列说法正确的是( ) A、铁电极反应式为Fe-3e→ Fe3+ B、铁腐蚀过程中化学能转化为电能和热能 C、活性炭的存在可以减缓铁的腐蚀 D、铁发生析氢腐蚀8. 如图装置进行实验,向小试管中加入稀盐酸。观察到U形管内两边红墨水液面逐渐变为左低右高,与此现象有关的推论是( )
A、铁电极反应式为Fe-3e→ Fe3+ B、铁腐蚀过程中化学能转化为电能和热能 C、活性炭的存在可以减缓铁的腐蚀 D、铁发生析氢腐蚀8. 如图装置进行实验,向小试管中加入稀盐酸。观察到U形管内两边红墨水液面逐渐变为左低右高,与此现象有关的推论是( ) A、反应物总能量低于生成物 B、发生了析氢腐蚀,产生较多气体 C、生成物中化学键形成会放出能量 D、锥形瓶内气体分子间平均距离变大9. 下列实验操作正确且能达到实验目的的是( )
A、反应物总能量低于生成物 B、发生了析氢腐蚀,产生较多气体 C、生成物中化学键形成会放出能量 D、锥形瓶内气体分子间平均距离变大9. 下列实验操作正确且能达到实验目的的是( )选项
操作
目的
A
将MgCl2溶液加热蒸干
由MgCl2溶液制备无水MgCl2
B
将铁钉放入试管中,用盐酸浸没
验证铁的吸氧腐蚀
C
称取KMnO4固体0.3160g,放入100mL容量瓶中,加水溶解并稀释至刻度
配制浓度为0.0200的KMnO4溶液
D
先从分液漏斗下口放出有机层,后从上口倒出水层
CCl4萃取分离碘水中的I2
A、A B、B C、C D、D10. “辛勤的劳动才能创造美好的生活”。下列生产活动中,没有运用相应化学原理的是( )选项
生产活动
化学原理
A
古代科技:我国古代湿法炼铜
发生置换反应
B
现代建筑:港珠溴大桥的钢铁护栏涂刷防锈漆
钢铁与潮湿空气隔绝可防止腐蚀
C
科学研究:屠呦呦从青蒿中提取青蒿素
主要利用蒸馏原理
D
民间艺术:五颜六色的烟花
金属和金属离子的焰色反应
A、A B、B C、C D、D11. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( ) A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大12. 根据下列实验操作和现象所得结论正确的是( )
A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大12. 根据下列实验操作和现象所得结论正确的是( )选项
实验操作和现象
结论
A
在一块已除锈的铁片上滴1滴含有酚酞的食盐水,静置2~3min,溶液边缘出现红色
铁片上发生了吸氧腐蚀
B
向pH=3的醋酸溶液中,加入少量醋酸铵固体,溶液pH增大
醋酸铵溶液呈碱性
C
用蘸有浓氨水的玻璃棒靠近试剂瓶瓶口,试剂瓶瓶口有白烟生成
该试剂瓶中盛装的是浓盐酸
D
将大理石与稀盐酸反应得到的气体直接通入足量澄清石灰水中,澄清石灰水变浑浊
Cl的非金属性比C的强
A、A B、B C、C D、D13. 下列事实与电化学无关的是( )



A.暖宝宝(含铁粉、碳、氯化钠等)发热
B.海沙比河沙混凝土更易使钢筋生锈
C.家用铁锅生锈
D.铁罐运输浓硫酸
A、A B、B C、C D、D14. 下列化学用语或模型正确的是( )A、在潮湿的中性环境中,钢铁吸氧腐蚀的负极反应为: B、CH4 分子的比例模型: C、结构示意图为
C、结构示意图为  的原子,可表示为 或
D、H2O2的电子式:
的原子,可表示为 或
D、H2O2的电子式:  15. 有关电化学原理的推断正确的是( )A、金属腐蚀就是金属原子失去电子被还原的过程 B、钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-=4OH- C、氯碱工业中,阳极发生的反应为:2Cl-–2e-=Cl2↑ D、镀锌铁皮的镀层部分损坏后,铁更容易腐蚀16. 下列有关电化学装置不能达到相应实验目的的是( )A、
15. 有关电化学原理的推断正确的是( )A、金属腐蚀就是金属原子失去电子被还原的过程 B、钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-=4OH- C、氯碱工业中,阳极发生的反应为:2Cl-–2e-=Cl2↑ D、镀锌铁皮的镀层部分损坏后,铁更容易腐蚀16. 下列有关电化学装置不能达到相应实验目的的是( )A、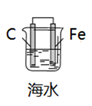 模拟吸氧腐蚀
B、
模拟吸氧腐蚀
B、 电解法制氯气
C、
电解法制氯气
C、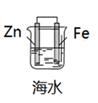 铁的防护
D、
铁的防护
D、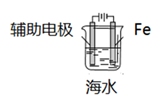 外加电流的阴极保护法
17. 下列图示方法能完成相应实验的是( )
外加电流的阴极保护法
17. 下列图示方法能完成相应实验的是( )
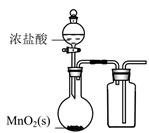

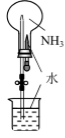
A.配制一定物质的量浓度的NaOH溶液
B.实验室制取Cl2
C.验证铁的析氢腐蚀
D.验证氨气易溶于水
A、A B、B C、C D、D18. 巧妙的实验设计有助于更好地解决问题。下列装置能达到实验目的的是( ) A、比较Na2CO3、NaHCO3的热稳定性 B、用装置乙验证SO2具有漂白性 C、用装置丙判断铁钉发生的是析氢腐蚀还是吸氧腐蚀 D、用装置丁检验NH4Cl分解产生的气体19. 化学与生活、环境密切相关,下列说法错误的是( )A、补铁剂与维生素C共同服用可提高补铁效果 B、铁粉和碳粉的混合物可作食品抗氧化剂 C、生活中钢铁制品生锈主要是析氢腐蚀所致 D、新能源汽车的推广使用有助于减少光化学烟雾20. 利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
A、比较Na2CO3、NaHCO3的热稳定性 B、用装置乙验证SO2具有漂白性 C、用装置丙判断铁钉发生的是析氢腐蚀还是吸氧腐蚀 D、用装置丁检验NH4Cl分解产生的气体19. 化学与生活、环境密切相关,下列说法错误的是( )A、补铁剂与维生素C共同服用可提高补铁效果 B、铁粉和碳粉的混合物可作食品抗氧化剂 C、生活中钢铁制品生锈主要是析氢腐蚀所致 D、新能源汽车的推广使用有助于减少光化学烟雾20. 利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
下列说法错误的是( )
A、上述正极反应均为O2+4e-+2H2O=4OH- B、在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素 C、向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快 D、在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液21. 有关远洋轮船船壳腐蚀与防护叙述错误的是( )A、可在船壳外刷油漆进行保护 B、可将船壳与电源的正极相连进行保护 C、可在船底安装锌块进行保护 D、在海上航行时,船壳主要发生吸氧腐蚀22. 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 B、含2.24g铁粉的脱氧剂,理论上最多能吸收氧气672mL(标准状况) C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4 e﹣=4OH﹣ D、脱氧过程中铁作原电池正极,电极反应为:Fe﹣2e﹣=Fe2+23. 下列实验操作或装置能达到实验目的的是 A、用装置甲探究、对分解速率的影响 B、用装置乙蒸干溶液制备无水固体 C、用装置丙制备并能较长时间观察其颜色 D、用装置丁釆集到的压强数据判断铁钉发生吸氧腐蚀还是析氢腐蚀24. 如图,拴上金属条的铁钉插在含有酚酞的 NaCl 溶液中,可以看到在贴近金属条一边的 溶液出现粉红色。该金属条可能是
A、用装置甲探究、对分解速率的影响 B、用装置乙蒸干溶液制备无水固体 C、用装置丙制备并能较长时间观察其颜色 D、用装置丁釆集到的压强数据判断铁钉发生吸氧腐蚀还是析氢腐蚀24. 如图,拴上金属条的铁钉插在含有酚酞的 NaCl 溶液中,可以看到在贴近金属条一边的 溶液出现粉红色。该金属条可能是 A、铜 B、铁 C、铝 D、锌25. 保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中错误的是A、铁栅栏上涂上油漆 B、铁闸与直流电源正极相连 C、轮船底部焊接镁块 D、家用铁锅水洗后及时擦干26. 如图所示,各烧杯中均盛有海水,铁在其中的腐蚀速率由快到慢的顺序为
A、铜 B、铁 C、铝 D、锌25. 保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中错误的是A、铁栅栏上涂上油漆 B、铁闸与直流电源正极相连 C、轮船底部焊接镁块 D、家用铁锅水洗后及时擦干26. 如图所示,各烧杯中均盛有海水,铁在其中的腐蚀速率由快到慢的顺序为 A、②>①>③>④>⑤>⑥ B、⑤>④>③>①>②>⑥ C、⑤>④>②>①>③>⑥ D、⑤>③>②>④>①>⑥27. 实验小组研究金属电化学腐蚀,实验如下:
A、②>①>③>④>⑤>⑥ B、⑤>④>③>①>②>⑥ C、⑤>④>②>①>③>⑥ D、⑤>③>②>④>①>⑥27. 实验小组研究金属电化学腐蚀,实验如下:序号
实验
实验Ⅰ

铁钉表面及周边未见明显变化
铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成
实验Ⅱ

铁钉周边出现红色区域,未见蓝色出现
锌片周边未见明显变化
铁钉周边红色加深,区域变大,未见蓝色出现
锌片周边未见明显变化
下列说法错误的是
A、实验Ⅰ中铁钉发生了吸氧腐蚀 B、实验Ⅱ中锌片未发生反应 C、实验Ⅱ中正极的电极反应式: D、若将片换成片,推测片周边会出现红色,铁钉周边会出现蓝色28. 用如下装置进行铁的电化学腐蚀实验。下列说法正确的是
一段时间后,左侧试管发热,导管口有气泡产生。
A、铁发生的电极反应: B、铁腐蚀过程中,化学能转化为热能 C、炭粉的存在对铁腐蚀的速率无影响 D、导管口产生气泡证明铁发生了析氢腐蚀29. 对下列图示实验的描述正确的是 A、根据两烧瓶中气体颜色的变化判断正反应是吸热反应 B、用已知浓度的NaOH溶液滴定锥形瓶中未知浓度的盐酸 C、根据小试管中导气管内液面的变化判断铁钉发生吸氧腐蚀 D、向镀件上镀银30. 下列实验不能达到实验目的的是
A、根据两烧瓶中气体颜色的变化判断正反应是吸热反应 B、用已知浓度的NaOH溶液滴定锥形瓶中未知浓度的盐酸 C、根据小试管中导气管内液面的变化判断铁钉发生吸氧腐蚀 D、向镀件上镀银30. 下列实验不能达到实验目的的是A.铁上电镀铜
B.证明温度对平衡的影响


C.研究酸碱性对平衡移动的影响
D.验证铁发生吸氧腐蚀

 A、A B、B C、C D、D31. 常温下,某小组探究不同溶液中钢铁的腐蚀,结果如下。下列说法错误的是
A、A B、B C、C D、D31. 常温下,某小组探究不同溶液中钢铁的腐蚀,结果如下。下列说法错误的是溶液
腐蚀快慢
较快
慢
慢
较快
主要产物
A、在溶液中,主要发生的是析氢腐蚀 B、在溶液中,发生腐蚀时正极反应为: C、由实验可知,溶液碱性越强,钢铁腐蚀越困难 D、钢铁腐蚀的产物受到溶液酸碱性的影响32. 中性环境微生物介导的铁循环过程,是纷繁复杂的土壤物质循环过程的重要部分(见图)。下列说法正确的是 A、此环境下主要发生析氢腐蚀 B、硝酸根依赖的(Ⅱ)氧化过程,每生成氮气转移电子 C、分解产生 D、羟基氧化铁有氧化性33. 实验是学习化学的重要途径。下列所示装置或操作能达到实验目的的是( )
A、此环境下主要发生析氢腐蚀 B、硝酸根依赖的(Ⅱ)氧化过程,每生成氮气转移电子 C、分解产生 D、羟基氧化铁有氧化性33. 实验是学习化学的重要途径。下列所示装置或操作能达到实验目的的是( )A
B
C
D

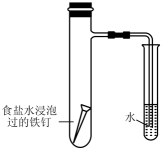

测定未知溶液的浓度
探究铁的析氢腐蚀
配制0.10 mol/L NaOH溶液
中和热的测定
A、A B、B C、C D、D34. 在表面无锈的铁片上滴食盐水,一段时间后有铁锈出现。此过程反应为:2Fe+2H2O+O2=2Fe(OH)2 , Fe(OH)2进一步被氧气氧化为Fe(OH)3 , 再在一定条件下脱水生成铁锈,其原理如图。下列说法不正确的是( ) A、铁片发生氧化反应而被腐蚀 B、铁片腐蚀最严重区域应该是生锈最多的区域 C、铁片腐蚀中正极发生的电极反应:2H2O+O2+4e-=4OH- D、铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
A、铁片发生氧化反应而被腐蚀 B、铁片腐蚀最严重区域应该是生锈最多的区域 C、铁片腐蚀中正极发生的电极反应:2H2O+O2+4e-=4OH- D、铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀二、非选择题
-
35. 铁及其化合物在生产和生活中具有广泛的用途。请回答下列问题。(1)、铁制品暴露在潮湿空气中容易发生腐蚀,通过图甲所示装置可验证铁钉是否发生电化学腐蚀,正极反应式是。
 (2)、利用图乙装置可模拟工业生产高铁酸盐,阳极反应为 , 阴极区的溶液(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为 , 放电时每转移电子,正极有被还原。
(2)、利用图乙装置可模拟工业生产高铁酸盐,阳极反应为 , 阴极区的溶液(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为 , 放电时每转移电子,正极有被还原。