高考二轮复习知识点:金属的电化学腐蚀与防护2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列叙述错误的是( )A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 D、铁管上镶嵌锌块,铁管不易被腐蚀2. 利用如图装置探究铁在海水中的电化学防护,下列说法错误的是
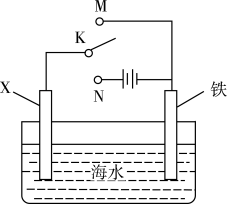 A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,海水降低 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,碳棒上发生氧化反应3. 化学与社会、生活、生产密切相关,下列有关说法正确的是( )A、漂白粉可用于游泳池杀菌消毒 B、菜刀洗净后擦干主要是为了防止发生化学腐蚀 C、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 D、区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察是否变蓝4. “外加电流法”和“牺牲阳极法”均可有效防止铁发生电化学腐蚀。下列说法不正确的是( )A、铁发生电化学腐蚀的原因是在其表面形成了原电池 B、利用“外加电流法”时,铁连接电源负极 C、“牺牲阳极法”利用了电解池原理 D、两种保护法中都要采用辅助阳极5. 化学与社会、生产和生活密切相关。下列说法不正确的是( )A、研究高效合成氨有利于提高粮食产量 B、大量鲜花的香味主要来自酯的混合物 C、液化石油气是一种可再生的清洁能源 D、采用喷涂油漆法可以防止钢铁的腐蚀6. 我国学者进行了如下模拟实验:将甲、乙两片相同的低合金钢片用导线连接插入海水中,钢片甲附近通入氧气,钢片乙附近通入氮气。研究表明钢片乙的腐蚀速率明显高于钢片甲,下列说法不正确的是( )A、钢片甲作正极 B、氮气在钢片乙上得电子 C、在海水中阳离子向钢片甲移动 D、能产生电流的主要原因是两极上氧气浓度不同7. 在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )A、锌块作原电池的负极 B、钢铁在海水中易发生吸氧腐蚀 C、电子由船体钢铁外壳向锌块移动 D、在海水中阳离子向船体钢铁外壳移动8. 美好生活离不开化学。下列人类活动中,运用了相应的化学原理的是( )
A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,海水降低 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,碳棒上发生氧化反应3. 化学与社会、生活、生产密切相关,下列有关说法正确的是( )A、漂白粉可用于游泳池杀菌消毒 B、菜刀洗净后擦干主要是为了防止发生化学腐蚀 C、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 D、区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察是否变蓝4. “外加电流法”和“牺牲阳极法”均可有效防止铁发生电化学腐蚀。下列说法不正确的是( )A、铁发生电化学腐蚀的原因是在其表面形成了原电池 B、利用“外加电流法”时,铁连接电源负极 C、“牺牲阳极法”利用了电解池原理 D、两种保护法中都要采用辅助阳极5. 化学与社会、生产和生活密切相关。下列说法不正确的是( )A、研究高效合成氨有利于提高粮食产量 B、大量鲜花的香味主要来自酯的混合物 C、液化石油气是一种可再生的清洁能源 D、采用喷涂油漆法可以防止钢铁的腐蚀6. 我国学者进行了如下模拟实验:将甲、乙两片相同的低合金钢片用导线连接插入海水中,钢片甲附近通入氧气,钢片乙附近通入氮气。研究表明钢片乙的腐蚀速率明显高于钢片甲,下列说法不正确的是( )A、钢片甲作正极 B、氮气在钢片乙上得电子 C、在海水中阳离子向钢片甲移动 D、能产生电流的主要原因是两极上氧气浓度不同7. 在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )A、锌块作原电池的负极 B、钢铁在海水中易发生吸氧腐蚀 C、电子由船体钢铁外壳向锌块移动 D、在海水中阳离子向船体钢铁外壳移动8. 美好生活离不开化学。下列人类活动中,运用了相应的化学原理的是( )选项
人类活动
化学原理
A
NH4Cl溶液除铁锈
NH水解呈酸性
B
游轮底部定期更换锌块
利用电解原理可防止腐蚀
C
铝罐贮运浓硝酸
铝具有良好导热性
D
NH4HCO3可用作氮肥
NH4HCO3受热易分解
A、A B、B C、C D、D9. 镀锌铁皮可用于制备七水合硫酸锌(ZnSO4 7H2O),其流程如图。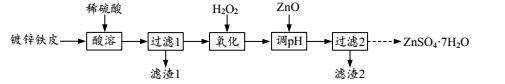
下列有关说法正确的是( )
A、镀锌铁皮的镀层被破坏后铁的腐蚀比生铁快 B、“氧化”发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O C、“调pH”后所得溶液中大量存在的离子有Zn2+、SO 、Fe3+、H+ D、从“过滤2”所得滤液中获取晶体的操作为:蒸发滤液至有大量晶体出现时停止加热,利用余热将液体蒸干10. 化学与生活密切相关,下列说法错误的是( )A、利用 、 和 的强氧化性进行消毒 B、电热水器用镁棒防止铁质内胆腐蚀,原理是牺牲阳极的阴极保护法 C、某品牌运动服材料的主要成分聚氨酯,属于有机高分子化合物 D、实施“煤改气”等清洁燃料改造工程,有利于保护环境11. 下列实验设计能达到相应实验目的的是( )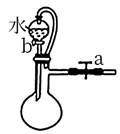
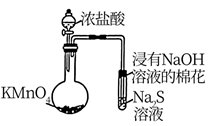
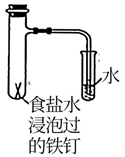
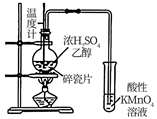
A.关闭a,打开b,可检验装置的气密性
B.比较KMnO4、Cl2、S的氧化性强弱
C.验证铁钉能发生析氢腐蚀
D.检验乙醇消去反应的产物乙烯
A、A B、B C、C D、D12. 下列说法错误的是( )A、溶质的溶解度越大,析出速度越慢,越有可能得到颗粒较大的晶体 B、亚硝酸钠与碘化钾反应生成的碘可使淀粉溶液变蓝色,据此可以检验亚硝酸根的存在 C、镀锌铁皮酸浸过程中,可根据产生气体速度显著减慢这一现象来判定锌镀层已反应完全 D、实验时意外受溴腐蚀可用大量的浓氢氧化钠溶液清洗伤口13. 下列说法正确的是( )A、麒麟9905G芯片己正式发布,其主要成分为SiO2 B、碳酸钠能与盐酸反应,可用于治疗胃酸过多 C、在船身上装有锌块,是利用了牺牲阳极的阴极保护法保护船体 D、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒14. 下列有关实验说法中,错误的是( )A、利用纸层析法分离Fe3+、Cu2+时,氨熏显色后上方出现红棕色斑点,下方出现深蓝色斑点 B、可用AgNO3溶液和稀HNO3区分NaCl、NaNO2和NaNO3 C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生气泡的速率显著减小时,可以判断锌镀层已反应完全 D、溶质的溶解度小,溶液的浓度高,可析出较大晶粒15. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。下列说法错误的是( )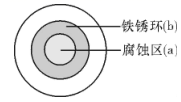 A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)316. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)316. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③
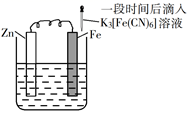
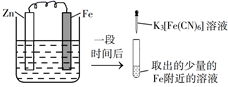
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法错误的是( )
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼17. 下列事实能用勒夏特列原理解释的是( )A、铜与浓硫酸反应需要加热 B、加热蒸干FeCl3溶液最终得到Fe(OH)3 C、使用催化剂提高合成氨的生产效率 D、钢管与铜管堆放一处,钢管更易腐蚀18. 图中实验装置正确,且能达到实验目的的是( )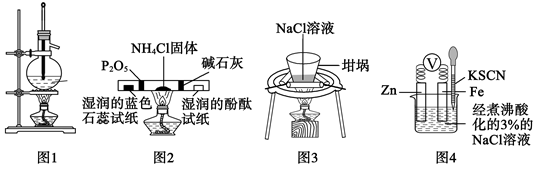 A、利用图1 装置模拟石油的分馏 B、利用图 2 装置检验 NH4Cl分解产生的两种气体 C、利用图 3 装置蒸发结晶得到食盐晶体 D、利用图 4 装置验证牺牲阳极的阴极保护法19. 化学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )A、碳酸钠可用于制作糕点的膨松剂,是因为加热能分解出二氧化碳 B、电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法 C、含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O D、高纯铝被大量用于制造火箭、导弹和飞机的外壳20. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用21. 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法错误的是( )
A、利用图1 装置模拟石油的分馏 B、利用图 2 装置检验 NH4Cl分解产生的两种气体 C、利用图 3 装置蒸发结晶得到食盐晶体 D、利用图 4 装置验证牺牲阳极的阴极保护法19. 化学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )A、碳酸钠可用于制作糕点的膨松剂,是因为加热能分解出二氧化碳 B、电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法 C、含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O D、高纯铝被大量用于制造火箭、导弹和飞机的外壳20. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用21. 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法错误的是( )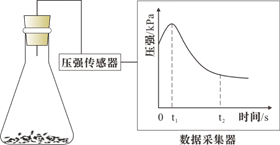 A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性
A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性二、多选题
-
22. 银器的保护主要是维持它的原貌,对于轻微腐蚀蒙有硫化银的银器,可将其和铝片一起接触浸泡在稀NaOH溶液中,经一定时间污迹消失,取出后用水洗于净,再用软布或棉团擦光.有关叙述正确的是( )A、溶液中的OH﹣离子向正极移动 B、在银表面上的反应为:Ag2S+2e﹣═2Ag+S2﹣ C、反应后容易的pH增大 D、在铝表面的反应为:Al+4OH﹣﹣3e﹣═AlO2﹣+2H2O
三、非选择题
-
23.
用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
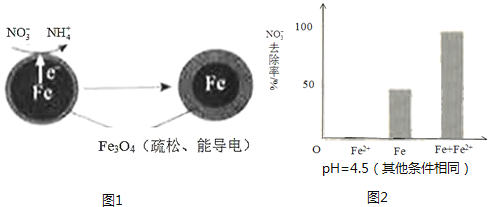 (1)、Fe还原水体中NO3﹣的反应原理如图1所示.
(1)、Fe还原水体中NO3﹣的反应原理如图1所示.①作负极的物质是 .
②正极的电极反应式是 .
(2)、将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
接近100%
<50%
24小时pH
接近中性
接近中性
铁的最终物质形态


pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)、实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)、其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
约10%
约3%
1小时pH
接近中性
接近中性
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
24. 回答下列问题:(1)、X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法错误的是A、若W是单质铁,则Z溶液可能是溶液 B、若W是氢氧化钠,则X水溶液呈酸性 C、若W是氧气,则X、Z的相对分子质量可能相差48 D、若W是强氧化性的单质,则X可能是金属铝(2)、A是一种常见的铵盐,受热分解可得到碱性气体B,C、D是常见的两种氧化物,E溶液显酸性。A、B、C、D、E是含有一种相同元素的五种化合物,在一定条件下可发生如图所示的转化。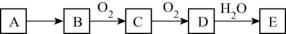
①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
(3)、电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
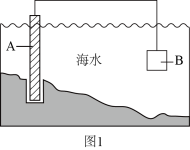
a.碳棒 b.锌板 c.铜板
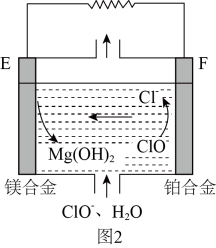
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。
 25. 回答下列问题(1)、一种锂离子电池,以LiPF6 (六氟磷酸锂)的碳酸酯溶液(无水)为电解质溶液,其中P元素在周期表中的位置是 , 写出其基态原子的价层电子的轨道表示式 , Li、P、F三种元素的基态原子的第一电离能由大到小顺序为(请填元素符号)。(2)、海港、码头的钢管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护,工作原理如图所示。钢管桩上主要发生的电极反应式为:(假设海水为氯化钠溶液,下同)。也可以在钢管桩上焊接锌块进行保护,钢管桩中的铁上主要发生的电极反应式为:。
25. 回答下列问题(1)、一种锂离子电池,以LiPF6 (六氟磷酸锂)的碳酸酯溶液(无水)为电解质溶液,其中P元素在周期表中的位置是 , 写出其基态原子的价层电子的轨道表示式 , Li、P、F三种元素的基态原子的第一电离能由大到小顺序为(请填元素符号)。(2)、海港、码头的钢管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护,工作原理如图所示。钢管桩上主要发生的电极反应式为:(假设海水为氯化钠溶液,下同)。也可以在钢管桩上焊接锌块进行保护,钢管桩中的铁上主要发生的电极反应式为:。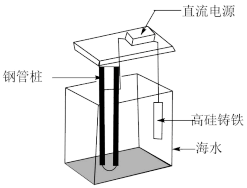 26. 回答下列问题:(1)、炒菜的铸铁锅长期不用时会因腐蚀而出现红褐色锈斑,铁锅的锈蚀主要是电化学腐蚀中的腐蚀,正极的电极反应式为。(2)、锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。一种锂离子电池构造如图所示,其中电解质溶于混合有机溶剂中,通过电解质迁移入晶格中,生成。回答下列问题:
26. 回答下列问题:(1)、炒菜的铸铁锅长期不用时会因腐蚀而出现红褐色锈斑,铁锅的锈蚀主要是电化学腐蚀中的腐蚀,正极的电极反应式为。(2)、锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。一种锂离子电池构造如图所示,其中电解质溶于混合有机溶剂中,通过电解质迁移入晶格中,生成。回答下列问题: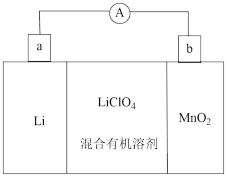
①a电极为该电池的极;
②该电池正极的电极反应式为。
(3)、许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。电有机合成反应条件温和,生产效率高。电解合成1,二氯乙烷的实验装置如图所示。回答下列问题:
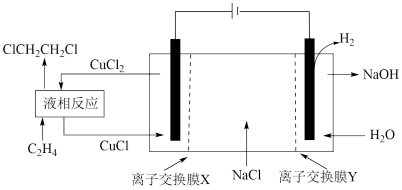
①离子交换膜X为交换膜(填“阳离子”或“阴离子”);
②阴极区的电极反应式是;
③阳极区发生的液相反应化学方程式为。
27. 完成下列各小题。(1)、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式。(2)、金属腐蚀一般可分为化学腐蚀和电化学腐蚀,炒过菜的铁锅未及时清洗容易发生腐蚀而生锈。请写出铁锅生锈过程的负极反应式:。(3)、图中甲池的总反应式为N2H4+O2=N2+2H2O。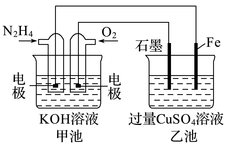
①甲池中N2H4发生的是(填“氧化反应”或“还原反应”),乙池中SO向移动(填“左”或“右”)。
②乙池中总反应的离子方程式为。
③要使乙池恢复到反应前的状态,应向溶液中加入(填化学式)。
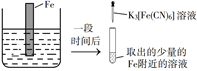
28. 某实验小组欲探究牺牲阳极法的原理,设计如图实验装置: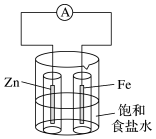 (1)、实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。
(1)、实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。锌棒上发生的电极反应为;铁棒上发生的电极反应为。
(2)、向铁棒附近滴加K3[Fe(CN)6]溶液,无明显现象,这说明该实验中无产生。(3)、实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流表连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞溶液。实验Ⅱ中电流表指针的偏转方向与实验Ⅰ(填“相同”或“相反”)。
(4)、在铁棒和铜棒附近可观察到的现象分别是、。(5)、上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对(填“活泼”或“不活泼”)的金属被保护,根据此原理采取的金属防护方法称为。29. 2020年3月22日为第 28届世界水日,化学中有很多与水相关的化学知识。(1)、海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌。(填“锌块”或“铜块”)(2)、自来水厂常用含有 Fe3+的净水剂净水,其原理是。(用离子方程式表示)(3)、自来水常用氯气杀菌消毒, ,要增大 HClO 的浓度,可以加入下列物质中的____。A、CH3COONa B、HCl C、CaCO3固体 D、H2O E、SO2(4)、常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH-)=mol·L-1。30. 按要求回答下列问题:(1)、含40.0 g NaOH的稀溶液与含24.5gH2SO4的稀硫酸反应,放出28.7kJ的热量,表示该反应中和热的热化学反应方程式。(2)、钢铁发生吸氧腐蚀的正极反应式。(3)、衡量一个体系的物理量叫做熵。(4)、甲苯和浓硝酸、浓硫酸的混合酸在100℃时反应生成TNT的化学方程式。(5)、写出如图所示高分子化合物的单体。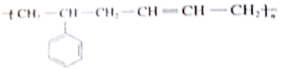 31.(1)、下列说法正确的是_______(填字母序号)。A、化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化 B、钢铁生锈腐蚀时,铁被氧化 C、放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生(2)、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气完全燃烧的热化学方程式表示为。(3)、目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。如图1表示该反应进行过程中能量的变化(单位为:kJ·mol-1),该反应是△H0(选填“>”“=”或“<”)。
31.(1)、下列说法正确的是_______(填字母序号)。A、化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化 B、钢铁生锈腐蚀时,铁被氧化 C、放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生(2)、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气完全燃烧的热化学方程式表示为。(3)、目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。如图1表示该反应进行过程中能量的变化(单位为:kJ·mol-1),该反应是△H0(选填“>”“=”或“<”)。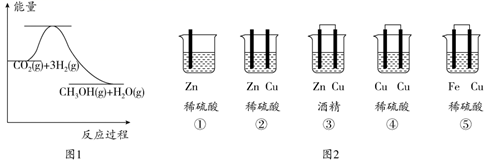 (4)、图2装置属于原电池的是(填序号)。在选出的原电池中,是负极,发生(选填“氧化”或“还原”)反应,正极的现象。此原电池反应的化学方程式为。32. 铁及其化合物是生活中常见的物质。(1)、铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作(填 “阳”或“阴”)极,铜离子向极移动,阴极的电极反应式为。(2)、下图中,为了减缓海水对铁闸门A的腐蚀,材料B可以选择(填字母序号)。
(4)、图2装置属于原电池的是(填序号)。在选出的原电池中,是负极,发生(选填“氧化”或“还原”)反应,正极的现象。此原电池反应的化学方程式为。32. 铁及其化合物是生活中常见的物质。(1)、铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作(填 “阳”或“阴”)极,铜离子向极移动,阴极的电极反应式为。(2)、下图中,为了减缓海水对铁闸门A的腐蚀,材料B可以选择(填字母序号)。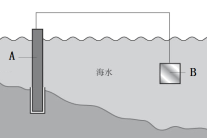
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:。
(3)、将FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为。33. 炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:(1)、铁锅的锈蚀应属于腐蚀。(2)、铁锅锈蚀的电极反应式为:负极:;正极:。正负极反应产物会继续发生反应,反应的离子方程式 , 化学方程式为。34. 电化学原理被广泛地应用于生产、生活的许多方面。(1)、I.制备氯气工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

此过程中能量转化形式为转化为(填“化学能”或“电能”)
(2)、电极乙为(填“阴极”或“阳极”),A 口生成的气体是(3)、电解饱和食盐水的离子方程式是(4)、下列有关氯气的说法中正确的是a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
(5)、II.金属防护某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)
(6)、结合电极反应式解释 i 中现象产生的原因(7)、结合以上实验,请对铁制零件的使用提出建议35. 某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)、同学们利用下表中装置进行实验并记录。装置
编号
电极A
溶液B
操作及现象
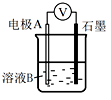
Ⅰ
Fe
pH=2的H2SO4
连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ
Cu
pH=2的H2SO4
连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
① 同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
② 针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
(2)、同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。编号
溶液B
操作及现象
Ⅲ
经煮沸的pH=2的 H2SO4
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ
pH=2的H2SO4
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ
pH=12的NaOH
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
① 丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。
36. 2018年7月至9月,国家文物局在辽宁开展水下考古,搜寻、发现并确认了甲午海战北洋水师沉舰——经远舰。已知:正常海水呈弱碱性。(1)、经远舰在海底“沉睡”124年后,钢铁制成的舰体腐蚀严重。舰体发生电化学腐蚀时,负极的电极反应式为。(2)、为了保护文物,考古队员采用“牺牲阳极的阴极保护法”对舰船进行了处理。
①下列说法错误的是。
A.锌块发生氧化反应:Zn-2e-=Zn2+
B.舰体有电子流入,可以有效减缓腐蚀
C.若通过外加电源保护舰体,应将舰体与电源正极相连
D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同
②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为。
(3)、船上有些器皿是铜制品,表面有铜锈。①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
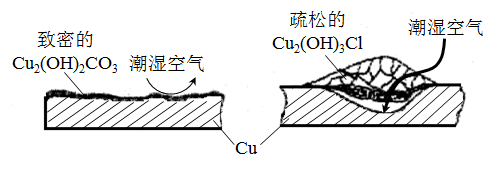
下列说法正确的是
A.疏松的Cu2(OH)3Cl属于有害锈
B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液
C.青铜器表面涂一层食盐水可以做保护层
D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”
②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为。
(4)、考古队员将舰船上的部分文物打捞出水后,采取脱盐、干燥等措施保护文物。从电化学原理的角度分析“脱盐、干燥”的防腐原理:。
-