高考二轮复习知识点:金属的电化学腐蚀与防护1
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
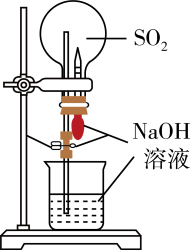
1. 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
 A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀2. 化学与生活密切相关。下列说法错误的是A、泡沫灭火器可用于一般的起火,也适用于电器起火 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法3.
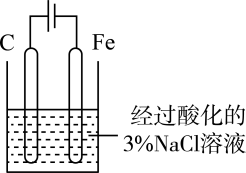
A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀2. 化学与生活密切相关。下列说法错误的是A、泡沫灭火器可用于一般的起火,也适用于电器起火 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法3.支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
 A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整4. 海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如图所示,其中高硅铸铁为惰性辅助电极)。下列有关叙述中错误的是
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整4. 海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如图所示,其中高硅铸铁为惰性辅助电极)。下列有关叙述中错误的是 A、a为负极,b为正极 B、高硅铸铁是作为损耗阳极材料发挥作用的 C、通电时,海水中的阳离子向钢制管柱电极移动 D、通电后使钢制管桩表面的腐蚀电流接近零5. 用如图示的方法可以保护钢质闸门。下列说法正确的是
A、a为负极,b为正极 B、高硅铸铁是作为损耗阳极材料发挥作用的 C、通电时,海水中的阳离子向钢制管柱电极移动 D、通电后使钢制管桩表面的腐蚀电流接近零5. 用如图示的方法可以保护钢质闸门。下列说法正确的是 A、当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 B、当a、b间用导线连接时,X可以是锌棒,电子经导线流入X C、当a、b与外接电源相连时,a应连接电源的正极 D、当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑6. 生活中的一些现象常常涉及化学知识。下列分析中错误的是A、咀嚼米饭时,越嚼越甜,因为淀粉水解生成了麦芽糖 B、向食盐浓溶液中加入鸡蛋清溶液,有白色沉淀析出,因为食盐能使蛋白质变性 C、铁锅用水清洗后,出现铁锈,因为潮湿环境中铁锅会发生电化学腐蚀 D、打开汽水瓶盖,有大量气泡冒出,因为减小压强后二氧化碳的溶解度减小7. 下列实验装置不能达到实验目的的是
A、当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 B、当a、b间用导线连接时,X可以是锌棒,电子经导线流入X C、当a、b与外接电源相连时,a应连接电源的正极 D、当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑6. 生活中的一些现象常常涉及化学知识。下列分析中错误的是A、咀嚼米饭时,越嚼越甜,因为淀粉水解生成了麦芽糖 B、向食盐浓溶液中加入鸡蛋清溶液,有白色沉淀析出,因为食盐能使蛋白质变性 C、铁锅用水清洗后,出现铁锈,因为潮湿环境中铁锅会发生电化学腐蚀 D、打开汽水瓶盖,有大量气泡冒出,因为减小压强后二氧化碳的溶解度减小7. 下列实验装置不能达到实验目的的是



A.用做SO2喷泉实验
B.探究压强对平衡的影响
C.探究生铁在不同条件下的电化学腐蚀
D.验证Cu与浓硝酸反应的热量变化
A、A B、B C、C D、D8. 利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,、、等共存物会影响修复效果。下列说法错误的是 A、反应①②③④均为还原反应 B、有效腐蚀过程中,1mol三氯乙烯完全脱氯,消耗铁1.5mol C、④的电极反应式为 D、修复过程中可能产生Fe(OH)39. 化学与生产、生活息息相关,下列说法正确的是A、75%的乙醇与84消毒液的消毒原理相同 B、钢铁在潮湿的空气中生锈主要发生电化学腐蚀 C、石油的分馏、裂化和煤的干馏都是化学变化 D、2022 年北京冬奥会比赛雪橇所使用的碳纤维材料属于有机高分子材料10. 某同学利用如图所示装置探究金属的腐蚀与防护,下列说法错误的是
A、反应①②③④均为还原反应 B、有效腐蚀过程中,1mol三氯乙烯完全脱氯,消耗铁1.5mol C、④的电极反应式为 D、修复过程中可能产生Fe(OH)39. 化学与生产、生活息息相关,下列说法正确的是A、75%的乙醇与84消毒液的消毒原理相同 B、钢铁在潮湿的空气中生锈主要发生电化学腐蚀 C、石油的分馏、裂化和煤的干馏都是化学变化 D、2022 年北京冬奥会比赛雪橇所使用的碳纤维材料属于有机高分子材料10. 某同学利用如图所示装置探究金属的腐蚀与防护,下列说法错误的是 A、③区电极电势Cu高于Fe B、①区Fe电极和③区Fe电极电极反应均为Fe-2e-=Fe2+ C、②区Zn电极和④区Cu电极电极反应均为2H2O+2e-=H2↑+2OH- D、②区Fe电极和④区Fe电极附近滴加K3[Fe(CN)6]溶液,均会出现蓝色沉淀11. 用压强传感器探究生铁分别在pH=2.0、4.0和6.0的酸性溶液中发生电化学腐蚀,得到反应体系气体压强与时间的关系如图。有关叙述错误的是
A、③区电极电势Cu高于Fe B、①区Fe电极和③区Fe电极电极反应均为Fe-2e-=Fe2+ C、②区Zn电极和④区Cu电极电极反应均为2H2O+2e-=H2↑+2OH- D、②区Fe电极和④区Fe电极附近滴加K3[Fe(CN)6]溶液,均会出现蓝色沉淀11. 用压强传感器探究生铁分别在pH=2.0、4.0和6.0的酸性溶液中发生电化学腐蚀,得到反应体系气体压强与时间的关系如图。有关叙述错误的是 A、负极的电极反应式均为: B、pH=2.0时,压强增大主要是因为产生了 C、pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀 D、pH=6.0时,正极一定会发生的电极反应为12. 劳动创造美好生活。下列关于劳动项目与所涉及的化学知识不相符的是
A、负极的电极反应式均为: B、pH=2.0时,压强增大主要是因为产生了 C、pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀 D、pH=6.0时,正极一定会发生的电极反应为12. 劳动创造美好生活。下列关于劳动项目与所涉及的化学知识不相符的是选项
劳动项目
化学知识
A
用明矾处理含有悬浮微粒的水
具有杀菌消毒作用
B
撒生石灰改良酸性土壤
生石灰能与酸性物质反应
C
将炒菜的铁锅洗净后擦干
电化学腐蚀需要电解质
D
用热的纯碱溶液去油污效果比较好
升高温度促进的水解
A、A B、B C、C D、D13. 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,设计下表实验。将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞。从胶头滴管中一次性滴入醋酸溶液,同时测量容器中的压强变化。下列说法错误的是( )
编号
实验目的
碳粉/g
铁粉/g
醋酸/
醋酸/
①
为以下实验作参照
0.5
2.0
90.0
2.0
②
醋酸浓度的影响
0.5
a
36.0
2.0
③
M
0.2
2.0
90.0
2.0
A、 B、M为“碳粉质量的影响” C、该实验一共探究了4种影响因素 D、铁发生电化学腐蚀负极反应为14. 化学在人类社会发展中发挥着重要作用,下列说法错误的是( )A、双氧水可用于处理泄漏的有毒物质 B、在钢铁设备上连接金属铜保护钢铁 C、高纯硅可用于制作通信设备的芯片 D、可用核磁共振氢谱区分苯甲醇和对甲基苯酚15. 含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是( ) A、阳极保护法中受保护的金属外接电源的负极 B、电流密度越大,金属受保护程度越好 C、CFD区,金属受到保护 D、外接电势越高,对金属保护性越有效16. 下列实验方案或操作正确且能达到实验目的的是( )
A、阳极保护法中受保护的金属外接电源的负极 B、电流密度越大,金属受保护程度越好 C、CFD区,金属受到保护 D、外接电势越高,对金属保护性越有效16. 下列实验方案或操作正确且能达到实验目的的是( )A
B
C
D

A.除去CO2中的水蒸气
B.进行喷泉实验
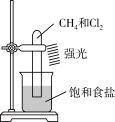
C.探究CH4与Cl2的反应
D.用铁氯化钾溶液验证牺牲阳极法保护铁
A、A B、B C、C D、D17. 下列有关金属及其化合物的应用不合理的是( )A、含有废铁屑的FeCl2溶液,可用于除去工业废气中的Cl2 B、盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 C、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 D、钢铁设施采用“牺牲阳极的阴极保护法”时,表面连接的金属一定比铁活泼18. 在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。下列说法正确的是( ) A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀19. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀19. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
下列说法错误的是( )
A、电热水器可将电能转化为热能 B、该热水器采用了牺牲阳极的电化学保护法 C、镁棒可以有效防止内部水垢生成 D、a应为出水口,b应为进水口20. 下列做法或实验(图中部分夹持装置已省略),能达到目的的是( )A
B
C
D




橡皮管能减小气体体积测量的误差
分离碘和四氯化碳的混合液
浓硫酸与萤石(主要成分为CaF2)加热制备HF
防止铁管道被腐蚀
A、A B、B C、C D、D21. 下列有关金属腐蚀的说法中正确的是( )A、银质奖牌久置后表面变暗是因为发生了电化腐蚀 B、因为二氧化碳普遍存在, 所以钢铁的电化腐蚀以析氢腐蚀为主 C、无论是析氢腐蚀还是吸氧腐蚀, 总是金属被氧化 D、钢铁吸氧腐蚀的正极反应:22. 下列叙述正确的是( )A、需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀 B、盐卤(含MgCl2)Mg(OH)2MgCl2溶液Mg C、煤的“气化”、煤的“液化”、煤的“干馏”都是化学变化 D、淀粉、蛋白质、纤维素、油脂都是高分子化合物,氨水、王水、双氧水都是混合物二、多选题
-
23. 在缺乏氧气的深层潮湿土壤中存在的硫酸盐还原菌,会附着在钢管表面促进钢铁的腐蚀,这个过程被称为厌氧腐蚀,其反应原理如图所示,下列说法正确的是( )
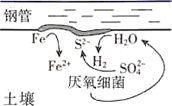 A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀24. 下列有关说法正确的是( )A、一定条件下反应2SO2+O2 2SO3达到平衡时,v(O2)正=2v(SO3)逆 B、用右图所示方法可保护钢闸门不被腐蚀
A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀24. 下列有关说法正确的是( )A、一定条件下反应2SO2+O2 2SO3达到平衡时,v(O2)正=2v(SO3)逆 B、用右图所示方法可保护钢闸门不被腐蚀 C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D、常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
25. 下列说法正确的是( )A、外加直流电源保护钢闸门时,钢闸门与电源的负极相连 B、铅蓄电池在放电过程中,负极质量增加,正极质量减少 C、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)⇌NO(g)+SO3(g),通入少量O2 , K值及SO2转化率不变
C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D、常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
25. 下列说法正确的是( )A、外加直流电源保护钢闸门时,钢闸门与电源的负极相连 B、铅蓄电池在放电过程中,负极质量增加,正极质量减少 C、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)⇌NO(g)+SO3(g),通入少量O2 , K值及SO2转化率不变三、非选择题
-
26. 某实验小组金属的电化学腐蚀实验探究(1)、完成下列问题。
实验序号
实验装置
实验方案
实验现象
实验一

将琼脂加入烧杯中,再加入饱和食盐水和水。搅拌、加热煮沸,使琼脂溶解,转入培养血中。滴入5~6滴酚酞溶液和溶液
将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。
铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀。
①请解释铜丝区域溶液变红的原因是。
②写出生成蓝色沉淀的离子方程式。
(2)、完成下列问题。实验序号
实验方案
实验现象
实验二
取饱和溶液于试管中,滴加几滴淀粉,振荡。继续滴加5~6滴溶液,振荡。
滴入溶液后,溶液变蓝色。
根据实验二的现象,推测可能具有“填氧化性或还原性”。
(3)、依据实验二的现象,甲同学认为实验一不一定能说明发生了电化学腐蚀,设计如下实验证明其结论。实验序号
实验装置
实验方案
实验现象
实验三

取煮沸过的的溶液于试管中,向试管中加入一小段铁片,再加入煤油液封。
溶液无明显变化
继续向试管中加入少许固体。
一段时间后,铁片表面产生大量的蓝
根据实验现象推出实验三的结论是:在溶液中情况下,。
(4)、结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为时,实验四的两个实验方案均可以证明发生电化学腐蚀①补全实验方案2中的空格部分
实验序号
实验装置
实验方案
实验现象
实验四

1.按图连接好装置,准确读取电流表读数。
电流表指针偏转,读数为I
2.取于试管中,加入溶液,振荡。
产生蓝色沉淀。
②思考:若电极X为时,电流表读数为 , 推测电极X为时电流表读数的范围是。
27. 铁的腐蚀与防护与生产生活密切相关。(1)、Ⅰ.研究铁的腐蚀实验步骤如下:
步骤1:将铁粉放置于0.002 溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。

第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为。
(2)、第二、三阶段主要发生吸氧腐蚀。①选取b点进行分析,经检验溶液中含有 , 写出Fe被腐蚀的总反应。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点被氧化的离子方程式。
③依据b点发生的反应,分析第二阶段pH上升的原因是。
(3)、Ⅱ.研究铁的防护在铁表面镀锌可有效防止铁被腐蚀
已知:放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的相连。
②向电解液中加入NaCN溶液,将转化为 , 电解得到的镀层更加致密、细腻,原因是。
(4)、电镀后的废水中含有 , 一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 溶液滴定,消耗溶液V mL。已知:(无色) , 。①滴定终点的现象是。
②废水中的含量是(填计算式)。
28. 过氧化氢 常被称为绿色氧化剂。(1)、 电子式是。(2)、为分析 对 分解反应的催化效果,某同学做了以下实验。实验ⅰ.向 溶液中滴加5滴 溶液,较快产生无色无味气体。
实验ⅱ.向 溶液中滴加5滴 溶液,无气体产生。
由此推断 对 分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b. 。实验ⅱ的目的是:。
(3)、硏究表明:过氧化氢溶液中 的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图1所示。

已知: ,
①一定条件下,相同时间内 分解率随溶液 增大而增大的原因是:。
②相同 下,过氧化氢浓度越大分解速率越快,但是相同时间内 分解率反而降低,分析其原因。
(4)、 常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。①酸性条件下 腐蚀金属铜的离子方程式为。
②图2是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因。
 29. 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。(1)、查阅高中教材得知铜锈为Cu2(OH)2CO3 , 俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。请写出Cu在空气中生成铜锈的方程式。(2)、继续查阅资料,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学者将铜锈分为无害锈和有害锈,结构如图所示:
29. 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。(1)、查阅高中教材得知铜锈为Cu2(OH)2CO3 , 俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。请写出Cu在空气中生成铜锈的方程式。(2)、继续查阅资料,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学者将铜锈分为无害锈和有害锈,结构如图所示:
Cu2(OH)3Cl属于(填“无害锈”和“有害锈”),请解释原因。
(3)、文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),请结合如图回答:
①过程I的正极反应物是。
②过程I负极的电极反应式是。
(4)、青铜器的修复有以下三种方法:i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl- , 能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
30. 根据所学电化学知识填空。(1)、如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
①Zn电极为电池的(填“正极”或“负极”)。
②写出电极反应式:Zn电极 , Cu电极。
③盐桥中向CuSO4溶液中迁移的离子是(填离子符号)。
(2)、金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
①图1中被腐蚀的金属为(填化学式);图2中金属腐蚀类型属于(填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是(填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为。
31. 煤焦油、煤和海砂中氯离子含量高会破坏金属的钝化膜,导致铁制设备和钢管等被腐蚀。(1)、铁接触氧气和水后会发生电化学腐蚀,其负极的电极反应式为。(2)、测定煤中氯离子含量的两种方法。方法一:在高温下,通入水蒸气将煤样中无机盐转化为HCl,再滴定氯离子。
方法二:取a g煤样,处理后得到含氯离子的样品溶液,加入溶液,以作指示剂,用溶液滴定过量的溶液,共消耗KSCN溶液。
已知:能与KSCN反应生成AgSCN沉淀。
①结合化学用语,从化学平衡的角度解释方法一中无机盐中生成HCl的原因。
②方法二中,滴定终点的现象为。
③利用方法二,测得煤样中氯元素的质量分数为。
(3)、快速检测法测定海砂中氯离子含量的过程如下。i.配制固定组分的铬酸银()浑浊液;
ii.将待测海砂样品与i中浑浊液混合,溶液的颜色会随着氯离子含量的变化而变化。
氯离子含量x
ii中现象
沉淀仍然为砖红色
砖红色沉淀部分变为白色,溶液逐渐转变为黄色
砖红色沉淀完全变为白色,溶液完全转变为黄色
已知:;;溶液为黄色,固体为砖红色。
①时,沉淀仍然为砖红色的原因是。
②写出砖红色沉淀变为白色的离子方程式。
32. 天然气是一种清洁能源,但其中大多含有、等酸性气体和水汽,会腐蚀管道设备。已知:时氢硫酸和碳酸的电离常数如下表:(1)、碳钢材质管道发生电化学腐蚀,作负极的物质是。(2)、用化学用语表示溶液显酸性的原因。(3)、溶液可以去除 , 写出反应的离子方程式。(4)、用热碱液(溶液)吸收天然气中的 , 可将其转化为可溶性的 , 反应的化学方程式为。(5)、我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除,装置如下图所示。其中电极分别为石墨烯(石墨烯包裹的)和石墨烯。
①石墨烯是极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.
ⅱ.。
③协同转化总反应的化学方程式为 , 在其中所起的作用是。
④工作时,石墨烯电极区的基本保持不变,结合化学用语解释原因。
33. 钢铁腐蚀现象在生产、生活中普遍存在,也是科学研究的关注点之一(1)、碳钢管发生电化学腐蚀是因为形成了原电池,其负极的电极反应式为。(2)、外加电流的阴极保护法是防止钢铁腐蚀的常用方法之一,该方法中,需将被保护的碳钢管与直流电源的(填“正极”或“负极”)相连。(3)、在铁制品表面镀锌可防止铁制品被腐蚀,镀锌层即使局部破损,仍可防止破损部位被腐蚀,原因是。(4)、研究人员就大气环境对碳钢腐蚀的影响进行了研究。其中,A、B两个城市的气候环境和碳钢腐蚀速率数据如下:城市
年均温度℃
年均湿度%
的浓度()
大气沉积速率()
腐蚀速率()
A
17.0
76
61
29
58
B
12.3
72
54
420
79
①研究人员认为,A、B两城市中碳钢同时发生吸氧腐蚀和析氢腐蚀。碳钢发生析氢腐蚀时,正极的电极反应式为。
②结合化学用语解释A、B两城市中碳钢能发生析氢腐蚀的原因:。
③用电化学原理分析B城市碳钢腐蚀速率高于A城市的主要原因:。
34. 我们周围很多物品是由各种各样的材料做成的,金属、陶瓷和塑料是生活中最常用的材料。(1)、氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定,根据上述性质推测氮化硅陶瓷的用途是(填字母)。A.制汽轮机叶片 B.制包装材料 C.制人造骨骼 D.制柴油机
现用四氯化硅和氮气在氢气气氛的保护下,加强热发生反应,可获得较高纯度的氮化硅,同时生成一种酸,反应的化学方程式为。
(2)、“白口铁”(铁外面镀一层锌)和“马口铁”(铁外面镀一层锡)是日常生活中两种常见的铁制品,以下为两种铁制品的腐蚀情况:
请分别写出A、B两种铁制品的名称及腐蚀时负极的电极反应式:
A: , 负极:。
B: , 负极:。
(3)、目前我国建筑节能(建筑保温)领域中用于建筑物外墙保温材料主要是聚苯板,用它作外墙材料符合低碳生活。以下为聚苯板基础材料的结构片段:
用于合成聚苯板基础材料的有机小分子(单体)是(填结构简式),该合成反应的反应类型为。
35. 铁的腐蚀和防护与生产生活密切相关。已知:氢氧化物沉淀的如下表(开始沉淀时金属离子浓度为)。沉淀物
开始沉淀
1.1
5.8
5.9
完全沉淀
3.2
8.8
8.0
(1)、研究铁的腐蚀。将一定量铁粉和碳粉混合后置于一密闭容器中,加入和盐酸的混合溶液。测得溶液和压强随时间变化的曲线如所示。
①容器内压强先增大后减小,除温度影响外的原因是。
②反应过程中,混合液里先期生成的会被氧化生成 , 反应的离子方程式为。
③后略下降,原因是。
(2)、研究铁的防护。①在铁表面镀锌可有效防止铁被腐蚀。
已知:镀层金属析出缓慢、平稳时,镀层致密、细腻;溶液中与可发生反应:。以通入一定量的溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是。
②镀锌废液的回收。镀锌废液中含有等阳离子。请设计利用该电镀废液回收溶液的实验方案:。(实验中可选用试剂:、溶液、氨水)