高考二轮复习知识点:常见化学电源的种类及其工作原理
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. Mg﹣AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )A、负极反应式为Mg﹣2e﹣=Mg2+ B、正极反应式为Ag++e﹣=Ag C、电池放电时Cl﹣由正极向负极迁移 D、负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑2. 某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1﹣xCoO2+LixC6═LiCoO2+C6(x<1),下列关于该电池的说法不正确的是( )A、放电时,Li+在电解质中由负极向正极迁移 B、放电时,负极的电极反应式为LixC6﹣xe﹣═xLi++C6 C、充电时,若转移1mol e﹣ , 石墨(C6)电极将增重7x g D、充电时,阳极的电极反应式为LiCoO2﹣xe﹣═Li1﹣xCoO2+xLi+3. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。下列说法正确的是( )
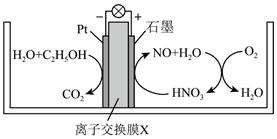 A、离子交换膜X为质子交换膜,质子从石墨电极移向Pt电极 B、C2H5OH在Pt电极发生还原反应 C、正极区反应为4 +12e-+16H+=4NO+8H2O、4NO+3O2+2H2O=4HNO3 D、若Pt电极生成2.24LCO2 , 电路中转移电子数为0.6NA4. 四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法错误的是( )
A、离子交换膜X为质子交换膜,质子从石墨电极移向Pt电极 B、C2H5OH在Pt电极发生还原反应 C、正极区反应为4 +12e-+16H+=4NO+8H2O、4NO+3O2+2H2O=4HNO3 D、若Pt电极生成2.24LCO2 , 电路中转移电子数为0.6NA4. 四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法错误的是( ) A、工作时原料室(CH3)4N+向II室迁移 B、Ⅰ室可得到H2和CO2 C、当外电路中有1mol电子通过时,理论上能生成1mol(CH3)4NOH D、电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑5. 一种可充电的锌锰分液电池,其结构如下图所示:
A、工作时原料室(CH3)4N+向II室迁移 B、Ⅰ室可得到H2和CO2 C、当外电路中有1mol电子通过时,理论上能生成1mol(CH3)4NOH D、电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑5. 一种可充电的锌锰分液电池,其结构如下图所示: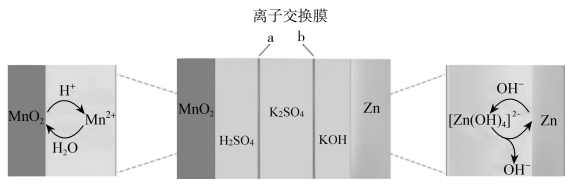
下列说法不正确的是( )
A、放电时,正极反应为: B、充电时,Zn作阴极: C、离子交换膜a和b分别为阳离子交换膜和阴离子交换膜 D、充电过程中溶液的浓度逐渐降低6. 自古以来,化学与人类生产、生活密切相关,下列有关说法错误的是( )A、杜康用高粱酿酒的原理,是通过蒸馏法将高粱中的乙醇分离出来 B、制造新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质 C、“深海勇士”号潜水艇使用的锂离子电池是一种二次电池 D、唐代诗人刘禹锡的《浪淘沙》中“美人首饰侯王印,尽是沙中浪底来”不涉及氧化还原反应7. 研究发现钾离子可在有机与无机材料层间脱嵌实现电池的充放电过程。如图所示是一种钾离子的二次电池模型。下列说法正确的是( )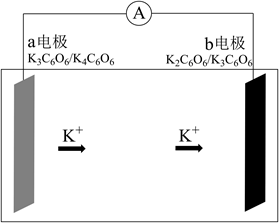 A、放电时,a为负极,碳元素化合价不变 B、放电时,转移0.2NA电子,正极增重7.8g C、充电时,b极反应为K2C6O6-e-+K+=K3C6O6 D、电池总反应为K4C6O6+K2C6O6 2K3C6O68. 我国科学家最近发明了一种Zn-PbO2二次电池,内部结构如图所示。电解质分别为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个区域。放电后B区域电解质溶液浓度增加。下列说法错误的是( )
A、放电时,a为负极,碳元素化合价不变 B、放电时,转移0.2NA电子,正极增重7.8g C、充电时,b极反应为K2C6O6-e-+K+=K3C6O6 D、电池总反应为K4C6O6+K2C6O6 2K3C6O68. 我国科学家最近发明了一种Zn-PbO2二次电池,内部结构如图所示。电解质分别为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个区域。放电后B区域电解质溶液浓度增加。下列说法错误的是( )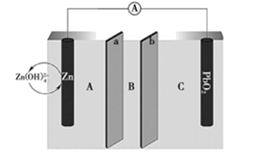 A、电池中PbO2为正极 B、B区域的电解质为K2SO4溶液 C、图中的b膜为阳离子交换膜 D、当电路中转移0.2mol电子时,B区溶质质量增大17.4g9. 2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4 , 下列说法错误的是( )
A、电池中PbO2为正极 B、B区域的电解质为K2SO4溶液 C、图中的b膜为阳离子交换膜 D、当电路中转移0.2mol电子时,B区溶质质量增大17.4g9. 2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4 , 下列说法错误的是( )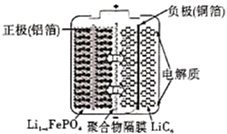 A、“刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染 B、放电时,负极反应为LiC6-xe-=xLi++Li1-xC6 C、充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌 D、该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)10. 太阳能电池在日常生活中已广泛应用,一种替代硅光电池的全天候太阳能电池已投入商用,其工作原理如图。下列说法错误的是( )
A、“刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染 B、放电时,负极反应为LiC6-xe-=xLi++Li1-xC6 C、充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌 D、该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)10. 太阳能电池在日常生活中已广泛应用,一种替代硅光电池的全天候太阳能电池已投入商用,其工作原理如图。下列说法错误的是( )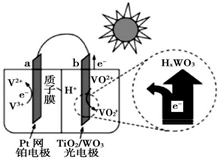 A、硅太阳能电池工作原理与该电池不相同 B、夜间时,该电池相当于蓄电池放电,a 极发生氧化反应 C、光照时,b 极的电极反应式为VO2+﹣e﹣+H2O=VO +2H+ D、光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移11. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。
A、硅太阳能电池工作原理与该电池不相同 B、夜间时,该电池相当于蓄电池放电,a 极发生氧化反应 C、光照时,b 极的电极反应式为VO2+﹣e﹣+H2O=VO +2H+ D、光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移11. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。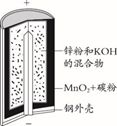
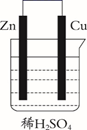
下列关于原电池和干电池的说法错误的是( )
A、两者正极材料不同 B、MnO2的放电产物可能是KMnO4 C、两者负极反应式均为Zn失电子 D、原电池中Zn与稀H2SO4存在自放电现象12. 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH− , 下列说法不正确的是( ) A、放电时,正极的电极反应式为O2+2H2O+4e−=4OH− B、放电时,Li+透过固体电解质向右移动 C、通空气时,铜被腐蚀,表面产生Cu2O D、整个反应过程中,氧化剂为O213. 最近我国科学家研制出一种高分子大规模储能二次电池,其示意图如下所示。这种电池具有寿命长、安全可靠等优点, 下列说法不正确的是( )
A、放电时,正极的电极反应式为O2+2H2O+4e−=4OH− B、放电时,Li+透过固体电解质向右移动 C、通空气时,铜被腐蚀,表面产生Cu2O D、整个反应过程中,氧化剂为O213. 最近我国科学家研制出一种高分子大规模储能二次电池,其示意图如下所示。这种电池具有寿命长、安全可靠等优点, 下列说法不正确的是( )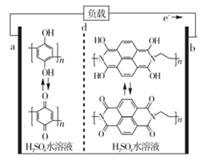 A、硫酸水溶液主要作用是增强导电性 B、充电时,电极 B接正极 C、D膜是质子交换膜 D、充放电时,A极有
A、硫酸水溶液主要作用是增强导电性 B、充电时,电极 B接正极 C、D膜是质子交换膜 D、充放电时,A极有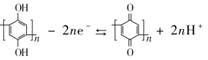 14. 下列有关电化学原理及应用的相关说法正确的是( )A、电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能 B、电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒 C、工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同 D、电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极15. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
14. 下列有关电化学原理及应用的相关说法正确的是( )A、电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能 B、电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒 C、工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同 D、电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极15. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )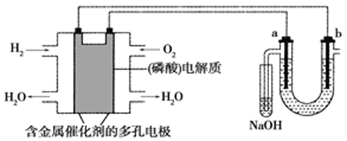 A、电池工作时,正极反应式为O2+2H2O+4e-=4OH- B、电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极 C、试管中NaOH溶液用来吸收电解时产生的Cl2 D、当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体16. 锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH- , 下列说法错误的是( )
A、电池工作时,正极反应式为O2+2H2O+4e-=4OH- B、电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极 C、试管中NaOH溶液用来吸收电解时产生的Cl2 D、当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体16. 锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH- , 下列说法错误的是( )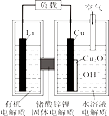 A、整个反应过程中,氧化剂为O2 B、放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH- C、放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应 D、通空气时,铜被腐蚀,表面产生Cu2O17. 锂-碘电池应用于心脏起搏器,使用寿命超过10 年,负极是锂,正极是聚2-乙烯吡(P2VP) 和I2 复合物,工作原理2Li+ P2VP·nI2=2LiI+ P2VP·(n-1)I2 , 下列叙述错误的是( )A、该电池是电解质为非水体系的二次电池 B、工作时Li+向正极移动 C、正极反应式为P2VP·nI2+2Li++2e-=2LiI+ P2VP·(n-1)I2 D、该电池具有全时间工作、体积小、质量小、寿命长等优点18. 全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )
A、整个反应过程中,氧化剂为O2 B、放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH- C、放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应 D、通空气时,铜被腐蚀,表面产生Cu2O17. 锂-碘电池应用于心脏起搏器,使用寿命超过10 年,负极是锂,正极是聚2-乙烯吡(P2VP) 和I2 复合物,工作原理2Li+ P2VP·nI2=2LiI+ P2VP·(n-1)I2 , 下列叙述错误的是( )A、该电池是电解质为非水体系的二次电池 B、工作时Li+向正极移动 C、正极反应式为P2VP·nI2+2Li++2e-=2LiI+ P2VP·(n-1)I2 D、该电池具有全时间工作、体积小、质量小、寿命长等优点18. 全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )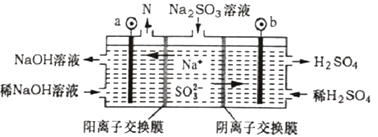 A、全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O B、图中a电极为阴极,N物质是H2 C、全钒液流电池充电时,V3+被氧化为VO2+ D、电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+19. 下列有关电化学说法错误的是( )A、电池中电流由正极流向负极。锂电池比能量高,锂电池一般不用有机酸、醇、水溶液直接作电解质溶液 B、太阳能电池有的是物理过程,有的还包括一个循环往复的化学反应 C、硅铁合金(一种惰性材料)可做牺牲阳极的阴极保护法的阳极 D、电解时,有时一些阳离子、含氧酸根也可在阳极放电20. 铝石墨双离子电池是一种全新低成本、高效电池。原理为:AlLi+Cx(PF6) Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
A、全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O B、图中a电极为阴极,N物质是H2 C、全钒液流电池充电时,V3+被氧化为VO2+ D、电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+19. 下列有关电化学说法错误的是( )A、电池中电流由正极流向负极。锂电池比能量高,锂电池一般不用有机酸、醇、水溶液直接作电解质溶液 B、太阳能电池有的是物理过程,有的还包括一个循环往复的化学反应 C、硅铁合金(一种惰性材料)可做牺牲阳极的阴极保护法的阳极 D、电解时,有时一些阳离子、含氧酸根也可在阳极放电20. 铝石墨双离子电池是一种全新低成本、高效电池。原理为:AlLi+Cx(PF6) Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )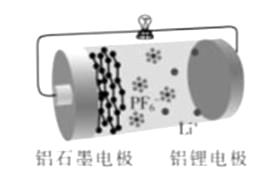 A、放电时,外电路中电子向铝锂电极移动 B、放电时,正极反应为Cx(PF6)+e-=xC+PF6- C、充电时,应将铝石墨电极与电源负极相连 D、充电时,若电路中通过1 mol电子,阴极质量增加9 g21. Al-Ag2O电池是一种以NaOH溶液为电解质的水下动力电源,下列说法错误的是( )A、负极反应式为:Al+4OH--3e-=AlO2-+2H2O B、负极可能会发生副反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ C、当电路中转移0.05mole-时,正极质量减少0.4g D、电池工作时,正极附近pH变小22. LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
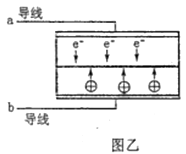
A、放电时,外电路中电子向铝锂电极移动 B、放电时,正极反应为Cx(PF6)+e-=xC+PF6- C、充电时,应将铝石墨电极与电源负极相连 D、充电时,若电路中通过1 mol电子,阴极质量增加9 g21. Al-Ag2O电池是一种以NaOH溶液为电解质的水下动力电源,下列说法错误的是( )A、负极反应式为:Al+4OH--3e-=AlO2-+2H2O B、负极可能会发生副反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ C、当电路中转移0.05mole-时,正极质量减少0.4g D、电池工作时,正极附近pH变小22. LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )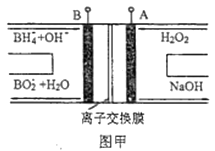
 A、电池应选用阳离子交换膜,Na+向A极区移动 B、电池A极区的电极反应式为:H2O2+2e-=2OH- C、每有1molNaBH4参加反应,转移电子数为4NA D、要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连23. 锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI。下列说法正确的是( )A、该电池放电时,锂电极发生还原反应 B、该电池发生的总反应为2Li+P2VP·nI2=P2VP·(n-1)I2+2LiI C、P2VP和I2的复合物是绝缘体,不能导电 D、该电池工作时,碘离子移向正极24. 下列有关电池的说法错误的是( )A、手机上用的锂离子电池属于二次电池 B、锌锰干电池中,锌电极是负极 C、氢氧燃料电池可把化学能转化为电能 D、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极25. 一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O.下列有关说法错误的是( )A、检测时,电解质溶液中的H+向正极移动 B、若有 0.4 mol电子转移,则消耗 2.24 L氧气 C、正极上发生还原反应,负极上发生氧化反应 D、负极上的反应为:CH3CH2OH﹣4e﹣+H2O═CH3COOH+4H+26. 如图所示是几种常见的化学电源示意图,有关说法正确的是( )
A、电池应选用阳离子交换膜,Na+向A极区移动 B、电池A极区的电极反应式为:H2O2+2e-=2OH- C、每有1molNaBH4参加反应,转移电子数为4NA D、要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连23. 锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI。下列说法正确的是( )A、该电池放电时,锂电极发生还原反应 B、该电池发生的总反应为2Li+P2VP·nI2=P2VP·(n-1)I2+2LiI C、P2VP和I2的复合物是绝缘体,不能导电 D、该电池工作时,碘离子移向正极24. 下列有关电池的说法错误的是( )A、手机上用的锂离子电池属于二次电池 B、锌锰干电池中,锌电极是负极 C、氢氧燃料电池可把化学能转化为电能 D、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极25. 一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O.下列有关说法错误的是( )A、检测时,电解质溶液中的H+向正极移动 B、若有 0.4 mol电子转移,则消耗 2.24 L氧气 C、正极上发生还原反应,负极上发生氧化反应 D、负极上的反应为:CH3CH2OH﹣4e﹣+H2O═CH3COOH+4H+26. 如图所示是几种常见的化学电源示意图,有关说法正确的是( )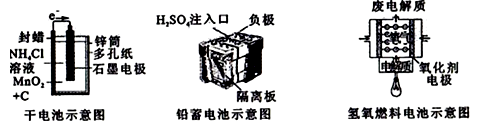 A、上述电池分别属于一次电池、二次电池和燃料电池 B、干电池工作时,H+向锌筒移动 C、铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207g D、氢氧燃料电池的正极反应一定是O2+4e-+2H2O=4OH-27. “软电池”采用一张薄层纸片作为传导体,一面为锌,另一面为二氧化锰,纸层中水和氧化锌组成电解液。电池总反应为:Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )A、该电池的正极为氧化锌 B、锌电极附近溶液的pH不变 C、电池正极反应式:2MnO2+2e-+2H2O=2MnO(OH)+2OH- D、当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
A、上述电池分别属于一次电池、二次电池和燃料电池 B、干电池工作时,H+向锌筒移动 C、铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207g D、氢氧燃料电池的正极反应一定是O2+4e-+2H2O=4OH-27. “软电池”采用一张薄层纸片作为传导体,一面为锌,另一面为二氧化锰,纸层中水和氧化锌组成电解液。电池总反应为:Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )A、该电池的正极为氧化锌 B、锌电极附近溶液的pH不变 C、电池正极反应式:2MnO2+2e-+2H2O=2MnO(OH)+2OH- D、当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol二、多选题
-
28. 下列有关叙述正确的是( )A、碱性锌锰电池中,MnO2是催化剂 B、银锌纽扣电池工作时,Ag2O被还原为Ag C、放电时,铅酸蓄电池中硫酸浓度不断增大 D、电镀时,待镀的金属制品表面发生还原反应29. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是( )。A、电池工作时,MnO2失去电子 B、电池工作时,电子由锌经外电路流向MnO2 C、从反应方程式来看,不使用氢氧化钾,也不影响电流大小 D、电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)30. 下列有关电池的说法正确的是( )A、手机上用的锂离子电池属于二次电池 B、铜锌原电池工作时,电子从铜电极流向锌电极 C、氢氧燃料电池可把化学能转化为电能 D、锌锰干电池中,锌电极是负极
三、非选择题
-
31. 以CO2生产甲醇(CH3OH)是实现“碳中和”的重要途径。其原理是CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。(1)、该反应的能量变化如图所示,该反应为(填“放热”或“吸热”)反应。
 (2)、恒容容器中,对于上述反应,下列措施能加快反应速率的是____。A、升高温度 B、充入He C、加入合适的催化剂 D、降低压强(3)、在体积为2L的密闭容器中,充入1molCO2和3molH2 , 测得CO2、CH3OH的物质的量随时间变化如图。反应达到平衡状态,此时H2的转化率为。
(2)、恒容容器中,对于上述反应,下列措施能加快反应速率的是____。A、升高温度 B、充入He C、加入合适的催化剂 D、降低压强(3)、在体积为2L的密闭容器中,充入1molCO2和3molH2 , 测得CO2、CH3OH的物质的量随时间变化如图。反应达到平衡状态,此时H2的转化率为。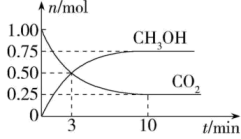 (4)、在相同温度、容积不变的条件下,不能说明该反应已达平衡状态的是____。A、CO2、H2的浓度均不再变化 B、体系压强不变 C、n(CH3OH)∶n(H2O)=1∶1 D、H2的消耗速率与CH3OH的生成速率之比为3∶1(5)、用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图。
(4)、在相同温度、容积不变的条件下,不能说明该反应已达平衡状态的是____。A、CO2、H2的浓度均不再变化 B、体系压强不变 C、n(CH3OH)∶n(H2O)=1∶1 D、H2的消耗速率与CH3OH的生成速率之比为3∶1(5)、用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图。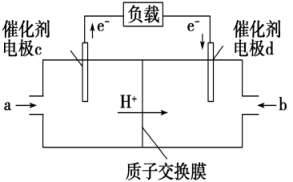
①则电极c是(填“正极”或“负极”),电极d的电极反应式。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。
32. CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善。由CO2合成甲醇是CO2资源化利用的重要方法。(1)、Ⅰ.合成甲醇由CO2催化加氢合成甲醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3 , 它们随温度变化的曲线如图所示。
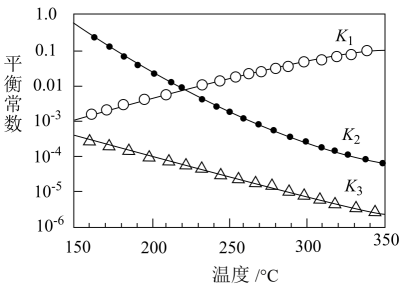
①则△H2△H3(填“>”“<”或“=”)。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法不正确的是(填字母)。
a.增大初始投料比 , 有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
(2)、电化学原理将CO2转化为甲醇。在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在(填“阴”或“阳”)极生成;
②氧化反应为。
(3)、Ⅱ.甲醇是重要的化工原料,也可用作甲醇燃料电池。以稀硫酸为电解质溶液,甲醇燃料电池的工作原理如图所示。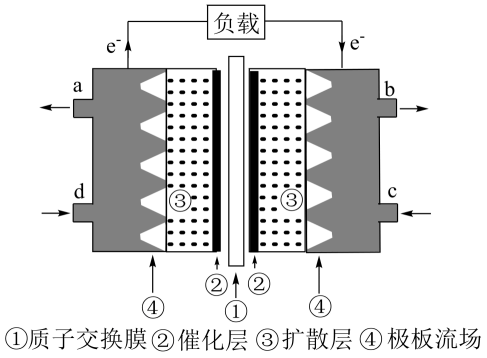
该电池工作时,c口通入的物质是。
(4)、该电池负极的电极反应式是。33. 镍镉电池是应用广泛的二次电池,其总反应为:Cd+2NiOOH+2H2O 2Ni(OH)2+Cd(OH)2
制造密封式镍镉电池的部分工艺如下:
(1)、I.Ni(OH)2的制备以硫酸镍(NiSO4)为原料制备Ni(OH)2的主要过程如下图所示。制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能。
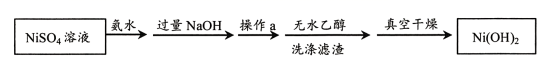
已知:Ni2++6NH3•H2O⇌[Ni(NH3)6]2++6H2O
操作a是 。
(2)、制备过程中,需先加氨水,再加过量NaOH,请分析:①先加氨水的目的是 。
②用化学平衡移动原理分析加入NaOH需过量的原因是。
(3)、用无水乙醇代替水洗涤滤渣的优点是答出1条即可)。(4)、II.镍镉电池的组装主要步骤:①将Ni(OH)2和Cd(OH)2固定,中间以隔膜隔开(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
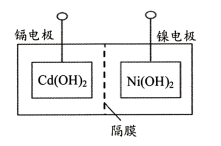
下列对镍镉电池组装和使用的分析正确的是(填字母序号)。
a.密封镍镉电池可以避免KOH变质
b.镍电极为电池的负极,镉电极为电池的正极
c.电池组装后,应先充电,再使用
(5)、III.过度充电的保护电池充电时,若Cd(OH)2和Ni(OH)2耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的Cd(OH)2可对电池进行过度充电保护,该方法称为镉氧循环法。
Cd(OH)2耗尽后继续充电,镉电极上生成的物质为。
(6)、已知:①隔膜可以透过阴离子和分子:②O2可以与Cd发生反应生成Cd(OH)2。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理:。34. 铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb,还含有少量的Ag、CaO)制备硫酸铅。制备流程图如下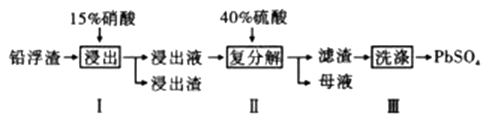
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
(1)、步骤I有NO产生浸出液中含量最多的金属阳离子为Pb2+ , 写出Pb参加反应的化学方程式 , 为防止Ag被溶解进入溶液,步骤I操作时应注意。(2)、粗PbSO4产品含有的杂质是;要得到纯净的PbSO4 , 需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是。A.稀硫酸
B.稀盐酸
C.硝酸铅溶液
D.酒精
(3)、母液可循环利用的物质是HNO3 , 若母液中残留的SO42-过多,循环利用时可能出现的问题是。(4)、若将步骤Ⅱ中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为mol/L。(5)、(CH3COO)2Pb是皮毛行业可溶于水的染色助剂,可用PbSO4与CH3 COONH4反应制备,写出该反应的离子方程式。(6)、铅蓄电池是电压稳定、使用方便的二次电池。PbSO4在其中扮演了重要角色,写出铅蓄电池充电时阳极的电极反应。35. 水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084%CaO。
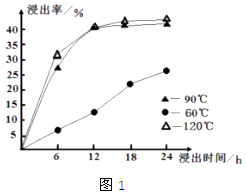
 (1)、在一定浓度的 溶液中,钴的浸出率随时间、温度的变化如图1所示 考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为(2)、请配平下列除铁的化学方程式:
(1)、在一定浓度的 溶液中,钴的浸出率随时间、温度的变化如图1所示 考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为(2)、请配平下列除铁的化学方程式:_ _Fe2(SO4)3+H2O +Na2CO3 =Na2Fe6(SO4)4(OH)12↓+Na2SO4 +CO2↑
(3)、“除钙、镁”的原理反应为: ; 已知 ,加入过量NaF溶液反应完全后过滤,则滤液中 .(4)、“沉淀”中含杂质离子主要有 、 、和;“操作X”包括和。(5)、某锂离子电池正极是 ,含 导电固体为电解质 充电时, 还原为Li,并以原子形式嵌入电池负极材料碳 中 如图2所示 电池反应为 ,写出该电池放电时的正极反应式 .