高考二轮复习知识点:电极反应和电池反应方程式3
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1.
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
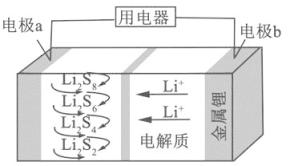 A、电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4 B、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C、石墨烯的作用主要是提高电极a的导电性 D、电池充电时间越长,电池中的Li2S2量越多2. 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4﹣H2C2O4混合溶液.下列叙述错误的是( )A、待加工铝质工件为阳极 B、可选用不锈钢网作为阴极 C、阴极的电极反应式为:Al3++3e﹣═Al D、硫酸根离子在电解过程中向阳极移动3. 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )A、阴极附近溶液呈红色 B、阴极逸出气体 C、阳极附近溶液呈蓝色 D、溶液的pH变小4. 卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石()中,与浓反应可制取HF;氯、溴主要存在于海水中,工业常通过电解NaCl饱和溶液制备 , 可用于制取漂白粉。卤水中可通过氧化、溶液吸收;BrCl能发生水解反应。易升华,一种二次电池正极界面反应机理如图所示。
A、电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4 B、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C、石墨烯的作用主要是提高电极a的导电性 D、电池充电时间越长,电池中的Li2S2量越多2. 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4﹣H2C2O4混合溶液.下列叙述错误的是( )A、待加工铝质工件为阳极 B、可选用不锈钢网作为阴极 C、阴极的电极反应式为:Al3++3e﹣═Al D、硫酸根离子在电解过程中向阳极移动3. 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )A、阴极附近溶液呈红色 B、阴极逸出气体 C、阳极附近溶液呈蓝色 D、溶液的pH变小4. 卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石()中,与浓反应可制取HF;氯、溴主要存在于海水中,工业常通过电解NaCl饱和溶液制备 , 可用于制取漂白粉。卤水中可通过氧化、溶液吸收;BrCl能发生水解反应。易升华,一种二次电池正极界面反应机理如图所示。
下列化学反应表示正确的是
A、电池正极放电时的电极反应有: B、电解饱和NaCl溶液: C、BrCl与反应: D、用溶液吸收:5. 用石墨作电极电解a浊液,记录如表。实验装置
实验现象

I.a为AgCl
II.a为AgI
两电极均产生气泡,有黑色固体在阴极附近生成,并沉降在烧杯底部,烧杯中的液体逐渐变澄清透明
两电极均产生气泡,阴极表面附着少量银白色固体,烧杯中的液体逐渐变为棕黄色
下列说法错误的是
A、I中阳极气体可能为Cl2和O2 , II中阳极气体为O2 B、I和II中阴极生成气体的方程式均为2H2O+2e-=H2↑+2OH- C、II中液体变为棕黄色,说明阳极上发生了反应2AgI-2e-=I2+2Ag+ D、两实验阴极现象有差异的原因可能是II中c(Ag+)比I中的小6. 我国科学家近期开发了一种高性能的水系锰基锌电池。 其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。下列说法正确的是 A、电子流向:Zn电极→b膜→a膜→MnO2电极→负载→Zn电极 B、负极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O C、a膜为阴离子交换膜,b膜为阳离子交换膜 D、装置工作一段时间后,正极区溶液的pH降低7. 新能源的开发和利用是解决气候问题的重要途径,科研人员开发一种新型可充电钾离子电池的正极材料(),可使电池效能更佳,已知放电时正极会生成。下列有关说法正确的是
A、电子流向:Zn电极→b膜→a膜→MnO2电极→负载→Zn电极 B、负极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O C、a膜为阴离子交换膜,b膜为阳离子交换膜 D、装置工作一段时间后,正极区溶液的pH降低7. 新能源的开发和利用是解决气候问题的重要途径,科研人员开发一种新型可充电钾离子电池的正极材料(),可使电池效能更佳,已知放电时正极会生成。下列有关说法正确的是 A、总反应为 B、放电时,正极反应为 C、该电池可用溶液作为电解质溶液 D、用该电池电解溶液,阴极增重24克时,通过交换膜的为8. 目前科学家发明了一种利用微生物进行脱硫、脱氮的原电池装置,其基本原理如图所示(图中隔膜为质子交换膜)。下列有关说法正确的是
A、总反应为 B、放电时,正极反应为 C、该电池可用溶液作为电解质溶液 D、用该电池电解溶液,阴极增重24克时,通过交换膜的为8. 目前科学家发明了一种利用微生物进行脱硫、脱氮的原电池装置,其基本原理如图所示(图中隔膜为质子交换膜)。下列有关说法正确的是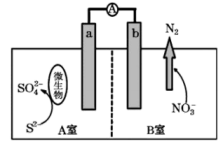 A、a极的电极反应式为 B、H+从B室向A室迁移 C、电池工作时,线路中通过1mol电子,则在b极析出2.24LN2 D、若用该电池给铅蓄电池充电,应将b极连在正极上9. 用如图装置进行实验,产生电流。下列说法错误的是
A、a极的电极反应式为 B、H+从B室向A室迁移 C、电池工作时,线路中通过1mol电子,则在b极析出2.24LN2 D、若用该电池给铅蓄电池充电,应将b极连在正极上9. 用如图装置进行实验,产生电流。下列说法错误的是 A、b为电池的负极 B、工作一段时间后,a极附近溶液pH减小 C、K+从a极经阳离子交换膜移动到b极 D、该装置的总反应为:H2+Cl2+2OH-=2Cl-+2H2O10. 一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,电池总反应为:。下列说法错误的是
A、b为电池的负极 B、工作一段时间后,a极附近溶液pH减小 C、K+从a极经阳离子交换膜移动到b极 D、该装置的总反应为:H2+Cl2+2OH-=2Cl-+2H2O10. 一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,电池总反应为:。下列说法错误的是 A、放电时,含有锌膜的碳纳米管纤维作电池负极 B、充电时,阴极反应: C、有机高聚物中含有极性键、非极性键和氢键 D、合成有机高聚物的单体:
A、放电时,含有锌膜的碳纳米管纤维作电池负极 B、充电时,阴极反应: C、有机高聚物中含有极性键、非极性键和氢键 D、合成有机高聚物的单体: 11. 我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如图。
11. 我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如图。
下列说法错误的是
A、电极a是正极 B、电极b的反应式:N2H4-4e-+4OH-=N2↑+4H2O C、每生成1molN2 , 有2molNaCl发生迁移 D、离子交换膜c、d分别是阳离子交换膜和阴离子交换膜12. 科学家研发了一种绿色环保“全氢电池”,某化学兴趣小组将其用于铜片上镀银作为奖牌奖给优秀学生,工作原理如图所示。下列说法错误的是 A、负极的电极反应式: B、当吸附层a通入2.24L(标况)氢气时,溶液中有0.2mol离子透过交换膜 C、离子交换膜既可以是阳离子交换膜也可以是阴离子交换膜 D、电池工作时,m电极质量逐渐增重13. 我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气(CO和H2),原理如图所示,下列说法错误的是
A、负极的电极反应式: B、当吸附层a通入2.24L(标况)氢气时,溶液中有0.2mol离子透过交换膜 C、离子交换膜既可以是阳离子交换膜也可以是阴离子交换膜 D、电池工作时,m电极质量逐渐增重13. 我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气(CO和H2),原理如图所示,下列说法错误的是 A、催化电极b与电源负极相连 B、电解时催化电极a附近的pH增大 C、电解时阴离子透过交换膜向a极迁移 D、生成合成气时电极上发生还原反应
A、催化电极b与电源负极相连 B、电解时催化电极a附近的pH增大 C、电解时阴离子透过交换膜向a极迁移 D、生成合成气时电极上发生还原反应二、多选题
-
14. 我国科学家在利用电解法合成高纯度有机产品的研究上有重大突破。其中在酸性环境中电解糠醛(
 )制备有机产品的原理示意图如下所示。下列说法正确的是( )
)制备有机产品的原理示意图如下所示。下列说法正确的是( )  A、交换膜适宜选用质子交换膜 B、N极电势高于M极电势 C、N极上发生的电极反应包括
A、交换膜适宜选用质子交换膜 B、N极电势高于M极电势 C、N极上发生的电极反应包括 +H2O-2e-=
+H2O-2e-= 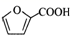 +2H+
D、电路上每通过1mol e- , 理论上生成1 mol
+2H+
D、电路上每通过1mol e- , 理论上生成1 mol  15. CO难溶于水和碱液,在优化催化剂的基础上,调节电极的孔道和疏水性增加CO的扩散速率,可实现高选择性将CO电解还原制备C2H4 , 装置如下图所示。下列说法错误的是( )
15. CO难溶于水和碱液,在优化催化剂的基础上,调节电极的孔道和疏水性增加CO的扩散速率,可实现高选择性将CO电解还原制备C2H4 , 装置如下图所示。下列说法错误的是( ) A、聚四氟乙烯具有吸附并增加CO浓度的作用 B、碳纸/聚四氟乙烯电极连接电源的正极,发生氧化反应 C、生成C2H4的电极反应为:2CO-8e-+6H2O=C2H4+8OH- D、为了维持电解效率,离子交换膜应使用阴离子交换膜16. 新型 双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图。当闭合 时,发生反应为 ,下列关于该电池说法错误的是( )
A、聚四氟乙烯具有吸附并增加CO浓度的作用 B、碳纸/聚四氟乙烯电极连接电源的正极,发生氧化反应 C、生成C2H4的电极反应为:2CO-8e-+6H2O=C2H4+8OH- D、为了维持电解效率,离子交换膜应使用阴离子交换膜16. 新型 双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图。当闭合 时,发生反应为 ,下列关于该电池说法错误的是( )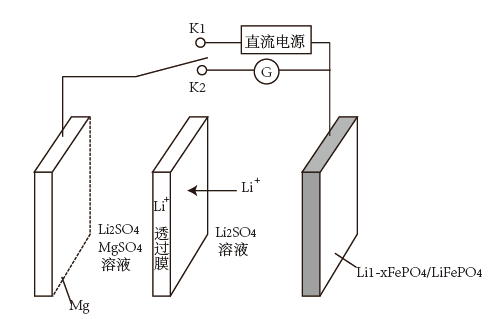 A、当闭合 时,出现图示中 移动情况 B、放电时正极的电极反应式为 C、可以通过提高 、 溶液的酸度来提高该电池的工作效率 D、若 ,则 中 与 的个数比为17. 微生物电池可以处理含醋酸铵和对氯苯酚的工业废水,工作原理如图,下列说法错误的是( )
A、当闭合 时,出现图示中 移动情况 B、放电时正极的电极反应式为 C、可以通过提高 、 溶液的酸度来提高该电池的工作效率 D、若 ,则 中 与 的个数比为17. 微生物电池可以处理含醋酸铵和对氯苯酚的工业废水,工作原理如图,下列说法错误的是( ) A、采用高温条件,可以提高该电池的工作效率 B、甲电极的电极反应式:
A、采用高温条件,可以提高该电池的工作效率 B、甲电极的电极反应式: +e-→Cl-+
+e-→Cl-+  C、标况下产生22.4LCO2时,有4molH+通过质子交换膜
D、不考虑其它离子放电,甲乙两电极可同时处理CH3COONH4与
C、标况下产生22.4LCO2时,有4molH+通过质子交换膜
D、不考虑其它离子放电,甲乙两电极可同时处理CH3COONH4与  的物质的量之比为1:4
18. 我国科学家利用电解法在常温常压下实现了氨的合成,该装置工作时阴极区的微观示意图如下,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
的物质的量之比为1:4
18. 我国科学家利用电解法在常温常压下实现了氨的合成,该装置工作时阴极区的微观示意图如下,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。 下列说法正确的是( )A、三氟甲磺酸锂的作用是增强导电性 B、选择性透过膜允许N2、NH3和H2O通过 C、该装置用Au作催化剂,目的是改变N2的键能 D、生成NH3的电板反应为N2+6C2H5OH+6e-=2NH3+6C2H5O-19. 可充电水系Zn—CO2电池用锌和催化剂材料作两极,电池工作示意图如图所示,其中双极膜是由阳膜和阴膜制成的复合膜,在直流电场的作用下,双极膜复合层间的H2O电离出的H+和OH-可以分别通过膜移向两极。下列说法错误的是( )
下列说法正确的是( )A、三氟甲磺酸锂的作用是增强导电性 B、选择性透过膜允许N2、NH3和H2O通过 C、该装置用Au作催化剂,目的是改变N2的键能 D、生成NH3的电板反应为N2+6C2H5OH+6e-=2NH3+6C2H5O-19. 可充电水系Zn—CO2电池用锌和催化剂材料作两极,电池工作示意图如图所示,其中双极膜是由阳膜和阴膜制成的复合膜,在直流电场的作用下,双极膜复合层间的H2O电离出的H+和OH-可以分别通过膜移向两极。下列说法错误的是( ) A、放电时,右侧电极的电极反应为CO2+2H+-2e-=HCOOH B、放电时,金属锌为负极,发生氧化反应 C、充电时,双极隔膜产生的H+向右侧正极室移动 D、充电时,电池总反应为2Zn(OH) =2Zn +O2↑+4OH-+2H2O20. 有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极( )中的Na+的嵌入和脱掉机理,分两步电解生产H2、NaOH和Cl2.其原理如图所示,下列说法错误的是( )
A、放电时,右侧电极的电极反应为CO2+2H+-2e-=HCOOH B、放电时,金属锌为负极,发生氧化反应 C、充电时,双极隔膜产生的H+向右侧正极室移动 D、充电时,电池总反应为2Zn(OH) =2Zn +O2↑+4OH-+2H2O20. 有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极( )中的Na+的嵌入和脱掉机理,分两步电解生产H2、NaOH和Cl2.其原理如图所示,下列说法错误的是( ) A、钠离子的嵌入反应是还原反应: B、电极b和c所连接的直流电源的电极相同 C、第1步结束后, 电极必须用水洗涤干净后,再用于第2步 D、第一步中的Na+浓度始终保持不变21. 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。硫化氢—空气质子交换膜燃料电池实现了发电、环保的有效结合,已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJ/mol,下列说法错误的是( )
A、钠离子的嵌入反应是还原反应: B、电极b和c所连接的直流电源的电极相同 C、第1步结束后, 电极必须用水洗涤干净后,再用于第2步 D、第一步中的Na+浓度始终保持不变21. 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。硫化氢—空气质子交换膜燃料电池实现了发电、环保的有效结合,已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJ/mol,下列说法错误的是( )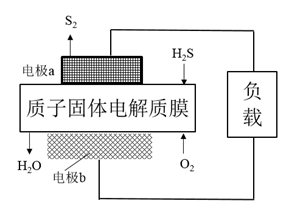 A、电极a 发生了氧化反应 B、标准状况下,每 11.2 L H2S 参与反应,有1 mol H+ 经固体电解质膜进入正极区 C、当电极a的质量增加64 g 时,电池内部释放632 kJ 的热能 D、电极b上发生的电极反应为O2+2H2O+4e- = 4OH-22. 电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(•OH)能氧化降解有机污染物。下列说法错误的是( )
A、电极a 发生了氧化反应 B、标准状况下,每 11.2 L H2S 参与反应,有1 mol H+ 经固体电解质膜进入正极区 C、当电极a的质量增加64 g 时,电池内部释放632 kJ 的热能 D、电极b上发生的电极反应为O2+2H2O+4e- = 4OH-22. 电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(•OH)能氧化降解有机污染物。下列说法错误的是( ) A、电源的A极为正极 B、与电源B极相连的电极反应式为:H2O-e-=H++•OH C、H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++•OH D、每消耗2.24LO2(标准状况),整个电解池中理论上可产生的•OH为0.2mol23. 一种新型 水介质电池示意图如下,电极材料为金属锌和选择性催化材料。放电时,温室气体 被转化为储氢物质甲酸等,为解决“碳中和”和能源问题提供了一种新途径。下列说法正确的是( )
A、电源的A极为正极 B、与电源B极相连的电极反应式为:H2O-e-=H++•OH C、H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++•OH D、每消耗2.24LO2(标准状况),整个电解池中理论上可产生的•OH为0.2mol23. 一种新型 水介质电池示意图如下,电极材料为金属锌和选择性催化材料。放电时,温室气体 被转化为储氢物质甲酸等,为解决“碳中和”和能源问题提供了一种新途径。下列说法正确的是( ) A、充电时,Zn电极连电源负极 B、充电时,阳极区pH升高 C、放电时,Zn在正极失去电子 D、放电时, 完全转化为HCOOH时有 转移24. 一种以锌-石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有 ,可表示为 )为正极、盐-水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法正确的是( )
A、充电时,Zn电极连电源负极 B、充电时,阳极区pH升高 C、放电时,Zn在正极失去电子 D、放电时, 完全转化为HCOOH时有 转移24. 一种以锌-石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有 ,可表示为 )为正极、盐-水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法正确的是( ) A、放电时,石墨烯气凝胶电极上的电极反应式为 B、多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面 C、电池总反应为 D、充电时, 被还原, 在石墨烯纤维无纺布电极侧沉积, 被氧化后在阴极嵌入
A、放电时,石墨烯气凝胶电极上的电极反应式为 B、多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面 C、电池总反应为 D、充电时, 被还原, 在石墨烯纤维无纺布电极侧沉积, 被氧化后在阴极嵌入三、非选择题
-
25. 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 . 回答下列问题:
 (1)、外电路的电流方向是由极流向极(填字母).(2)、电池正极反应式 .(3)、是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是 .(4)、MnO2可与KOH和KClO3在高温下反应,生成K2MnO4 , 反应的化学方程式为 . K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .26. 在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
(1)、外电路的电流方向是由极流向极(填字母).(2)、电池正极反应式 .(3)、是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是 .(4)、MnO2可与KOH和KClO3在高温下反应,生成K2MnO4 , 反应的化学方程式为 . K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .26. 在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1>0
②2NO2(g)N2O4(g) △H2<0
(1)、温度T1时,在0.5L的恒容密闭容器中投入0.04molAgNO3(s)并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图1所示:
①下列情况能说明体系达到平衡状态的是(填字母)。
a.混合气体的平均相对分子质量不再改变
b.O2的浓度不再改变
c.NO2的体积分数不再改变
d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0.8MPa,反应开始到10min内N2O4的平均反应速率为MPa·min-1。在该温度下2NO2(g)N2O4(g)的平衡常数Kp=(MPa)-1(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得正=(NO2)消耗=k正c2(NO2),逆=2(N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=。若将容器的温度改变为T2时,其k正=10k逆 , 则T1T2(填“>”“<”或“=”)。
(2)、用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为C(s)+2NO(g)N2(g)+CO2(g)。向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入NO和N2 , 使二者的浓度均增加至原来的两倍,此时反应正 逆(填“>”“<”或“=”)。(3)、氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn—NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图2所示(双极膜可将水解离为H+和OH- , 并实现其定向通过)。在该电池工作过程中,MoS2电极上发生的电极反应式为 , 若有4.48LNO(标准状况下)参加反应,Zn/ZnO电极质量增加g。 27. 氢气是重要的清洁能源,低成本制氢是今后科研攻关的重点课题。(1)、碱金属氢化物制氢。以一种制氢储氢材料氢化钠在室温下结合制氢为例,能将反应中的部分还原成碳并放出 , 该反应的化学方程式为。(2)、活性金属铝制氢。向两份活性合金粉末(的质量分数为)中分别加入溶液充分搅拌,在相同时间内测得、两种不同温度下制氢率(实际制氢量占理论产氢量的百分比)随时间的变化如图-1所示。后时制氢率始终低于时制氢率的原因是。
27. 氢气是重要的清洁能源,低成本制氢是今后科研攻关的重点课题。(1)、碱金属氢化物制氢。以一种制氢储氢材料氢化钠在室温下结合制氢为例,能将反应中的部分还原成碳并放出 , 该反应的化学方程式为。(2)、活性金属铝制氢。向两份活性合金粉末(的质量分数为)中分别加入溶液充分搅拌,在相同时间内测得、两种不同温度下制氢率(实际制氢量占理论产氢量的百分比)随时间的变化如图-1所示。后时制氢率始终低于时制氢率的原因是。 (3)、不对称电解质电解制氢。以电解苯甲醇生成苯甲酸为例,其电解槽阴极区为酸性电解质进行析氢反应,阳极区为碱性电解质和苯甲醇。写出阳极发生的电极反应式:。(4)、肼催化分解制氢。在温和条件下,负载型双金属合金M催化肼迅速分解,并且制氢选择性可达 , 可能机理如图-2所示。
(3)、不对称电解质电解制氢。以电解苯甲醇生成苯甲酸为例,其电解槽阴极区为酸性电解质进行析氢反应,阳极区为碱性电解质和苯甲醇。写出阳极发生的电极反应式:。(4)、肼催化分解制氢。在温和条件下,负载型双金属合金M催化肼迅速分解,并且制氢选择性可达 , 可能机理如图-2所示。
①催化分解制氢的过程可描述为。
②的水溶液呈弱碱性。研究发现:向溶液中加入适量或 , 能明显促进上述催化分解反应的进行。其原因可能是。
28. 苯乙酸铜是合成优良催化剂、传感材料纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线: +H2O+H2SO4
+H2O+H2SO4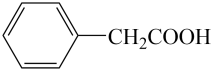 +NH4HSO4
+NH4HSO4 +Cu(OH)2
+Cu(OH)2 +H2O
+H2O制备苯乙酸的装置示意图(加热和夹持装置等略):
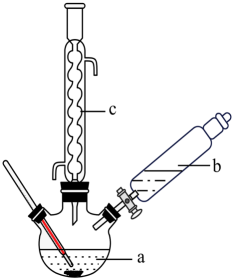
已知:苯乙酸
 的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:i.在250mL三颈烧瓶a中加入70mL70%的硫酸。
ii.将a中的溶液加热至100℃,缓缓滴加40g苯乙腈(
 )到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
)到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。iii.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。回答下列问题:
(1)、配制70%硫酸时,加入蒸馏水与浓硫酸的先后顺序是:先加 的后加。(2)、在装置中,仪器b的名称是 ; 仪器c的作用是。反应分离苯乙酸粗品时,加适量冷水的目的是。(3)、下列仪器中可用于分离苯乙酸粗品的是____ (填标号)。A、分液漏斗 B、漏斗 C、烧杯 D、直形冷凝管 E、玻璃棒(4)、最终得到41 g苯乙酸晶体,则苯乙酸的产率是% (结果保留小数点后两位数字)(5)、写出用CuCl2·2H2O和NaOH溶液制备Cu(OH)2沉淀的化学方程式:。(6)、某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置电解CuCl2·2H2O溶液,该电池的负极反应式为。 29. 全球变暖是人类行为造成地球气候变化的后果,随着石油、煤炭、木材等含“碳”自然资源的过度使用,导致地球暖化的“元凶”二氧化碳也制造得越来越多,减少二氧化碳排放刻不容缓。回答下列问题:(1)、二氧化碳可催化加氢以制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=。(2)、当二氧化碳和氢气起始投料比n(CO2):n(H2)=1:2时,在0.5MPa、2.5MPa、5MPa压强下,H2.的平衡转化率α随温度变化如图所示:
29. 全球变暖是人类行为造成地球气候变化的后果,随着石油、煤炭、木材等含“碳”自然资源的过度使用,导致地球暖化的“元凶”二氧化碳也制造得越来越多,减少二氧化碳排放刻不容缓。回答下列问题:(1)、二氧化碳可催化加氢以制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=。(2)、当二氧化碳和氢气起始投料比n(CO2):n(H2)=1:2时,在0.5MPa、2.5MPa、5MPa压强下,H2.的平衡转化率α随温度变化如图所示:
则反应在0.5MPa,550℃时的α= , 判断的依据是 , 影响α的因素有(答出一点即可)。
(3)、将组成(物质的量分数)为0.2mol CO2(g),0.6mol H2(g)和0.1mol N2(g)通入反应器,按(1)中的反应原理,在温度T,恒定压强为p的条件下反应,平衡时若H2的转化率为50%,则CH3OH(g)的压强为 , 平衡常数Kp=(以分压表示,分压=总压×气体物质的量分数)。(4)、根据相关文献报道,我国科学家设计了CO2熔盐捕获与电化学转化装置,原理如下图所示:
则b为电源极(填“正”或“负"),电路中转移0.4mol电子可捕获CO2的体积(标况下)为L。
30. 三氧化二砷(As2O3)可用于治疗急性早幼粒细胞白血病。利用某酸性含砷废水(含H3AsO3、H2SO4)可提取As2O3 , 提取工艺流程如下:
已知:①As2O3为酸性氧化物;②As2S3易溶于过量的Na2S溶液中,故加入FeSO4 , 的目的是除去过量的S2-。
回答下列问题:
(1)、废水中H3AsO3中砷元素的化合价为(2)、“焙烧”操作中,As2S3参与反应的化学方程式为(3)、“碱浸”的目的 , “滤渣Y”的主要成分是。(写化学式)。(4)、“氧化”操作的目的是(用离子方程式表示)。(5)、“还原”过程中H3AsO4转化为H3AsO3然后将“还原”后溶液加热,H3AsO3分解为As2O3。某次“还原”过程中制得了1.98kgAs2O3 , 则消耗标准状况下气体X的体积是L。(6)、砷酸钠(Na3AsO4)可用于可逆电池,装置如图1所示,其反应原理为AsO+2H++2I-=AsO+I2+H2O。探究pH对AsO氧化性的影响,测得输出电压与pH的关系如图2所示。则a点时,盐桥中K+(填“向左”“向右”或“不”)移动,c点时,负极的电极反应为。 31. 硫酸镍主要用于电镀、镍电池、催化剂以及制取其他镍盐等,并用于印染媒染剂、金属着色剂等。NiSO4·nH2O易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中回收制备NiSO4·nH2O和其它金属的工艺流程如下。
31. 硫酸镍主要用于电镀、镍电池、催化剂以及制取其他镍盐等,并用于印染媒染剂、金属着色剂等。NiSO4·nH2O易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中回收制备NiSO4·nH2O和其它金属的工艺流程如下。
已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RHNiR2+2H+。
回答下列问题:
(1)、“酸浸”时,为加快浸出速率,提高生产效益,降低生产成本,下列措施不合理的有____ (填标号)。A、搅拌 B、适当增大硫酸的浓度 C、对污泥进一步球磨粉碎(2)、“电解”时,铜的电解电压(U)较低,且电解速率很快,铁和铬存在形式随电解电压的变化如下表。为得到纯的NiSO4·nH2O,电解电压(U)的范围是(单位:V)。电解电压/V
1.0
1.2
1.5
2.0
2.5
3.0
3.5
Fe2+
有
有
有
无
无
无
无
Cr4+
无
无
无
无
无
有
有
(3)、萃取余液可在操作单元中循环利用(填选项),A.酸浸 B.调pH C.除Cr
反萃取剂X为 (填化学式)。
(4)、“反萃取”得到的NiSO4溶液,可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为。(5)、第三代混合动力车,可以用电动机,内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池。镍氢电池充放电原理如图1所示,根据所给信息判断,混合动力车上坡或加速时,乙电极的电极反应式为。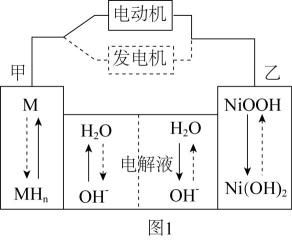 (6)、采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为。
(6)、采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为。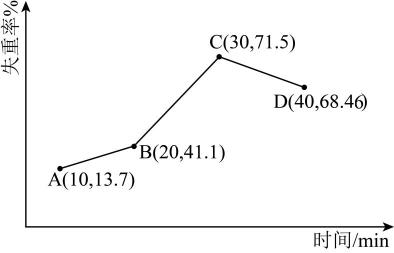 32. 合理处理金属垃圾既可以保护环境又可以节约资源。利用废旧镀锡铜线制备胆矾并回收锡的流程如下:
32. 合理处理金属垃圾既可以保护环境又可以节约资源。利用废旧镀锡铜线制备胆矾并回收锡的流程如下:
已知Sn2+容易水解。
回答下列问题:
(1)、加快“脱锡”速率的措施有(写出一点)。“操作I” 包含、、过滤、洗涤、干燥。(2)、“脱锡”过程中加入少量稀硫酸调控溶液pH,其目的是;硫酸铜浓度与脱锡率的关系如图所示,当浓度大于120g·L-1时,脱锡率下降的原因。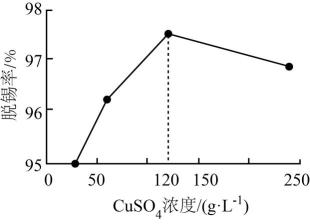 (3)、“脱锡液”中含有的离子主要为Cu2+、Sn2+、H+、SO , 以石墨为电极,通过控制溶液pH、电解时电压,可以依次回收铜、锡。电解时阳极反应式为; 当阴极出现的现象时,说明电解回收锡结束。(4)、“脱锡渣”溶于硫酸的离子方程式为。(5)、称量纯净的胆矾2.50g进行热重分析,实验测得胆矾的热重曲线如图所示。则120℃时所得固体的化学式为。
(3)、“脱锡液”中含有的离子主要为Cu2+、Sn2+、H+、SO , 以石墨为电极,通过控制溶液pH、电解时电压,可以依次回收铜、锡。电解时阳极反应式为; 当阴极出现的现象时,说明电解回收锡结束。(4)、“脱锡渣”溶于硫酸的离子方程式为。(5)、称量纯净的胆矾2.50g进行热重分析,实验测得胆矾的热重曲线如图所示。则120℃时所得固体的化学式为。 33. 综合利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:
33. 综合利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度及开始沉淀的pH
金属离子
浓度(mol·L-1)
开始沉淀pH
Fe2+
1.0×10-3
8.0
Fe3+
4.0×10-2
1.7
Zn2+
1.5
5.5
Ga3+
3.0×10-3
3.0
表2金属离子的萃取率
金属离子
萃取率(%)
Fe2+
0
Fe3+
99
Zn2+
0
Ga3+
97-98.5
(1)、Ga2(Fe2O4)3中Ga的化合价为 , “浸出”时其发生反应的离子方程式为。(2)、滤液1中可回收利用的物质是 , 滤饼的主要成分是;萃取前加入的固体X为。(3)、Ga与Al同主族,化学性质相似。反萃取后,镓的存在形式为 (填化学式)。(4)、电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为。(5)、GaN可采用MOCVD (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为。(6)、滤液1中残余的Ga3+的浓度为 mol·L-1 (写出计算过程)。34. 综合利用炼锌矿渣(主要含铁酸镓Ga2( Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓( GaN) ,部分工艺流程如下:
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度 及开始沉淀的pH
金属离子
浓度( mol· L-1)
开始沉淀pH
Fe2+
1.0×10-3
8.0
Fe3+
4.0×10-2
1.7
Zn2+
1.5
5.5
Ga3+
3.0×10-3
3.0
表2金属离子的萃取率
金属离子
萃取率(%)
Fe2+
0
Fe3+
99
Zn2+
0
Ga3+
97-98.5
(1)、“浸出”时ZnFe2O4发生反应的化学方程式为。(2)、滤液1中可回收利用的物质是 , 滤 饼的主要成分是;萃取前加入的固体X为 , 加入X的目的是。(3)、Ga与Al同主族,化学性质相似。反萃取后,镓的存在形式为(填化学式)。(4)、电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为。(5)、GaN可采用MOCVD (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为。(6)、滤液1中残余的Ga3+的浓度为mol·L-1。35. 葡萄糖、葡萄糖酸在医疗和工业上有广泛用途。(1)、锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。
回答下列问题:
已知:MnSO4·H2O易溶于水,不溶于乙醇。20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2 , Ksp(PbCO3)=7.4×10-14mol2·L-2 , 1.262≈1.6。
①“酸洗”过程中生成硫酸锌的离子方程式为;“还原酸浸”过程中主要反应的离子方程式为。
②实验室中获得MnSO4·H2O晶体的一系列操作是指蒸发结晶趁热过滤、洗涤、干燥,其中洗涤的具体操作是;将分离出晶体的母液收集、循环使用,其意义是。
③整个流程中可循环利用的物质是;加入Na2CO3溶液的目的是将PbSO4转化为PbCO3 , Na2CO3溶液的最小浓度为mol·L-1(保留一位小数);PbSO4(s)+(aq)⇌PbCO3(s)+(aq),平衡常数K=(列出计算式)。
(2)、工业上常采用电渗析法从含葡萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。
①交换膜1为交换膜(选填“阴离子”、“阳离子”);电路中通过2mol电子时,理论上回收gNaOH。
②b电极上发生反应的电极反应式为。