高考二轮复习知识点:反应热和焓变5
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列叙述正确的是( )A、使用催化剂能够降低化学反应的反应热(△H) B、金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 C、原电池中发生的反应达平衡时,该电池仍有电流产生 D、在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小2. 一定条件下, 可以将 置换出来,其转化的能量变化如下:

则在1538℃时,反应 的 为( )
A、 B、 C、 D、3. 已知键能:H—H键为 ,Br—Br键为 ,H—Br键为 。一定温度下,反应 的反应历程与能量的关系如图所示。下列叙述正确的是( ) A、该反应的正反应是放热反应 B、 ,加入催化剂时, 、 及 均减小 C、已知 ,若反应 ,则 D、升高温度,正逆反应速率均加快,且正反应速率加快的程度较大4. 已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,O-H为452.5,则断裂1 mol N-H所需的能量(kJ)是( )
A、该反应的正反应是放热反应 B、 ,加入催化剂时, 、 及 均减小 C、已知 ,若反应 ,则 D、升高温度,正逆反应速率均加快,且正反应速率加快的程度较大4. 已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,O-H为452.5,则断裂1 mol N-H所需的能量(kJ)是( ) A、194 B、316 C、391 D、6585. 碳酸钠晶体(Na2CO3·10H2O)失水可得到Na2CO3·H2O(s)或Na2CO3(s),两个化学反应的能量变化示意图如下:
A、194 B、316 C、391 D、6585. 碳酸钠晶体(Na2CO3·10H2O)失水可得到Na2CO3·H2O(s)或Na2CO3(s),两个化学反应的能量变化示意图如下:
下列说法正确的是( )
A、∆H1<0 B、碳酸钠晶体(Na2CO3·10H2O)失水不是化学变化 C、Na2CO3·H2O(s)失水生成Na2CO3(s):∆H=∆H1-∆H2 D、向Na2CO3(s)中滴加几滴水,温度升高6. CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO※+N2
第二步:FeO*+CO=Fe*+CO2
下列叙述错误的是( )
A、第一步反应比第二步反应快 B、上述两步反应的△H均小于0 C、Fe*是反应的催化剂 D、总反应为CO+N2O=N2+CO27. 依据图示关系,下列说法错误的是( ) A、反应①是吸热反应 B、△H3=△H1+△H2 C、反应③是一个熵增的反应 D、数据表明:V2O5(s)的能量比V2O4(s)低,更稳定8. 反应 在不同温度 时的平衡常数 如下:
A、反应①是吸热反应 B、△H3=△H1+△H2 C、反应③是一个熵增的反应 D、数据表明:V2O5(s)的能量比V2O4(s)低,更稳定8. 反应 在不同温度 时的平衡常数 如下:700
800
830
1000
1200
0.6
0.9
1.0
1.7
2.6
密闭容器中,某温度(T)、某时刻(t)时,反应混合物中M、N、P,Q的浓度分别为 、 、 、 。
下列说法正确的是( )
A、该反应 B、若 ,则t时刻反应向正反应方向进行 C、若t时刻反应达到化学平衡,则 D、当 达到化学平衡时,9. 人体内的血红蛋白(Hb)可与O2结合,更易与CO结合使人体中毒,涉及原理如下:①Hb(aq)+O2(g) HbO2(aq) ΔH1<0
②Hb(aq)+CO(g) HbCO(aq) ΔH2<0
③HbO2(aq)+CO(g) HbCO(aq)+O2(g) ΔH3<0
下列说法错误的是( )
A、ΔH1<ΔH2 B、反应①、②在一定温度下均能自发进行 C、刚从平原到高原时,人体血液中c(HbO2)将降低,使人体因缺氧而不适 D、将CO中毒的人转至高压氧仓中治疗,反应③平衡逆向移动而缓解症状10. CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg 与温度(t)的关系曲线如右图。下列说法正确的是( ) A、通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量 B、CO不适宜用于工业冶炼金属Cr C、CO还原PbO2的反应△H>0 D、工业冶炼金属Cu时,高温有利于提高CO的转化率11. 向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下:
A、通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量 B、CO不适宜用于工业冶炼金属Cr C、CO还原PbO2的反应△H>0 D、工业冶炼金属Cu时,高温有利于提高CO的转化率11. 向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下:
0
5
10
20
…
0.0
8.96
15.68
22.40
…
下列判断正确的是( )
A、反应ⅰ是放热反应 B、反应ⅱ是整个反应的决速步骤 C、 是 分解反应的催化剂 D、0~20 的平均反应速率:12. 和 是环境污染性气体,可在 表面转化为无害气体,其总反应为 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( ) A、 为氧化剂 B、 C、由图乙知该反应正反应的活化能小于逆反应的活化能 D、为了实现转化,需不断向反应器中补充 和13. 与HCl的加成反应由第一步 和第二步 组成,能量与反应历程如图所示。下列说法正确的是( )
A、 为氧化剂 B、 C、由图乙知该反应正反应的活化能小于逆反应的活化能 D、为了实现转化,需不断向反应器中补充 和13. 与HCl的加成反应由第一步 和第二步 组成,能量与反应历程如图所示。下列说法正确的是( ) A、两步反应均释放能量 B、第一步的反应速率比第二步的慢 C、第二步 与 的碰撞100%有效 D、总反应 的14. 已知正丁烷、异丁烷燃烧的热化学方程式分别为:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ·mol-1,(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2869kJ·mol-1 , 下列说法正确的是( )A、正丁烷分子储存的能量大于异丁烷分子 B、正丁烷的稳定性大于异丁烷 C、异丁烷转化为正丁烷的过程是一个放热过程 D、异丁烷和正丁烷属于同系物15. 下列说法正确的是( )A、分子式为C2H6O的有机化合物性质相同 B、相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a: ,途径b: C、在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 D、通过化学变化可以直接将水转变为汽油16. 根据下列图示所得出的结论正确的是( )A、
A、两步反应均释放能量 B、第一步的反应速率比第二步的慢 C、第二步 与 的碰撞100%有效 D、总反应 的14. 已知正丁烷、异丁烷燃烧的热化学方程式分别为:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ·mol-1,(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2869kJ·mol-1 , 下列说法正确的是( )A、正丁烷分子储存的能量大于异丁烷分子 B、正丁烷的稳定性大于异丁烷 C、异丁烷转化为正丁烷的过程是一个放热过程 D、异丁烷和正丁烷属于同系物15. 下列说法正确的是( )A、分子式为C2H6O的有机化合物性质相同 B、相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a: ,途径b: C、在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 D、通过化学变化可以直接将水转变为汽油16. 根据下列图示所得出的结论正确的是( )A、 图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
B、
图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
B、 图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg 的变化关系,则a=2
C、
图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg 的变化关系,则a=2
C、 图丙表示密闭容器中CH4(g)+H2O(g) CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
D、
图丙表示密闭容器中CH4(g)+H2O(g) CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
D、 图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
二、多选题
-
17. FeCl3(aq)与KSCN(aq)混合时平衡:Fe3+(aq)+SCN﹣(aq)⇌Fe(SCN)2+(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如图所示,则下列说法正确的是( )
 A、FeCl3(aq)与KSCN(aq)反应是放热反应 B、温度为T1、T2时,反应的平衡常数分别为K1、K2 , 则K1<K2 C、反应处于D点时,一定有V正>V逆 D、A点与B点相比,A点的c(Fe3+)大18. 反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
A、FeCl3(aq)与KSCN(aq)反应是放热反应 B、温度为T1、T2时,反应的平衡常数分别为K1、K2 , 则K1<K2 C、反应处于D点时,一定有V正>V逆 D、A点与B点相比,A点的c(Fe3+)大18. 反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( ) A、该反应是放热反应 B、加入催化剂后,反应加快,△E减小 C、反应物的总键能大于生成物的总键能 D、反应达到平衡时,升高温度,A的转化率增大19. 下列有关说法正确的是( )A、一定温度下,反应 MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0 B、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 C、0.1mol•L﹣1CH3COOH溶液加水稀释,溶液的pH和CH3COOH的电离度均增大 D、将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色逐渐褪去,说明BaCl2溶液显酸性20. 已知反应:①2C(s)+O2(g)=2CO(g)△H=﹣221kJ/mol
A、该反应是放热反应 B、加入催化剂后,反应加快,△E减小 C、反应物的总键能大于生成物的总键能 D、反应达到平衡时,升高温度,A的转化率增大19. 下列有关说法正确的是( )A、一定温度下,反应 MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0 B、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 C、0.1mol•L﹣1CH3COOH溶液加水稀释,溶液的pH和CH3COOH的电离度均增大 D、将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色逐渐褪去,说明BaCl2溶液显酸性20. 已知反应:①2C(s)+O2(g)=2CO(g)△H=﹣221kJ/mol②稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ/mol B、①的反应热为221 kJ/mol C、稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量21. 下列说法正确的是( )A、3C(s)+CaC(s)⇌CaC2 (s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 B、CH3COOH溶液加水稀释后,溶液中 的值增大 C、恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣aKJ/mol,平衡时向容器中在充入一定量的NH3 , 重新达到平衡时a值不变 D、C(s)+H2O(g)⇌CO(g)+H2(g) (△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动22. 已知,氧气与不同聚集状态的硫单质反应的热化学方程式如下:①S(s)+O2(g)=SO2(g)△H=a kJ/mol;
②S(g)+O2(g)=SO2(g)△H=b kJ/mol;
对于a和b的关系,下列说法正确的是( )
A、a>0,b>0 B、a<0,b<0 C、a>b D、a<b23. (多选)某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( ) A、该反应为吸热反应 B、催化剂能改变反应的焓变 C、催化剂能降低反应的活化能 D、逆反应的活化能大于正反应的活化能24. 25℃、101kPa 下:
A、该反应为吸热反应 B、催化剂能改变反应的焓变 C、催化剂能降低反应的活化能 D、逆反应的活化能大于正反应的活化能24. 25℃、101kPa 下:①2Na(s)+ O2(g)═Na2O(s)△H1=﹣414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=﹣511KJ/mol
下列说法正确的是( )
A、①和②产物的阴阳离子个数比不相等 B、①和②生成等物质的量的产物,转移电子数不同 C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 D、25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=﹣317kJ/mol三、非选择题
-
25.
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
 (1)、与汽油相比,氢气作为燃料的优点是(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: .(2)、氢气可用于制备H2O2 . 已知:
(1)、与汽油相比,氢气作为燃料的优点是(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: .(2)、氢气可用于制备H2O2 . 已知:H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=0(填“>”或“=”)
(3)、在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)⇌MHx+2y(s)△H<0达到化学平衡.下列有关叙述正确的是a.容器内气体压强保持不变
b.吸收ymol H2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
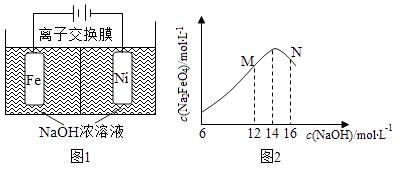
(4)、利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 .(5)、化工生产的副产氢也是氢气的来源,电解法制取有广泛用途的Na2FeO4 . 同时获得氢气:Fe+2H2O+2OH﹣→FeO42﹣+3H2↑,装置如图所示,装置通电后,铁电极附近生成紫红色FeO42﹣ , 镍电极有气泡产生.若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.
①电解一段时间后,c(OH﹣)降低的区域在(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为 .
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因 .
26. 汽车等交通工具为出行、物流等带来方便。然而,燃油车排放的汽车尾气中含有大量的有害物质,会对人体健康和环境产生危害。(1)、汽油在不同空燃比(空气与燃油气的体积比)时尾气的主要成分不同,空燃比较小时的有毒气体主要是(填化学式)(2)、辛烷(C8H18)是汽油的主要成分之一,已知辛烷的燃烧热 , 请写出表示辛烷燃烧热的热化学方程式。(3)、空气中的氮气和氧气在汽车汽缸内的高温环境下,通过电火花放电生成有毒气体NO,反应的热化学方程式: 。已知:N2、O2分子中化学键的键能分别是946、497。请计算NO分子中化学键的键能为。(4)、为减轻污染,现在汽车上都安装三元催化转化器,可实现反应: 。则该反应在(填“高温”、“低温”或“任何温度”)下能自发进行。(5)、将NO和CO以一定的流速通过两种不同的催化剂进行反应,经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。
以下说法错误的是____。
A、曲线②中催化剂脱氮率比曲线①中的高 B、曲线②中的催化剂适用于450℃左右脱氢 C、曲线①、②最高点表示此时平衡转化率 D、若低于200℃,图中曲线①脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高27. 研究化学反应过程与能量变化的关系具有重要意义。回答下列问题:(1)、CO2和NH3合成尿素[CO(NH2)2]的能量变化如图1所示,写出该反应的热化学方程式:。 (2)、C6H6(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以测量,原因是。已知CO的燃烧热,还需要的一组数据是(写出热化学方程式,焓变用△H表示)。(3)、H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图1,在图3中画出该反应的能量一反应历程曲线图(标出该反应的焓变)。
(2)、C6H6(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以测量,原因是。已知CO的燃烧热,还需要的一组数据是(写出热化学方程式,焓变用△H表示)。(3)、H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图1,在图3中画出该反应的能量一反应历程曲线图(标出该反应的焓变)。 (4)、图4表示VIA族的O、S、Se、Te在生成1mol气态氢化物时的焓变数据,根据数据可确定c代表(填元素符号)的氢化物,写出H2Te发生分解反应的热化学方程式:。
(4)、图4表示VIA族的O、S、Se、Te在生成1mol气态氢化物时的焓变数据,根据数据可确定c代表(填元素符号)的氢化物,写出H2Te发生分解反应的热化学方程式:。 (5)、已知:S8(s)+8O2(g)=8SO2(g) △H=-8akJ•mol-1;1个S8分子中有8个硫硫键,1个SO2分子中有2个硫氧键;破坏1mol硫氧键、1mol氧氧键所需能量分别为bkJ、ckJ,则生成1mol硫硫键所释放能量为。28. 将捕集的转化合成气可有效实现碳资源的综合充分利用。
(5)、已知:S8(s)+8O2(g)=8SO2(g) △H=-8akJ•mol-1;1个S8分子中有8个硫硫键,1个SO2分子中有2个硫氧键;破坏1mol硫氧键、1mol氧氧键所需能量分别为bkJ、ckJ,则生成1mol硫硫键所释放能量为。28. 将捕集的转化合成气可有效实现碳资源的综合充分利用。方法I:热催化制备合成气:一定条件下用甲烷还原制备合成气。
相关化学键的键能数据
化学键
键能
745
414
1046
436
(1)、反应的热化学方程式是: , 该反应为(填“吸热”或“放热”)反应。平衡常数表达式。(2)、已知某一温度时 , 测得某时刻反应混合物中的浓度分别为 , 则此刻上述反应的平衡移动方向为(填“正向移动”“逆向移动”或“不移动”)。(3)、热力学分析表明时易发生的歧化反应和以上易发生的裂解反应(方程式如下所示),一段时间后基催化剂的催化效果会明显下降,其原因是。方法II:加氢备合成气:将原料气与按一定比例在催化剂作用下发生反应a,同时伴随反应b发生,反应方程式如下所示。
反应a:
反应b:
(4)、将原料气按置于恒容密闭容器中发生反应,在相同时间内测得平衡时各组分摩尔分数与温度的变化曲线如图所示,则制合成气适宜的温度为。 (5)、理论上,能提高平衡转化率的措施有(写出一条即可)。29. 完成下列问题(1)、保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促使燃料循环使用的构想,其原理如图所示。回答下列问题:
(5)、理论上,能提高平衡转化率的措施有(写出一条即可)。29. 完成下列问题(1)、保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促使燃料循环使用的构想,其原理如图所示。回答下列问题:
①过程Ⅰ发生的反应为反应(填“吸热”或“放热”),反应过程中能量的主要转化形式为;
②上述转化过程中,△H1+△H20(填“>”“<”或“=”)。
(2)、以NH3、CO2为原料生产尿素[CO(NH2)2]的反应历程与能量变化如图所示。回答下列问题:
①以NH3、CO2为原料生产尿素[CO(NH2)2]的热化学方程式为;
②从图像分析该反应分两步进行,则决定生产尿素的总反应速率的步骤是第步反应(填“一”或“二”)。
(3)、已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544 kJ/mol的部分键能数据如下表所示:化学键
N-N
O=O
N≡N
键能(kJ/mol)
193
497
946
①物质的稳定性O2(g)N2(g)(填“>”“<”或“=”);
②若H2O(l)=H2O(g) △H=+44 kJ/mol,则N2H4(g)的燃烧热为;
③已知:N2(g)+2O2(g)=2NO2(g) △H=+68 kJ/mol,则N2H4(g)和NO2(g)反应生成氮气和水蒸气的热化学方程式为。
30. 甲醇是重要的化工原料,可以使用多种方法制备甲醇。科学家利用CO或和都能合成甲醇,同时有利于减少二氧化碳的排放。已知在一定温度和压强下,发生如下反应:(1)、则反应 。(2)、利用反应合成甲醇。T℃时向固定容积的密闭容器中充入CO、H2 , 反应到t时刻测得各组分的浓度如下:物质
浓度
0.60
0.40
1.20
1.20
如果该反应的平衡常数 , 比较t时刻正、逆反应速率的大小:v正v逆(填“大于”“小于”或“等于”)。
(3)、向1L的恒容密闭容器中按物质的量之比1∶2充入一定量CO和 , 在催化剂的作用下合成甲醇,测得平衡时混合物中的体积分数在不同压强下随温度的变化如图甲所示。(已知时最初充入1mol CO。)
①下列说法正确的是。
A.该反应的
B.反应速率:
C.A、B、C的平衡常数大小:
D.在压强为下,反应经过5min达到B点的平衡状态,则
②D点时反应的平衡常数K=。
(4)、T℃时向恒容密闭容器中充入和 , 发生反应 , 在使用不同催化剂时,相同时间内测得的转化率随温度的变化如下图所示:
①c点转化率比a点低的原因是。
②下列措施有利于提高转化为的平衡转化率的有。
A.恒容条件下充入稀有气体He
B.在达到平衡后的体系中移出部分甲醇
C.保持反应容器的体积不变,平衡时再按照原投料比投入一定量的原料
D.选择催化效率更高的催化剂
③维持温度足够长时间,则的转化率a(填“大于”“小于”或“等于”)。
31. 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。(1)、下列变化过程属于吸热反应的是(填序号)。①浓硫酸稀释②酸碱中和反应③炭在O2中燃烧④煅烧石灰石⑤C与水蒸气反应制取水煤气⑥锌和稀硫酸反应制取H2⑦C还原CO2
(2)、①1mol乙烯在氧气中完全燃烧生成气态水过程的能量变化如图所示:
已知:H2O(l)=H2O(g) △H=+44kJ•mol-1 , 则C2H4(g)+3O2(g)=2CO2(g)+2H2O(1),的△H=。
②键能是指气态基态原子形成1mol化学键释放的最低能量。已知部分化学键的键能如表所示,通过计算可得x=。
化学键
C=C
C-H
O=O
C=O
O-H
键能/(kJ•mol-1)
x
413
498
799
467
(3)、已知反应I:C2H4(g)+H2(g)=C2H6(g) △H1反应II:C2H6(g)+O2(g)=2CO2(g)+3H2O(1) △H2
反应III:C2H4(g)+3O2(g)=2CO2(g)+2H2O(1) △H3
则△H1+△H2△H3(填“<”“>”或“=”)。
32. 填空。(1)、如图(图中物质均为气态)是和反应生成和的过程中能量变化示意图,写出和反应的热化学方程式。 (2)、(主要指和)是大气主要污染物之一、有效去除大气中的是环境保护的重要课题。用水吸收的相关热化学方程式如下:
(2)、(主要指和)是大气主要污染物之一、有效去除大气中的是环境保护的重要课题。用水吸收的相关热化学方程式如下:反应的。
33. 锰及其化合物在催化剂及金属材料方面有重要的应用。(1)、金属锰常用铝热法由软锰矿还原制得。因铝与软锰矿反应过于激烈,故先将软锰矿加强热使之转变为 , 然后与铝粉混合高温燃烧,具体反应如下ⅰ. , ⅱ.。
①写出第ⅱ步反应的化学方程式。
②锰基催化剂可用于催化加氢合成乙烯,其中部分反应历程如图1。则反应的焓变为(列式用字母表示),该反应自发进行的条件是(填“高温”“低温”或“任意温度”)。
 (2)、EDTA即乙二胺四乙酸,简写为(
(2)、EDTA即乙二胺四乙酸,简写为( , ),因能与众多金属离子络合而在化学分析与测定中有广泛应用。
, ),因能与众多金属离子络合而在化学分析与测定中有广泛应用。
①EDTA在水溶液中总共有六级离解平衡,相当于六元酸。室温时其各种存在形式的分布系数随pH值的变化关系如图2所示,下列说法不正确的是( )

A.EDTA在水溶液中有七种存在形式
B.室温时,的电离常数
C.向溶液中加入少量NaOH固体,平衡的值增大
D.等浓度的和按体积比约1:9可配成pH≈0的缓冲溶液
②20℃时,测得EDTA溶液中与pH值的关系如图3所示:(其中表示的平衡浓度,表示EDTA除外其它存在形式的浓度之和)

已知EDTA与的络合反应为: , 。工业上利用该反应回收水溶液中的Mn2+。数据表明,溶液中的存在会降低EDTA与金属离子的络合能力,试从平衡移动的角度解释原因。化学上常用条件稳定常数来描述金属离子M2+与EDTA络合产物的稳定性,(已知 , 其中c(Y)表示EDTA所有存在形式的总浓度),现实验室通过将一定浓度的EDTA溶液与0.02mol/L的溶液等体积混合来模拟回收 , 充分反应后测得溶液pH=4.2,mol/L,计算此时的条件稳定常数 , 溶液中剩余的“浓度为。
34. 乙苯是一种用途广泛的有机原料,可制备多种化工产品。(1)、(一)制备苯乙烯(原理如反应I所示):Ⅰ.
 △H=+124kJ·mol-1
△H=+124kJ·mol-1部分化学键的键能如下表所示:
化学键
C-H
C-C
C=C
H-H
键能/ KJ/mol
412
348
X
436
根据反应I的能量变化,计算X=。
(2)、工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。请用化学平衡理论解释通入水蒸气的原因:。(3)、已知吉布斯自由能△G=△H-T△S ,当△G < 0时反应可自发进行。由此判断反应I在(填“高温”或“低温”)更易自发进行。(4)、(二)制备α-氯乙基苯(原理如反应Ⅱ所示):Ⅱ.
 △H2>0
△H2>0T℃时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、 α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0—2 min内,以HCl表示的该反应速率v(HCl)=。
②6 min时,改变的外界条件为 , 该条件下的平衡常数K的数值=。
③10 min时,保持其他条件不变,再向容器中充入1 mol乙苯、1 mol Cl2、1 molα-氯乙基苯和1mol HCl,则此时该反应v正v逆(填“>”、“<”或“=” );若12 min时反应再次达到平衡,则在0-12 min内,Cl2的转化率α=。(计算结果保留三位有效数字)
35. 汽车尾气主要含有一氧化碳、一氧化氮等物质,是造成城市空气污染的主要因素之一。请回答下列问题:(1)、已知汽缸中氮气和氧气反应生成一氧化氮的䏍量变化值如下图所示,则由该反应生成1 mol NO时,应(填“释放”或“吸收”)kJ能量。 (2)、通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图1所示:
(2)、通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图1所示:
①NiO电极上发生的是反应(填“氧化”或“还原”)。
②外电路中,电子流动方向是从电极㳘向电极(填“NiO”或“Pt”)。
③NiO电极上的电极反应式为。
(3)、在恒温恒容的密闭容器中,充入等物质的量的和混合气体,发生如下反应: , t0时达到平衡,测得反应过程中的体积分数与时间的关系如图所示。
①比较大小:a处v正b处v逆(填“>”“<”或“=”)
②CO的平衡转化率为。
③能说明上述反应达到平衡状态的是(填字母)。
A.的浓度与浓度均不再变化 B.混合气体密度保持不变
C.反应容器内压强保持不变 D.和的浓度之比保持不变
36. 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:
(1)、在C和的反应体系中:反应1
反应2
反应3
①
②设 , 反应1、2和3的y随温度的变化关系如图所示。图中的线条b对应的是反应。

③一定压强下,随着温度的升高,气体中与的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
(2)、一氧化碳变换反应:。①一定温度下,反应后测得各组分的平衡压强(已知温度相同时气体压强之比等于浓度之比):、、和 , 则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使的平衡转化率提高到 , 则原料气中水蒸气和的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中不合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强 C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如下图所示,写出步骤Ⅱ的反应方程式。

步骤Ⅰ:;
步骤Ⅱ:
从图中可以看出使用催化剂能加快化学反应速率的原因是。