高考二轮复习知识点:反应热和焓变4
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 卤代烃与端基炔(R'C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
 A、偶联反应中起催化作用的是M和CuI B、R'C≡CCu为该催化过程的中间产物 C、该偶联反应的原理为R'C≡CH+RI→R'C≡CR+HI D、该催化机理改变了反应路径和反应热2. 十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“ ”脱氢过程释放氢气。下列说法正确的是( )
A、偶联反应中起催化作用的是M和CuI B、R'C≡CCu为该催化过程的中间产物 C、该偶联反应的原理为R'C≡CH+RI→R'C≡CR+HI D、该催化机理改变了反应路径和反应热2. 十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“ ”脱氢过程释放氢气。下列说法正确的是( ) A、总反应的 B、C10H18(l)的脱氢过程中,不会有大量中间产物C10H12(l) C、十氢萘脱氢的总反应速率由第二步反应决定 D、选择合适的催化剂不能改变Ea1、Ea2的大小3. 反应A+B→C分两步进行:反应①A+B→X,反应②X→C。反应过程中能量变化如图,下列说法正确的是( )
A、总反应的 B、C10H18(l)的脱氢过程中,不会有大量中间产物C10H12(l) C、十氢萘脱氢的总反应速率由第二步反应决定 D、选择合适的催化剂不能改变Ea1、Ea2的大小3. 反应A+B→C分两步进行:反应①A+B→X,反应②X→C。反应过程中能量变化如图,下列说法正确的是( ) A、该反应为放热反应,△H=a-d B、催化剂通过降低化学反应的焓变加快化学反应速率 C、升高温度,a、b、c、d的数值均会发生改变 D、该反应速率的快慢主要由反应②决定4. 一定温度下,某定容密闭容器中充入 和 ,发生反应: ,其能量变化如图所示。由图可知( )
A、该反应为放热反应,△H=a-d B、催化剂通过降低化学反应的焓变加快化学反应速率 C、升高温度,a、b、c、d的数值均会发生改变 D、该反应速率的快慢主要由反应②决定4. 一定温度下,某定容密闭容器中充入 和 ,发生反应: ,其能量变化如图所示。由图可知( ) A、该反应的 B、使用催化剂可以改变该反应的 C、断键吸收总能量小于成键释放总能量 D、若容器中气体密度不变,则反应达到化学平衡状态5. 已知 转化为 和 分步进行:① ,② ,其反应过程能量变化如图所示,下列说法错误的是( )
A、该反应的 B、使用催化剂可以改变该反应的 C、断键吸收总能量小于成键释放总能量 D、若容器中气体密度不变,则反应达到化学平衡状态5. 已知 转化为 和 分步进行:① ,② ,其反应过程能量变化如图所示,下列说法错误的是( )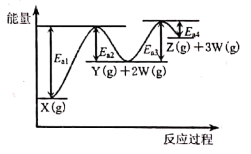 A、Ea1是反应①的活化能 B、 的能量一定低于 的能量 C、 D、反应②更容易发生,气体 很难大量累积6. 根据碘与氢气反应的热化学方程式(碘为气态或固态),下列判断正确的是( )
A、Ea1是反应①的活化能 B、 的能量一定低于 的能量 C、 D、反应②更容易发生,气体 很难大量累积6. 根据碘与氢气反应的热化学方程式(碘为气态或固态),下列判断正确的是( )(ⅰ)I2(?)+H2(g) 2HI(g)+9.48 kJ (ⅱ)I2(?)+H2(g) 2HI(g)-26.48 kJ
A、ⅰ中碘为气态,ⅱ中碘为固态 B、反应(ⅰ)的产物比反应(ⅱ)的产物稳定 C、1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ D、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ7. 已知共价键的键能与热化学方程式信息如下表:共价键
键能/( )
436
463
热化学方程式
则 的Q为( )
A、428 B、-428 C、498 D、-4988. 恒温密闭容器中加入一定量的A,发生反应 ( ),达到平衡。以下分析正确的是( )A、加入少量B,平衡就会逆向移动 B、达到平衡的标志之一: C、若开始时向容器中加入1 A,达到平衡时吸收热量Q D、缩小容器体积,重新达到平衡时, 的浓度与原平衡浓度相等9. 已知: 。不同情况下反应过程的能量变化如图。下列结论正确的是( ) A、1mol (g)和3mol (g)混合后反应,放出Q kJ热量 B、催化剂可以改变反应途径,缩短达到平衡的时间 C、当生成的水为液态时,Q值减小 D、催化剂不同,反应的热效应不同10. I2(s)+ H2(g)⇌2HI(g)能量变化如图所示,有关叙述错误的是( )
A、1mol (g)和3mol (g)混合后反应,放出Q kJ热量 B、催化剂可以改变反应途径,缩短达到平衡的时间 C、当生成的水为液态时,Q值减小 D、催化剂不同,反应的热效应不同10. I2(s)+ H2(g)⇌2HI(g)能量变化如图所示,有关叙述错误的是( ) A、正反应为吸热反应 B、该反应的反应热为E2-E1 C、加入催化剂,E1、E2都不变 D、若I2为气态,则该反应热大于E2-E111. 碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
A、正反应为吸热反应 B、该反应的反应热为E2-E1 C、加入催化剂,E1、E2都不变 D、若I2为气态,则该反应热大于E2-E111. 碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:①H2(g) + I2(?) 2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
下列判断正确的是( )
A、①中的I2为固态,②中的I2为气态 B、②的反应物总能量比①的反应物总能量低 C、①的产物比反应②的产物热稳定性更好 D、1mol 固态碘升华时将吸热17kJ12. 已知Fe3+能催化H2O2分解,2H2O2(aq) = 2H2O(l)+O2(g)的反应机理及反应进程中的能量变化如下:步骤①:2Fe3+(aq)+H2O2(aq)=2Fe2+(aq)+O2(g)+2H+(aq)步骤②:

下列有关H2O2分解反应说法错误的是( )
A、v(H2O2)=2v(O2) B、该反应的△H<0 C、增大Fe3+的浓度能够加快反应速率 D、若不加Fe3+ , 正反应的活化能比逆反应大13. 1,3-丁二烯和Br2以物质的量之比为1:1发生加成反应分两步:第一步Br+进攻1,3-丁二烯生成中间体C(溴正离子);第二步Br-进攻中间体C完成1,2-加成或1,4-加成。反应过程中的能量变化如下图所示,下列说法正确的是( )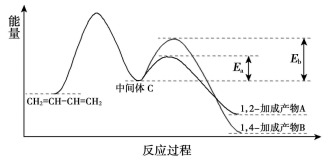 A、其它条件相同时,生成产物B的速率快于产物A的速率 B、升高温度,1,3-丁二烯的平衡转化率增大 C、该加成反应的反应热为Eb-Ea D、该反应的速率主要取决于第一步反应的快慢14. M和N转化为P的催化反应历程如图。下列说法错误的是( )
A、其它条件相同时,生成产物B的速率快于产物A的速率 B、升高温度,1,3-丁二烯的平衡转化率增大 C、该加成反应的反应热为Eb-Ea D、该反应的速率主要取决于第一步反应的快慢14. M和N转化为P的催化反应历程如图。下列说法错误的是( ) A、生活中常用P除水垢 B、催化剂能改变反应速率同时也能改变反应的焓变 C、M和N转化为P是一个放热反应 D、该反应有利于治理温室效应15. NH3和NO是有毒气体,在一定条件下它们可通过反应转化为无害的N2和H2O。已知:断开1 mol N≡N、1 mol N-H、1 mol N=O、1 mol H-O的键能分别为:946 kJ/mol、391 kJ/mol、607 kJ/mol、464 kJ/ mol。则该反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)的反应热△H为( )A、-1964 kJ·mol-1 B、+430 kJ·mol-1 C、-1780 kJ·mol-1 D、-450 kJ·mol-1
A、生活中常用P除水垢 B、催化剂能改变反应速率同时也能改变反应的焓变 C、M和N转化为P是一个放热反应 D、该反应有利于治理温室效应15. NH3和NO是有毒气体,在一定条件下它们可通过反应转化为无害的N2和H2O。已知:断开1 mol N≡N、1 mol N-H、1 mol N=O、1 mol H-O的键能分别为:946 kJ/mol、391 kJ/mol、607 kJ/mol、464 kJ/ mol。则该反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)的反应热△H为( )A、-1964 kJ·mol-1 B、+430 kJ·mol-1 C、-1780 kJ·mol-1 D、-450 kJ·mol-1二、多选题
-
16.
由反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
 A、由X→Y反应的△H=E5﹣E2 B、由X→Z反应的△H<0 C、降低压强有利于提高Y的产率 D、升高温度有利于提高Z的产率17. 下列有关说法正确的是( )A、加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 B、向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42﹣ C、在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 D、298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<018. 如图图示与对应的叙述相符的是( )
A、由X→Y反应的△H=E5﹣E2 B、由X→Z反应的△H<0 C、降低压强有利于提高Y的产率 D、升高温度有利于提高Z的产率17. 下列有关说法正确的是( )A、加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 B、向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42﹣ C、在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 D、298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<018. 如图图示与对应的叙述相符的是( ) A、图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 B、图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A C、图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 D、图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 mol•L﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系19. 下列说法正确的是( )A、对于反应:H2(g)+Cl2(g)=2HCl (g)△H=﹣a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 B、2MnO(s)+O2(g)═2MnO2(s),该反应在低温下能自发进行,则其△H<0 C、用干燥的pH试纸测得某氯水的pH=3.1 D、航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀20. 已知:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
A、图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 B、图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A C、图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 D、图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 mol•L﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系19. 下列说法正确的是( )A、对于反应:H2(g)+Cl2(g)=2HCl (g)△H=﹣a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 B、2MnO(s)+O2(g)═2MnO2(s),该反应在低温下能自发进行,则其△H<0 C、用干燥的pH试纸测得某氯水的pH=3.1 D、航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀20. 已知:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣12CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1 452kJ•mol﹣1
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1
下列说法正确的是( )
A、H2(g)的燃烧热为571.6 kJ•mol﹣1 B、0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=﹣57.3 kJ•mol﹣1 C、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 D、3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol﹣121. 2019年9月我国科研人员研制出Ti—H—Fe双温区催化剂,其中Ti—H区域和Fe区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用标注。下列说法正确的是( ) A、能量变化最大的过程中发生了N≡N断裂 B、过程②③处于高温区域;过程⑤处于低温区域 C、过程④表示N原子由Fe区域向Ti—H区域传递 D、使用双温区催化合成氨,使合成氨反应转化为吸热反应22. 在容积为2L的刚性密闭容器中加入1molCO2和3molH2 , 发生反应:CO2(g)+3H2(g) (g)+H2O(g)。在其他条件不变的情况下,温度对反应的影响如图所示(注:T1、T2均大于300℃)。下列说法正确的是( )
A、能量变化最大的过程中发生了N≡N断裂 B、过程②③处于高温区域;过程⑤处于低温区域 C、过程④表示N原子由Fe区域向Ti—H区域传递 D、使用双温区催化合成氨,使合成氨反应转化为吸热反应22. 在容积为2L的刚性密闭容器中加入1molCO2和3molH2 , 发生反应:CO2(g)+3H2(g) (g)+H2O(g)。在其他条件不变的情况下,温度对反应的影响如图所示(注:T1、T2均大于300℃)。下列说法正确的是( ) A、该反应的△H<0 B、处于A点的反应体系从T1变到T2 , 达到平衡时化学平衡常数增大 C、T2时,反应达到平衡时消耗H2的平均反应速率v(H2)= mol·L-1·min-1 D、T2时,该反应的化学平衡常数为23. 下列说法正确的是( )A、电解法精炼铜时,以粗铜作阳极,纯铜作阴极 B、氢氧燃料电池放电时化学能全部转化为电能 C、Na2O2与水反应产生1molO2 , 转移的电子数约为2×6.02×1023 D、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的∆H>024. 下列有关说法中正确的是( )A、保持温度不变,向稀氨水中缓慢通入 CO2 , 溶液中 c(OH-)/c(NH3⋅H2O)的值增大 B、室温下,用 pH 均为 2 的盐酸和醋酸分别中和等物质的量的 NaOH,消耗醋酸的体积更小 C、一定温度下,反应 CO(g)+3H2(g)═CH4(g)+H2O(g)能自发进行,该反应的△H<0 D、反应 NH4NO3 N2O↑+2H2O,生成 11.2 L N2O 转移电子数为 2×6.02×102325. 下列关于热化学反应的描述中正确的是( )A、吸热反应不一定需要加热才能发生 B、CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)△H=2×283.0 kJ/mol C、HCl和NaOH反应的中加热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol D、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
A、该反应的△H<0 B、处于A点的反应体系从T1变到T2 , 达到平衡时化学平衡常数增大 C、T2时,反应达到平衡时消耗H2的平均反应速率v(H2)= mol·L-1·min-1 D、T2时,该反应的化学平衡常数为23. 下列说法正确的是( )A、电解法精炼铜时,以粗铜作阳极,纯铜作阴极 B、氢氧燃料电池放电时化学能全部转化为电能 C、Na2O2与水反应产生1molO2 , 转移的电子数约为2×6.02×1023 D、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的∆H>024. 下列有关说法中正确的是( )A、保持温度不变,向稀氨水中缓慢通入 CO2 , 溶液中 c(OH-)/c(NH3⋅H2O)的值增大 B、室温下,用 pH 均为 2 的盐酸和醋酸分别中和等物质的量的 NaOH,消耗醋酸的体积更小 C、一定温度下,反应 CO(g)+3H2(g)═CH4(g)+H2O(g)能自发进行,该反应的△H<0 D、反应 NH4NO3 N2O↑+2H2O,生成 11.2 L N2O 转移电子数为 2×6.02×102325. 下列关于热化学反应的描述中正确的是( )A、吸热反应不一定需要加热才能发生 B、CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)△H=2×283.0 kJ/mol C、HCl和NaOH反应的中加热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol D、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热三、非选择题
-
26. 煤燃烧排放的烟含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:(1)、NaClO2的化学名称为 .(2)、在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10﹣3mol•L﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子
SO42﹣
SO32﹣
NO3﹣
NO2﹣
Cl﹣
c/(mol•L﹣1)
8.35×10﹣4
6.87×10﹣6
1.5×10﹣4
1.2×10﹣5
3.4×10﹣3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 . 增加压强,NO的转化率(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是 .
(3)、在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压p0如图所示.

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”、“不变”或“减小”).
②反应ClO2﹣+2SO32﹣═2SO42﹣+Cl﹣的平衡常数K表达式为 .
(4)、如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
②已知下列反应:
SO2(g)+2OH﹣(aq)═SO32﹣(aq)+H2O(l)△H1
ClO﹣(aq)+SO32﹣(aq)═SO42﹣(aq)+Cl﹣(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42﹣(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO﹣(aq)+2OH﹣(aq)═CaSO4(s)+H2O(l)+Cl﹣(aq)的△H= .
27. 化学反应过程中既有物质变化,又有能量变化。释放或吸收热量是化学反应中能量变化的主要形式之一(1)、甲烷具有较大的燃烧热(),是常见燃料。请写出甲烷燃烧的热化学反应方程式。(2)、①工业上高纯硅可通过下列反应制取: 该反应的反应热。已知:
化学键
Si-Cl
H-H
H-Cl
Si-Si
键能/
360
436
431
176
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。
 (3)、自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图-2所示。
(3)、自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图-2所示。实验编号
反应物组成
a
0.20gCaO粉末、5.0mL
b
0.15gAl粉、5.0mL
c
0.15gAl粉、5.0mL饱和石灰水
d
0.15gAl粉、5.0mL石灰乳
e
0.15gAl粉、0.20gCaO粉末 5.0mL

已知:I.
II.
III.
①实验b中,的变化说明Al粉与在该条件下(填“反应”或“不反应”)。
②实验c中,前3min的有变化,其原因是;3min后基本不变,其原因是。
③实验d在10min内温度持续升高的原因是。
④实验e中发生的总反应可表示为: , 其。
五组实验对比,e放热效果最好。
28. 武汉大学课题组报道了一种氯化镁循环法(MCC),在常压下利用和合成氨。MCC法各步骤反应方程式如下:①
②
③
④
⑤
(1)、法合成氨反应的(填“>”或“”)0。在该循环法中气态中间产物有。(2)、已知几种化学键的键能如表所示。化学键
键能
243
463
431
496
请根据表中数据计算。
(3)、向一恒容密闭容器内按充入反应物,发生反应 , 平衡体系中各物质的体积分数(φ)随温度的变化如图所示:
①M、N点对应的平衡常数(填“>”、“<”或“=”)。
②点时的转化率为(保留三位有效数字)%。
③点时的总压强为 , 为用平衡分压代替平衡浓度表示的平衡常数(分压总压物质的量分数),则温度下的平衡常数为。
29.(1)、I.完成下列问题。标准状态下,下列物质气态时的相对能量如下表:
物质(g)
O
H
HO
能量/
249
218
39
0
-136
-242
(2)、已知同一容器中发生 反应1:反应2:
反应3:
在一定压强下,随着温度升高,气体中CO与的物质的量之比(填“不变”、“增大”、“减小”)。
(3)、II.工业上可利用生产甲醇,同时可减少温室气体二氧化碳,发生反应①:当起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的、在下的如图所示。当的平衡转化率为1/3时,反应条件可能是。
 (4)、在某催化剂作用下,和除发生反应①外,还发生反应②: 。维持压强不变,按固定初始投料比将和按一定流速通过该催化剂,经相同时间测得实验数据:
(4)、在某催化剂作用下,和除发生反应①外,还发生反应②: 。维持压强不变,按固定初始投料比将和按一定流速通过该催化剂,经相同时间测得实验数据:T(K)
实际转化率(%)
甲醇选择性(%)
543
12.3
42.3
553
15.3
39.1
注:甲醇的选择性是指发生反应的中转化为甲醇的百分比。
表中数据说明,升高温度,的实际转化率提高而甲醇的选择性降低,其原因是。
(5)、甲醇催化制取丙烯的过程中发生反应: , 反应的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为(为活化能,k为速率常数,R和C为常数)。
①该反应的活化能
②当使用更高效催化剂时,画出与的关系图。
30. 氮的化合物在生产、生活中有广泛应用。(1)、已知几种共价键的键能数据如下表所示:共价键
键能/ kJ∙mol-1
391
160
945
498
467
根据表格数据,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= kJ∙mol-1。
(2)、向一恒温恒容密闭容器中充入一定量N2O4和N2H4 , 发生反应: 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H<0。下列说法正确的是____(填标号)。A、当气体平均摩尔质量不随时间变化时,达到平衡状态 B、平衡后,充入惰性气体,平衡向右移动 C、上述反应的正反应活化能大于逆反应活化能(3)、工业上,采用NH3还原NO法消除NO污染。一定条件下,向一恒容密闭容器中充入NH3和NO,在不同催化剂Catl、Cat2、Cat3作用下发生反应: 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0。测得相同时间内NO的转化率随温度的变化如图1所示。①a点时:v正(NO) (填“>”、“<”或“=”) v逆(NO)。
②bc段NO的转化率随温度升高而降低,可能的原因是。(任答一点)

 (4)、工业上用天然气处理NO2 , 消除NO2的污染。发生的反应为CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g)。在一定温度下,向一恒容密闭容器中充入1molCH4和2mol NO2 , 发生上述反应,起始时测得总压强为90kPa。N2的分压与时间的关系如图2所示。
(4)、工业上用天然气处理NO2 , 消除NO2的污染。发生的反应为CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g)。在一定温度下,向一恒容密闭容器中充入1molCH4和2mol NO2 , 发生上述反应,起始时测得总压强为90kPa。N2的分压与时间的关系如图2所示。①0~10min内NO2的分压变化速率为kPa∙min-1。
②该温度下,平衡常数Kp=kPa。(提示:用气体分压计算的平衡常数为Kp , 气体分压=总压×物质的量分数)
(5)、工业上制备HCN的反应为CH4(g)+NH3(g)HCN(g)+3H2(g) △H>0。速率方程为 , ( k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。①其他条件不变,反应达到平衡后,NH3的转化率随着条件X的增大而增大,则X可能是。(答一种即可)
②升高温度,k逆增大的倍数 k正增大的倍数(填“>”、“<”或“=”)
31. 根据所学知识,回答下列问题。(1)、实验室中和热的测定过程中,玻璃搅拌器的正确操作是____(填字母)A、顺时针搅拌 B、逆时针搅拌 C、上下移动(2)、中和热的测定,倒入NaOH溶液的正确操作是(填字母)a.沿玻璃棒缓慢倒入 b.分三次倒入 c.一次迅速倒入
(3)、若中和热的测定实验过程中,内筒未加杯盖,求得的中和反应反应热(填“偏大“偏小”或“无影响”)。(4)、向的溶液中分别加入下列物质:①浓硫酸;②稀硝酸;③稀醋酸。反应恰好完全,生成1mol水时的热效应分别为 , 则三者由大到小的顺序为。(5)、已知:①②
③
碳与水蒸气反应制氢气的总反应热化学方程式是。
(6)、图Ⅰ是和反应生成和过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,的变化是 , (填“增大”、“减小”、“不变”,下同)。的变化是。 32. 含碳化合物的转化利用是目前全球研究的热点。(1)、利用CO2生产甲醇是资源化利用CO2的一种有效途径。涉及的反应如下:
32. 含碳化合物的转化利用是目前全球研究的热点。(1)、利用CO2生产甲醇是资源化利用CO2的一种有效途径。涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g)
在恒压条件下,起始n(CO2):n(H2)=1:3时,平衡时CO2的转化率和CH3OH的选择性随温度变化如图-1所示。CH3OH的选择性=100%。

①已知键能总和:=2798。则=。
②温度高于280℃时,曲线Y随温度的升高而升高的原因是。
(2)、一种铜分子筛催化甲烷制取甲醇的反应机理如图-2所示。请结合Cu元素的化合价变化描述转化Ⅰ的反应过程:。 (3)、一种捕获和转化CO的原理如图-3所示。在反应Ⅰ完成之后,以N2为载气,以恒定组成的N2和CH4混合气匀速通入装有CaCO3和催化剂的反应器,测得流出气体各组分的物质的量随反应时间变化如图-4所示。反应过程中检测到催化剂上有积碳,积碳反应为CH4=C+2H2。
(3)、一种捕获和转化CO的原理如图-3所示。在反应Ⅰ完成之后,以N2为载气,以恒定组成的N2和CH4混合气匀速通入装有CaCO3和催化剂的反应器,测得流出气体各组分的物质的量随反应时间变化如图-4所示。反应过程中检测到催化剂上有积碳,积碳反应为CH4=C+2H2。

①t时刻,CO气体流出速率为0的原因
②氢气的流出速率保持为CH4流入速率的2倍的原因
33. 乙烯是石油化工的基本原料之一,研究制备乙烯的原理具有重要的意义。回答下列问题:(1)、乙烯在催化剂作用下,由乙烷直接脱氢或氧化脱氢制备I.C2H6(g)C2H4(g)+H2(g) △H1
II.2C2H6(g)+O2(g)2C2H4(g)+2H2O(g) △H2<0
①已知键能:E(C-H)=413.4kJ•mol-1 , E(H-H)=436kJ•mol-1 , 生成1mol碳碳π键放出的能量为267.3kJ,则△H1=kJ•mol-1。
②一定温度下,通入p(C2H6):p(O2):p(N2)=10:5:85的混合气体,发生上述反应,测得各组分气体的分压随时间的变化关系如图所示。

0~2.5min内,O2的平均速率为kPa•min-1;反应一段时间后,C2H6和O2的消耗速率比小于2:1的原因为。
③通过比较反应I、II的热效应,氧化脱氢法的优点为。
(2)、利用乙炔和氢气催化加成制备乙烯,发生如下反应III.C2H2(g)+H2(g)C2H4(g) △H3<0
IV. C2H2(g)+2H2(g)C2H6(g) △H4<0
保持压强为20kPa条件下,按起始投料n(C2H2):n(H2)=1:2,匀速通入装有催化剂的反应器中发生反应III和V,测得不同温度下C2H2和H2的转化率如图实线所示(图中虚线表示相同条件下平衡转化率随温度的变化)。

①表示C2H2转化率的曲线是(填“m”或“n”)。
②温度高于T2时,曲线m、n几乎重合的原因是。
③T1时,两种物质的转化率分别为0.75、0.5,反应IV的平衡常数Kp=kPa-2。
34. 、为重要化工原料,常用于合成重要化合物。Ⅰ.以、为原料合成涉及的反应如下:
ⅰ
ⅱ
ⅲ
回答下列问题:
(1)、为分压平衡常数,各反应的随的变化如图所示。
反应ⅲ的 , 其对应的曲线为(填“a”或“c”)。
(2)、在5MPa下,按照投料,平衡时,CO和在含碳产物中物质的量分数及的转化率随温度的变化如图:
①图中代表的曲线为(填“m”或“n”)。
②解释150~250℃范围内转化率随温度升高而降低的原因。
③下列说法错误的是(填字母)。
A.的平衡转化率始终低于的
B.温度越低,越有利于工业生产
C.加入选择性高的催化剂,可提高的平衡转化率
D.150-400℃范围内,温度升高,的平衡产量先减小后增大
④270℃时CO的分压为 , 反应ⅱ的平衡常数为(列出算式)。
Ⅱ.超干重整得到的CO经偶联反应可制得(草酸)。
(3)、在水溶液中、和物质的量分数与pH关系如图所示,则c点溶液。
Ⅲ.利用电池(工作原理如下图所示)能有效地将转化成化工原料草酸铝

已知:电池的正极反应式:(草酸根)正极反应过程中,起催化作用,催化过程可表示为:① ②……
(4)、写出反应②的方程式。35. 研究大气中含氮化合物、含硫化合物的转化具有重要意义。(1)、汽车发动机工作时会引发和反应,其能量变化示意图如下(常温常压下测定):
写出该反应的热化学方程式:。
(2)、土壤中的微生物可将大气中的经两步反应氧化成 , 两步反应的能量变化如图所示:
①第一步反应为反应(填“放热”或“吸热”),原因是。
②写出第二步反应的热化学方程式。
③结合两步反应过程,全部氧化成时的。
36. 利用含硫物质的热化学循环实现太阳能的转化与存储过程如下图所示。
反应I
反应Ⅲ
(1)、反应I中反应物的总能量(填“>”“<”或“=”)生成物的总能量。(2)、写出反应II的热化学方程式。(3)、反应II在某一投料比时,两种压强下,在平衡体系中物质的量分数随温度的变化关系如图所示,(填“>”或“<”),得出该结论的理由是。 (4)、关于以上转化过程叙述正确的是。
(4)、关于以上转化过程叙述正确的是。a.上述循环过程中共涉及4种能量转化形式
b.用替代反应II中 , 反应焓变为 , 则
c.上述循环过程中物质转化的作用是传递能量