高考二轮复习知识点:氧化性、还原性强弱的比较2
试卷更新日期:2023-07-30 类型:二轮复习
一、多选题
-
1. 由下列实验及现象不能推出相应结论的是( )
选项
实验
现象
结论
A
向0.1mol/LFeCl2溶液中加入1滴KSCN溶液,再滴加碘水
开始无明显现象,滴加碘水后溶液变红
氧化性:I2>Fe3+
B
向某钠盐中滴加盐酸,产生的气体通入品红溶液
品红溶液褪色
该钠盐可能为Na2S2O3
C
乙烯通入中性KMnO4溶液中
溶液褪色并产生黑色沉淀
乙烯具有还原性
D
将苯加入橙色的溴水中振荡并静置
下层液体几乎无色
苯与Br2发生了取代反应
A、A B、B C、C D、D2. 钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO 为淡黄色,VO 具有较强的氧化性。Fe2+、SO 等能把VO 还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )A、在酸性溶液中氧化性:MnO >VO2+>Fe3+ B、亚硫酸钠溶液与酸性(VO2)2SO4溶液发生反应:2VO +2H++SO =2VO2++SO +H2O C、向VOSO4溶液中滴加酸性KMnO4溶液反应化学方程式为:10VOSO4+2H2O+2KMnO4=5(VO2)2SO4+2MnSO4+2H2SO4+K2SO4 D、向含1mol VO 的酸性溶液中滴加含1.5 mol Fe2+的溶液完全反应,转移电子为1.5mol3. 有毒,工业吸收后的溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法不正确的是( ) A、电极a为阳极 B、由反应池中的反应可知氧化性: C、电极b上的反应为 D、随着电解的进行,阴极区溶液减小
A、电极a为阳极 B、由反应池中的反应可知氧化性: C、电极b上的反应为 D、随着电解的进行,阴极区溶液减小二、选择题
-
4. 由下列实验及现象不能推出相应结论的是( )
实验
现象
结论
A.
向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D5. 五种主族元素在周期表中的位置如图所示。L的单质在常温常压下呈液态,且保存时需要用水液封。下列推断正确的是( )X
Y
Z
T
L
A、原子半径:X<Y<Z<T<L B、气态氢化物的还原性:L>Z>T C、X的电负性是五种元素中最小的 D、Y和T组成的化合物是离子化合物6. 室温下进行下列实验,根据实验操作和现象,所得到的结论错误的是( )选项
实验操作和现象
结论
A
将NH3通过灼热的CuO粉末,有红色固体生成
NH3具有还原性
B
将某溶液滴在KI淀粉试纸上,试纸变蓝
原溶液中可能存在I2
C
向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液,溶液变红
氧化性:Fe3+<Ag+
D
向盛有2mL一定浓度的Na3[Ag(S2O3)2]溶液的试管中,滴入5滴2mol·L-1的KI溶液,产生黄色沉淀
[Ag(S2O3)2]3-发生了电离
A、A B、B C、C D、D7. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化过程如下图所示。下列叙述错误的是( )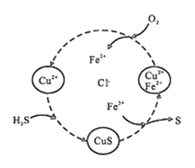 A、反应过程中,CuCl2、FeCl3可以循环利用 B、反应的总方程式为:2H2S+O2 2S↓+2H2O C、由图示的转化可得出:氧化性的强弱顺序为O2>Cu2+>S D、保持溶液中Fe3+的量不变,反应中消耗标况下22.4L的O2 , 可以生成64g硫8. 反应2Na2S2O3+I2→ 2NaI+ Na2S4O6常用于定量分析。下列相关说法错误的是( )A、反应中,每生成1 mol Na2S4O6 , 就有4 mol 电子发生转移 B、反应中,I2表现了氧化性 C、I2被还原,Na2S4O6是氧化产物 D、Na2S2O3溶液最好即配即用,久置空气易被氧化,可能生成Na2SO49. 次磷酸(H3PO2)与磷酸(H3PO4)的正盐性质如下表。正盐NaH2PO2有较强的还原性,可将硝酸银溶液中的Ag+转化为银,此时氧化剂与还原剂物质的量之比为4:1。
A、反应过程中,CuCl2、FeCl3可以循环利用 B、反应的总方程式为:2H2S+O2 2S↓+2H2O C、由图示的转化可得出:氧化性的强弱顺序为O2>Cu2+>S D、保持溶液中Fe3+的量不变,反应中消耗标况下22.4L的O2 , 可以生成64g硫8. 反应2Na2S2O3+I2→ 2NaI+ Na2S4O6常用于定量分析。下列相关说法错误的是( )A、反应中,每生成1 mol Na2S4O6 , 就有4 mol 电子发生转移 B、反应中,I2表现了氧化性 C、I2被还原,Na2S4O6是氧化产物 D、Na2S2O3溶液最好即配即用,久置空气易被氧化,可能生成Na2SO49. 次磷酸(H3PO2)与磷酸(H3PO4)的正盐性质如下表。正盐NaH2PO2有较强的还原性,可将硝酸银溶液中的Ag+转化为银,此时氧化剂与还原剂物质的量之比为4:1。化学式
Na3PO4
NaH2PO2
物质类别
正盐
正盐
溶液酸碱性
碱性
中性
关于该氧化还原反应的判断正确的是( )
A、H3PO2是三元酸 B、反应前后溶液的pH无变化 C、反应的离子方程式为:H2PO +4Ag++2H2O 4Ag↓+PO +6H+ D、硝酸银发生还原反应10. 为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成SeO2 , 再用KI溶液处理后回收Se。发生反应:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②SeO2+4KI+4HNO3=4KNO3+Se+2I2+2H2O,下列说法正确的是( )A、①中SO2是氧化产物,SeO2是还原产物 B、②中HNO3是氧化剂,KI是还原剂 C、由①②可知浓硫酸能将KI氧化生成I2 D、由①②可知还原性由强到弱的顺序:Se>KI>SO211. I-具有还原性,含碘食盐中的碘元素以KIO3的形式存在,I-、I2、IO 在一定条件下可以发生如图转化关系,下列说法错误的是( ) A、由图可知氧化性的强弱顺序为Cl2 > IO > I2 B、用淀粉碘化钾试纸和白醋可检验食盐是否加碘 C、生产等量的碘,反应①和反应②转移电子数目之比为2∶5 D、反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO +6H+12. 对于铝和烧碱溶液的反应,下列说法错误的是( )A、铝是还原剂 B、 是氧化剂 C、 与 是氧化剂 D、氢气是还原产物13. 硝酸厂的尾气中含有大量的氮氧化物(NOx),将尾气与H2混合,通入Ce(SO4)2与Ce2(SO4)3的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( )
A、由图可知氧化性的强弱顺序为Cl2 > IO > I2 B、用淀粉碘化钾试纸和白醋可检验食盐是否加碘 C、生产等量的碘,反应①和反应②转移电子数目之比为2∶5 D、反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO +6H+12. 对于铝和烧碱溶液的反应,下列说法错误的是( )A、铝是还原剂 B、 是氧化剂 C、 与 是氧化剂 D、氢气是还原产物13. 硝酸厂的尾气中含有大量的氮氧化物(NOx),将尾气与H2混合,通入Ce(SO4)2与Ce2(SO4)3的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( ) A、该转化过程的实质为NOx被H2还原 B、过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+ C、处理过程中,混合溶液中Ce3+和Ce4+总数减少 D、x=1时,过程II中氧化剂与还原剂的物质的量之比为2:114. 硝酸厂的烟气中含有大量的氮氧化物(NOx),为保护环境,将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图。下列说法正确的是( )
A、该转化过程的实质为NOx被H2还原 B、过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+ C、处理过程中,混合溶液中Ce3+和Ce4+总数减少 D、x=1时,过程II中氧化剂与还原剂的物质的量之比为2:114. 硝酸厂的烟气中含有大量的氮氧化物(NOx),为保护环境,将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图。下列说法正确的是( ) A、过程Ⅰ发生反应的离子方程式:H2+Ce4+=2H++Ce3+ B、处理一段时间后,混合溶液中Ce3+和Ce4+浓度不变 C、该转化过程的实质为NOx被H2还原 D、x=1时,过程中氧化剂与还原剂的物质的量之比为2:115. 下列反应中,酸体现还原性的是( )A、 与浓盐酸共热制 B、 与浓硫酸共热制 C、 与稀硫酸反应制 D、 与稀硝酸反应制备16. 工业上利用反应 检查氯气管道是否漏气。下列说法错误的是( )A、将浓氨水接近管道,若产生白烟说明管道漏气 B、 的电子式为:
A、过程Ⅰ发生反应的离子方程式:H2+Ce4+=2H++Ce3+ B、处理一段时间后,混合溶液中Ce3+和Ce4+浓度不变 C、该转化过程的实质为NOx被H2还原 D、x=1时,过程中氧化剂与还原剂的物质的量之比为2:115. 下列反应中,酸体现还原性的是( )A、 与浓盐酸共热制 B、 与浓硫酸共热制 C、 与稀硫酸反应制 D、 与稀硝酸反应制备16. 工业上利用反应 检查氯气管道是否漏气。下列说法错误的是( )A、将浓氨水接近管道,若产生白烟说明管道漏气 B、 的电子式为: C、 中只含有离子键
D、该反应中氧化剂和还原剂的物质的量之比为
17. 实验室可用KMnO4代替MnO2与浓盐酸反应,在常温下快速制备Cl2 , 反应原理为:2KMnO4+16HCl(浓)=5Cl2↑+2KCl+2MnCl2+8H2O。下列说法错误的是( )A、Cl2是氧化产物 B、浓盐酸在反应中只体现还原性 C、每生成标准状况下2.24LCl2 , 转移0.2mol电子 D、反应中KMnO4的氧化性强于Cl218. 氢化亚铜(CuH)是一种红棕色的难溶物,可在40℃~50℃时用CuSO4溶液和“另一种反应物”制取。CuH在Cl2中能燃烧生成CuCl2和HCl;CuH跟盐酸反应生成CuCl难溶物和H2。下列推断错误的是( )A、“另一种反应物”在反应中表现还原性 B、CuH与Cl2反应的化学方程式为:2CuH + 3Cl2 2CuCl2 + 2HCl C、CuH与Cl2反应时,CuH做还原剂 D、CuH与盐酸反应的离子方程式为:CuH + H+ = Cu+ + H2↑19. 下列氧化还原反应中,水作氧化剂的是( )A、C+H2O CO+H2 B、2Na2O2+2H2O=4NaOH+O2↑ C、2F2+2H2O=4HF+O2 D、3NO2+H2O=2HNO3+NO20. 下列反应中,水只作氧化剂的是( )A、 与水反应 B、 与水反应 C、 与水反应 D、 与水蒸气反应21. 下列变化中,气体被还原的是( )A、将SO2气体通入品红溶液,溶液红色褪去 B、将氯气通入KBr溶液,溶液变黄 C、氢气通入氧化铜中加热,黑色固体变为红色 D、氨气通入AlCl3溶液产生白色沉淀22. 将浓盐酸滴入 溶液中,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入 ,溶液又变为紫红色, 反应后变为无色的 。下列说法错误的是( )A、滴加盐酸时, 是氧化剂, 是氧化产物 B、此实验条件下,还原性: C、若有 参加了反应,则整个过程转移电子为 D、已知 为第 族元素,上述实验说明 具有较强的非金属性23. 双碱法脱硫过程如图所示。下列说法错误的是( )
C、 中只含有离子键
D、该反应中氧化剂和还原剂的物质的量之比为
17. 实验室可用KMnO4代替MnO2与浓盐酸反应,在常温下快速制备Cl2 , 反应原理为:2KMnO4+16HCl(浓)=5Cl2↑+2KCl+2MnCl2+8H2O。下列说法错误的是( )A、Cl2是氧化产物 B、浓盐酸在反应中只体现还原性 C、每生成标准状况下2.24LCl2 , 转移0.2mol电子 D、反应中KMnO4的氧化性强于Cl218. 氢化亚铜(CuH)是一种红棕色的难溶物,可在40℃~50℃时用CuSO4溶液和“另一种反应物”制取。CuH在Cl2中能燃烧生成CuCl2和HCl;CuH跟盐酸反应生成CuCl难溶物和H2。下列推断错误的是( )A、“另一种反应物”在反应中表现还原性 B、CuH与Cl2反应的化学方程式为:2CuH + 3Cl2 2CuCl2 + 2HCl C、CuH与Cl2反应时,CuH做还原剂 D、CuH与盐酸反应的离子方程式为:CuH + H+ = Cu+ + H2↑19. 下列氧化还原反应中,水作氧化剂的是( )A、C+H2O CO+H2 B、2Na2O2+2H2O=4NaOH+O2↑ C、2F2+2H2O=4HF+O2 D、3NO2+H2O=2HNO3+NO20. 下列反应中,水只作氧化剂的是( )A、 与水反应 B、 与水反应 C、 与水反应 D、 与水蒸气反应21. 下列变化中,气体被还原的是( )A、将SO2气体通入品红溶液,溶液红色褪去 B、将氯气通入KBr溶液,溶液变黄 C、氢气通入氧化铜中加热,黑色固体变为红色 D、氨气通入AlCl3溶液产生白色沉淀22. 将浓盐酸滴入 溶液中,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入 ,溶液又变为紫红色, 反应后变为无色的 。下列说法错误的是( )A、滴加盐酸时, 是氧化剂, 是氧化产物 B、此实验条件下,还原性: C、若有 参加了反应,则整个过程转移电子为 D、已知 为第 族元素,上述实验说明 具有较强的非金属性23. 双碱法脱硫过程如图所示。下列说法错误的是( ) A、过程Ⅰ中,SO2表现还原性 B、过程Ⅱ中,1 mol O2可氧化2 mol Na2SO3 C、双碱法脱硫过程中,NaOH可以循环利用 D、总反应为24. 向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法错误的是( )A、Cu2+将H2O2还原为O2 B、H2O2既表现氧化性又表现还原性 C、Cu2+是H2O2分解反应的催化剂 D、发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O
A、过程Ⅰ中,SO2表现还原性 B、过程Ⅱ中,1 mol O2可氧化2 mol Na2SO3 C、双碱法脱硫过程中,NaOH可以循环利用 D、总反应为24. 向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法错误的是( )A、Cu2+将H2O2还原为O2 B、H2O2既表现氧化性又表现还原性 C、Cu2+是H2O2分解反应的催化剂 D、发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O三、非选择题
-
25. 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:(1)、Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。
(2)、721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。A、<0.25 B、0.25 C、0.25~0.50 D、0.50 E、>0.50(3)、我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。

可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。
(4)、Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
计算曲线a的反应在30~90 min内的平均速率 (a)=kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是、。489 ℃时PH2和PCO随时间变化关系的曲线分别是、。
26. 某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证 、 、 氧化性的强弱。根据题目要求回答下列问题: (1)、检查装置气密性后,关闭 、 、 ,打开 ,旋开旋塞a,加热A,则B中发生反应的离子方程式为。(2)、B中溶液变黄时,停止加热A,关闭 。打开旋塞b,使约2mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是。(3)、若要继续证明 和 氧化性的强弱,需要进行的操作是。(4)、甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序: 的是(填“甲”、“乙”或“丙”)。
(1)、检查装置气密性后,关闭 、 、 ,打开 ,旋开旋塞a,加热A,则B中发生反应的离子方程式为。(2)、B中溶液变黄时,停止加热A,关闭 。打开旋塞b,使约2mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是。(3)、若要继续证明 和 氧化性的强弱,需要进行的操作是。(4)、甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序: 的是(填“甲”、“乙”或“丙”)。过程(2)中溶液含有的离子
过程(3)中溶液含有的离子
甲
既有 又有
有
乙
有 无
有
丙
有 无
有
(5)、验证结束后,将D换成盛有NaOH溶液的烧杯,旋开 、 、 和 ,关闭旋塞a、c,打开旋塞b,从两端鼓入 ,这样做的目的是27. 钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:(1)、将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是。(2)、向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。ClO +VO2++=Cl-+VO +
(3)、V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由大到小的顺序是。(4)、在20.00 mL 0.1 moI.L-1 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 。a.VO2+ b. c. V2+ d.V
28.(1)、比较Br-与Fe2+还原性相对强弱:Br-Fe2+(填“>”、“<”、“=”);用一个化学方程式说明Br-与Fe2+还原性相对强弱。(2)、KSCN溶液是高中阶段常用试剂,其阴离子对应酸为HSCN(硫氰化氢),硫氰化氢分子中各原子均具有稀有气体稳定结构。写出HSCN(硫氰化氢)的结构式。(3)、元素N与Cl的非金属性均较强,但常温下氮气远比氯气稳定,主要原因是。29. 某化学兴趣小组为了探究在相同条件下,草酸根()的还原性是否强于 , 进行了如下三个实验。【实验1】通过和在溶液中的反应比较和的还原性强弱。实验操作与现象如下:
在避光处,向溶液中缓慢加入溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤后得到翠绿色溶液和翠绿色晶体,并留存翠绿色溶液a待用。
已知:Ⅰ.草酸 ()为二元弱酸。
Ⅱ.三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解。其水溶液中存在: 请回答:
(1)、实验室配制溶液时若不加盐酸一起进行配制,常常得到红褐色的溶液,请用离子方程式说明原因。(2)、取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是。(3)、经检验,翠绿色晶体为。为了确认实验1中是否发生了氧化还原反应,取少量翠绿色溶液a,向其中滴加(填序号)末见明显现象。A.少量KSCN溶液 B.少量溶液 C.少量HCl溶液
该小组据此判断氧化还原没有发生。请简述未发生氧化还原反应的原因。
(4)、【实验2】通过比较与、反应的难易,判断二者还原性的强弱。实验操作与现象如下:①向溶液中加入溶液,过滤,立即产生黄色沉淀;
②洗涤①中的黄色沉淀(已知:为黄色固体,微溶于水,可溶于强酸),向其中加入过量的溶液,振荡,静置,反应剧烈放热,产生大量的红褐色沉淀和无色气体;
③待充分反应后,向其中加入稀硫酸,调节pH约为4,得到翠绿色溶液。请回答:
证明被氧化的实验现象是。
(5)、以上现象能否说明没有被氧化。请判断并说明理由:。(6)、【实验3】利用电化学装置进行实验,其装置如图:
用溶液、溶液和其他试剂,设计图的装置进行实验比较和的还原性强弱,一段时间的实验后,该小组依据实验所观察到的现象做出了比还原性强的实验结论。则下列实验现象描述能支持这一结论的有:____。(填序号)
A、电流表指针发生偏转 B、取左侧烧杯内溶液滴加氢氧化钠溶液,出现红褐色沉淀 C、取左侧烧杯内溶液滴加溶液,有蓝色沉淀生成 D、右侧烧杯的电极附近有无色气泡生成,经实验,该气体能使澄清石灰水变浑浊。30. 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。 (1)、I.上图是元素周期表的一部分,回答下列问题:
(1)、I.上图是元素周期表的一部分,回答下列问题:元素②位于元素周期表的第周期族,它的一种质量数为14的原子可测定文物年代,用核素符号表示该原子是。
(2)、元素⑥的原子结构示意图是。(3)、上述①~⑥号元素的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是(填化学式)。(4)、II.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
序号
实验①
实验②
实验操作


现象
溶液变为黄色
实验①中反应的离子方程式是。
(5)、实验②观察到的现象是 , 甲同学根据此现象得出结论:氧化性Br2>I2。乙同学认为实验②不能充分证明氧化性Br2>I2 , 其理由是。(6)、从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下 , 因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。31. 浩瀚的大海中蕴藏着丰富的化学资源。(1)、“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
①热空气吹出溴是利用了(填溴的一种物理性质)。
②写出“吸收”步骤中反应的化学方程式:。氧化性由强到弱的顺序为。
③“分离”操作名称为。
(2)、“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:写出步骤②中反应的离子方程式:。
(3)、溴量法测定废水中苯酚( , 相对分子质量为94)含量(每升水中含苯酚的质量,单位)的过程如下(废水中不含干扰测定的物质)。步骤1 向盛有溶液的锥形瓶中加入过量 , 加酸化一段时间:
步骤2 加入废水,充分反应;
步骤3 向锥形瓶中加入过量 , 生成的恰好和反应。
计算该废水中苯酚的含量(写出计算过程)(已知:)。
32. 已知氯气与碱反应时,产物受温度的影响。实验室中利用如图装置(部分装置省略)制备和 , 并探究其氧化还原性质。
回答下列问题:
(1)、仪器a的名称是。(2)、装置A产生氯气的化学方程式为。(3)、装置B的作用为。(4)、装置D中发生反应的离子方程式为。(5)、装置E可选用试剂____(填标号)。A、溶液 B、溶液 C、澄清石灰水 D、稀硫酸(6)、探究、的氧化能力
操作:向1号和2号试管中,分别滴加适量中性溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力(填“大于”或“小于”)。
33. 某实验小组用下列装置制备高铁酸钾( K2FeO4 )并探究其性质,制备原理为:3Cl2+2Fe(OH)3+ 10KOH=2K2FeO4+6KCl+8H2O。(夹持装置略)
查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
(1)、I K2FeO4 的制备仪器a的名称为 , D中的NaOH溶液可以用代替(填入对应字母)。
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)、检验气体发生装置A气密性的方法是; 该装置中生成黄绿色气体的化学反应方程式为。(3)、制备K2FeO4需要在(填“酸性”“碱性”或“中性”)环境中进行,根据上述K2FeO4的制备实验得出:氧化性Cl2FeO (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式。(4)、II.探究K2FeO4的性质实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO , 则用KOH溶液洗涤的目的是。
②由(4)的实验得出Cl2和FeO的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是。
34. 回答下列问题:(1)、某小组在探究Fe2+性质的实验中观察到异常现象(实验1),观察到溶液变红,片刻红色褪去,有气体生成(经检验为O2)。①在实验1加入H2O2溶液与Fe2+反应的离子方程式是 , 溶液变红的离子方程式是。

②用实验2探究“红色褪去”的原因,则红色褪去的原因是。
 (2)、Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+、 , 该反应的化学方程式是。(3)、向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。
(2)、Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+、 , 该反应的化学方程式是。(3)、向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。ClO+VO2++_=Cl-+VO+_
(4)、V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则SO、Cl-、VO2+还原性由大到小的顺序是。(5)、在20.00mL0.1mol/LVO溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是。a.VO2+ b. VO+ c. V2+ d.V
35. 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。(1)、阅读资料,回答下列相关问题。
①资料涉及的物质中,属于碱的是(填化学式);属于盐的是(填化学式)。
②Cl2与NaOH溶液反应的离子方程式是。
③“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,其中发生的化学反应符合规律:()+()=()+()(填物质类别)。
(2)、“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。①该反应中起氧化作用的微粒是。
②若反应中生成了0.01molCl2 , 转移电子的物质的量为mol。
(3)、2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClOH2O2的(填“>”或“<”)。