高考二轮复习知识点:氧化还原反应3
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
 A、A B、B C、C D、D2. 探究草酸( )性质,进行如下实验。(已知:室温下, 的pH=1.3)
A、A B、B C、C D、D2. 探究草酸( )性质,进行如下实验。(已知:室温下, 的pH=1.3)
由上述实验所得草酸性质所对应的方程式不正确的是( )
A、 有酸性, B、酸性: , C、 有还原性, D、 可发生酯化反应,3. 葡萄糖在碱性条件下和亚甲基蓝溶液混合后,蓝色会消失,经振荡,无色溶液又恢复蓝色,此过程可以反复多次。现用培养皿盛放上述溶液,将蓝牙音箱、白色亚克力板、培养皿由下至上放置,打开音箱(设置音频为60赫兹,音量为60分贝),振荡使空气中的氧气进入溶液,一段时间后,培养皿中呈现波纹状颜色变化。
以下分析不符合事实的是
A、颜色变化的过程是可逆反应 B、蓝色褪去的过程是亚甲基蓝被还原的过程 C、升高温度,不一定能加快溶液变蓝的过程 D、波腹处更容易呈现蓝色的原因是此处氧气浓度更大4. 劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是选项
劳动项目
化学知识
A
科学研究:燃煤脱硫
增大煤燃烧放出的热量
B
工厂生产:冶炼钢铁
涉及氧化还原反应
C
社会服务:推广使用免洗手酒精消毒液
酒精消毒液酒精能使蛋白质变性
D
家务劳动:饭后用热的纯碱溶液洗涤餐具
油脂在碱性条件下发生水解
A、A B、B C、C D、D5. 联氨(N2H4)可用于处理水中的溶解氧,其反应机理如下图所示:
下列说法错误的是
A、分子的共价键只有键 B、具有还原性,在一定条件下可被氧化 C、②中反应产物是而不是 , 说明相对较稳定 D、③中发生反应:6. 实验室以二氧化铺铈废渣为原料制备 , 其部分实验过程如下:
已知:能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:(水层)(有机层)(有机层)(水层)。下列说法正确的是
A、“酸浸”过程中做氧化剂 B、加氨水“中和”除去过量盐酸,主要目的是提高的萃取率 C、试剂a一定是盐酸 D、“沉淀”时反应的离子方程式为7. 在中国灿烂的农耕文明发展过程中,产生了许多有关农业生产与生活的化学智慧。对下列史料记载的判断错误的是A、将大豆煮熟后与面粉混合加醋曲酿醋:该过程不涉及氧化还原反应 B、用糯米石灰浆修筑长城:糯米石灰浆属于复合材料 C、用高粱制作饴糖(主要成分为麦芽糖);麦芽糖与蔗糖互为同分异构体 D、胡桐树的树脂可作金银焊药:胡桐树脂的主要成分属于天然高分子化合物8. 一种含P催化剂催化甲烷中的碳氢键活化的反应机理如图所示。下列有关说法错误的是 A、催化循环中Pt的配位数有3种 B、a中Pt的化合价为+2价 C、c→d发生的是氧化还原反应 D、SO2与SO3的VSEPR模型名称不同9. 钒系催化剂催化脱硝部分机理如图所示。有关该过程的叙述错误的是
A、催化循环中Pt的配位数有3种 B、a中Pt的化合价为+2价 C、c→d发生的是氧化还原反应 D、SO2与SO3的VSEPR模型名称不同9. 钒系催化剂催化脱硝部分机理如图所示。有关该过程的叙述错误的是 A、反应过程中有氢氧键的断裂和形成 B、反应过程中被氧化 C、脱硝反应为 D、是反应中间体10. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列化学反应表示错误的是A、碱性氢氧燃料电池放电时的正极反应:O2+2H2O+4e-=4OH- B、斜方硫的燃烧:S(s,斜方硫)+O2(g)=SO2(g) △H=297kJ•mol-1 C、煅烧黄铁矿获得SO2:4FeS2+11O28SO2+2Fe2O3 D、SO2与SeO2的水溶液反应制备硒:2SO2+SeO2+2H2O=Se↓+2H2SO411. 过渡金属元素离子催化乙烯氧化成乙醛的反应机理如图所示。下列说法正确的是
A、反应过程中有氢氧键的断裂和形成 B、反应过程中被氧化 C、脱硝反应为 D、是反应中间体10. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列化学反应表示错误的是A、碱性氢氧燃料电池放电时的正极反应:O2+2H2O+4e-=4OH- B、斜方硫的燃烧:S(s,斜方硫)+O2(g)=SO2(g) △H=297kJ•mol-1 C、煅烧黄铁矿获得SO2:4FeS2+11O28SO2+2Fe2O3 D、SO2与SeO2的水溶液反应制备硒:2SO2+SeO2+2H2O=Se↓+2H2SO411. 过渡金属元素离子催化乙烯氧化成乙醛的反应机理如图所示。下列说法正确的是 A、和能够降低反应的活化能 B、该反应历程中氢离子物质的量一直减小 C、Pd的化合价在反应历程中未发生变化 D、该历程的总反应为12. 已知反应: , 。下列关于该反应的说法错误的是A、可以对水体进行杀菌消毒、净化 B、在该反应中既是氧化剂又是还原剂 C、 D、每生成 , 转移4mol电子13. 我国科学家成功以二氧化碳和水为原料合成葡萄糖和脂肪酸,为合成“粮食”提供了新路径。下列有关说法错误的是A、属于酸性氧化物 B、链状葡萄糖分子中含有三种官能团 C、合成中发生了氧化还原反应 D、该新路径有利于促进“碳中和”14. 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,S8环状分子的结构为
A、和能够降低反应的活化能 B、该反应历程中氢离子物质的量一直减小 C、Pd的化合价在反应历程中未发生变化 D、该历程的总反应为12. 已知反应: , 。下列关于该反应的说法错误的是A、可以对水体进行杀菌消毒、净化 B、在该反应中既是氧化剂又是还原剂 C、 D、每生成 , 转移4mol电子13. 我国科学家成功以二氧化碳和水为原料合成葡萄糖和脂肪酸,为合成“粮食”提供了新路径。下列有关说法错误的是A、属于酸性氧化物 B、链状葡萄糖分子中含有三种官能团 C、合成中发生了氧化还原反应 D、该新路径有利于促进“碳中和”14. 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,S8环状分子的结构为  。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是 A、硫单质呈黄色,可用作橡胶硫化剂 B、SO2具有氧化性,可用于漂白草编织物 C、Na2SO3具有还原性,可用于处理自来水中残留的Cl2 D、浓硫酸具有强氧化性,可用作酯化反应的催化剂15. 下图是活性炭中的含氧基团催化双氧水氧化苯制苯酚的反应历程,下列说法正确的是
。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是 A、硫单质呈黄色,可用作橡胶硫化剂 B、SO2具有氧化性,可用于漂白草编织物 C、Na2SO3具有还原性,可用于处理自来水中残留的Cl2 D、浓硫酸具有强氧化性,可用作酯化反应的催化剂15. 下图是活性炭中的含氧基团催化双氧水氧化苯制苯酚的反应历程,下列说法正确的是 A、HO·有7个e- B、反应③中苯酚是氧化产物 C、反应②中没有元素化合价变化 D、已知O2中的氧氧键比H2O2中的氧氧键的键长短,则O2氧化苯比H2O2容易16. 下列化工生产原理不涉及氧化还原反应的是A、溴的提取 B、氯碱工业 C、合成氨工业 D、海水晒盐17. 氨基钠()是重要的化学试剂,其与氧气的反应如下:。下列说法正确的是A、 B、每消耗 , 转移电子数是 C、是氧化产物 D、中N的化合价部分发生变化
A、HO·有7个e- B、反应③中苯酚是氧化产物 C、反应②中没有元素化合价变化 D、已知O2中的氧氧键比H2O2中的氧氧键的键长短,则O2氧化苯比H2O2容易16. 下列化工生产原理不涉及氧化还原反应的是A、溴的提取 B、氯碱工业 C、合成氨工业 D、海水晒盐17. 氨基钠()是重要的化学试剂,其与氧气的反应如下:。下列说法正确的是A、 B、每消耗 , 转移电子数是 C、是氧化产物 D、中N的化合价部分发生变化二、多选题
-
18. 利用含钴废料(主要成分为Co3O4 , 还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如图:
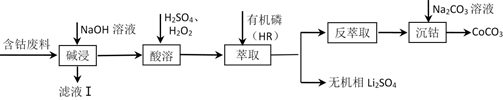
已知:萃取Co2+的反应原理:Co2++2HR(有机磷) CoR2+2H+。下列说法错误的是( )
A、“滤液Ⅰ”中溶质的主要成分是Na[Al(OH)4] B、“酸溶”中H2O2的作用是将Co2+氧化为Co3+ C、“反萃取”中可加入H2SO4分离出Co2+ D、“沉钴”时增大Na2CO3溶液的浓度或滴加速率,能够提高产品的纯度19. 工业生产中除去电石渣浆(含 )中的 并制取硫酸盐的一种常用流程如图。下列说法正确的是( ) A、碱性条件下,氧化性: B、过程I中氧化剂和还原剂物质的量之比为 C、过程Ⅱ中,反应的离子方程式为 D、将 转化为 理论上需要 的体积为 (标准状况)20. 某同学研究浓硝酸与 溶液的反应,进行如下实验:
A、碱性条件下,氧化性: B、过程I中氧化剂和还原剂物质的量之比为 C、过程Ⅱ中,反应的离子方程式为 D、将 转化为 理论上需要 的体积为 (标准状况)20. 某同学研究浓硝酸与 溶液的反应,进行如下实验: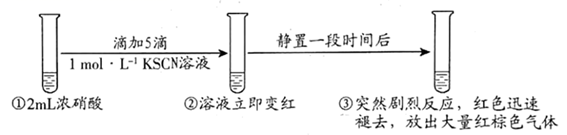
已知: 能被氧化为黄色的 可聚合为红色的 。
下列分析错误的是( )
A、②中溶液变红,是由于生成了 B、取少量③中的溶液加入 溶液,产生白色沉淀,证明最终有 生成 C、分析①②知,硝酸氧化 的速率大于 聚合为 ,的速率 D、向溶有 的浓硝酸中加几滴 溶液,溶液先变红后迅速褪色并产生大量红棕色气体,证明 催化浓硝酸氧化 ,的反应21. 极易发生水解,水解机理如图所示,下列说法错误的是( ) A、整个反应历程中P的化合价不变 B、水解产物 是一种三元弱酸 C、 中3个 原子被取代的机会不相等 D、 分子的P原子有孤电子对,易与金属离子配位而形成配合物22. CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应的机理如图所示,下列说法正确的是( )
A、整个反应历程中P的化合价不变 B、水解产物 是一种三元弱酸 C、 中3个 原子被取代的机会不相等 D、 分子的P原子有孤电子对,易与金属离子配位而形成配合物22. CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应的机理如图所示,下列说法正确的是( ) A、脱附过程1的总反应为:2CO+2CH3ONO
A、脱附过程1的总反应为:2CO+2CH3ONO +2NO
B、CH3ONO中氮氧双键在Pd表面断裂
C、增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D、脱附过程2生成了碳酸二甲酯(
+2NO
B、CH3ONO中氮氧双键在Pd表面断裂
C、增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D、脱附过程2生成了碳酸二甲酯(  )
23. 如图是PdCl2、CuCl2催化下的烯烃的氧化反应,L是配体或溶剂。下列说法正确的是( )
)
23. 如图是PdCl2、CuCl2催化下的烯烃的氧化反应,L是配体或溶剂。下列说法正确的是( )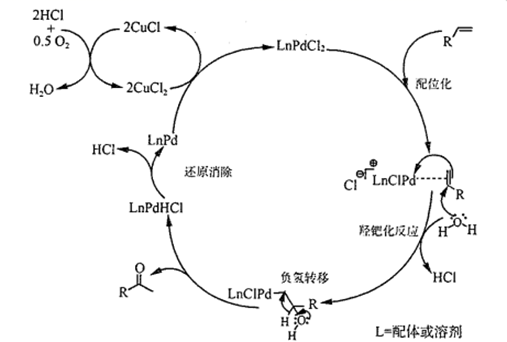 A、加入CuCl2之后再通入O2 , 目的是使催化剂再生 B、该过程原子利用率100%,且原料、催化剂、溶剂和试剂产物均无毒无害 C、过程中元素Pd、Cu、O和C等元素发生过化合价变化 D、
A、加入CuCl2之后再通入O2 , 目的是使催化剂再生 B、该过程原子利用率100%,且原料、催化剂、溶剂和试剂产物均无毒无害 C、过程中元素Pd、Cu、O和C等元素发生过化合价变化 D、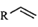 和
和 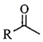 (二者R相同)中的 键数目相等
(二者R相同)中的 键数目相等
三、非选择题
-
24. 化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的 固体配制一定体积的 标准溶液;
Ⅱ.取 L上述溶液,加入过量 ,加 酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用
 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液 L。
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液 L。 已知:
和 溶液颜色均为无色
(1)、Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和。(2)、Ⅱ中发生反应的离子方程式是。(3)、Ⅲ中发生反应的化学方程式是。(4)、Ⅳ中加 前,溶液颜色须为黄色,原因是。(5)、 与 物质的量关系为 时, 一定过量,理由是。(6)、V中滴定至终点的现象是。(7)、废水中苯酚的含量为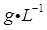 (苯酚摩尔质量:
(苯酚摩尔质量:  )
(8)、由于 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。25. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
)
(8)、由于 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。25. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)、步骤①的目的是去除废铁屑表面的油污,方法是。(2)、步骤②需要加热的目的是 , 温度保持80~95 ℃,采用的合适加热方式是。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。 (3)、步骤③中选用足量的H2O2 , 理由是。分批加入H2O2 , 同时为了 , 溶液要保持pH小于0.5。(4)、步骤⑤的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。(5)、采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为。26. 亚氯酸钠()是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 , 是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备固体的实验装置如图所示:
(3)、步骤③中选用足量的H2O2 , 理由是。分批加入H2O2 , 同时为了 , 溶液要保持pH小于0.5。(4)、步骤⑤的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。(5)、采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为。26. 亚氯酸钠()是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 , 是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备固体的实验装置如图所示:
已知:
①的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、、氮气等气体稀释时,爆炸性则降低。
②
回答下列问题:
(1)、按上图组装好仪器后,首先应该进行的操作是;装置B的作用是;冰水浴冷却的主要目的不包括(填字母)。a.减少的分解 b.降低的溶解度 c.减少的分解
(2)、是合成的重要原料,写出三颈烧瓶中生成的化学方程式:。(3)、装置C中加入NaOH溶液的目的除了作反应物外,还因为。空气的流速过慢时,不能及时被移走,浓度过高导致分解可能发生爆炸;空气流速过快时,则导致。(4)、该套装置存在的明显缺陷是。(5)、为防止生成的固体被继续还原为NaCl,所用还原剂的还原性应适中。除外,还可以选择的还原剂是____(填字母)A、过氧化钠 B、硫化钠 C、氯化亚铁 D、高锰酸钾(6)、若mg最终制得纯净的ng , 则的产率是×100%。(相对分子质量分别是:106.5 :90.5)27. 碳酸锶(SrCO3)具有屏蔽X射线的功能,广泛应用于彩色显示装置、等离子显色装置的荧光屏玻璃中。工业上以天青石(主要成分为SrSO4 , 含少量BaSO4和CaSO4)和煤为原料生产碳酸锶。工艺流程如下:
已知:①Sr(OH)2、Ba(OH)2、Ca(OH)2在不同温度下的溶解度(g):
温度/℃
20
40
60
80
90
100
Sr(OH)2
1.77
3.95
8.42
20.2
44.5
91.2
Ba(OH)2
3.89
8.22
20.94
101.4
—
—
Ca(OH)2
0.173
0.141
0. 121
0.094
0.086
0.076
②浸取时发生反应:2SrS+2H2O=Sr(HS)2+Sr(OH)2 , 硫化锶的溶解度主要受氢氧化锶的溶解度影响。
③BaSO4、SrCO3、BaCO3和SrSO4均难溶于水,在相同温度下的溶解度(S)关系如下:
S(BaSO4)≈S(SrCO3)<S(BaCO3)<S(SrSO4)。
回答下列问题:
(1)、天青石、煤混合粉碎的目的是。(2)、天青石与煤焙烧时CO还原了SrSO4 ,反应的化学方程式为。(3)、用热水浸取可以加快浸取速率,另外的主要作用是。(4)、碳化过程控制条件让硫氢化锶吸收二氧化碳有利于产品质量的提高,并且可以提供硫化氢使氢氧化锶转化为硫氢化锶。写出碳化时硫氢化锶吸收二氧化碳的化学方程式:。(5)、若达到碳化终点后继续碳化,则会使产品产率降低,结合化学方程式解释原因: , 取碳化后的料浆滴入无色酚酞试剂,若表明到达碳化终点。(6)、由于碳化所用的CO2中含有少量的O2、SO2等,在碳化时发生副反应,生成少量的SrSO3、SrSO4 , 所以要对碳化完成的碳酸锶浆进行脱硫处理。方法为加入纯碱,并加热煮沸,写出脱硫过程SrSO4与纯碱反应的化学方程式。28. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: (1)、反应Ⅰ由两步反应组成:
(1)、反应Ⅰ由两步反应组成:①;
②。
(2)、反应Ⅱ:①不同条件下,达到相同的平衡转化率,温度越高,所需的压强越大,0。
②一定压强下,与的投料比[]对体系中平衡转化率的影响如下:

时,解释平衡转化率随投料比增大而降低的原因:。
(3)、可以作为水溶液中歧化反应的催化剂。可能的催化过程如下:①ⅰ.
ⅱ.。
②反应结束后,分离混合物[硫酸(含、)、S(吸附了)等],从中获得固体S以及与的混合液,便于循环利用。
a.该过程中,应选取的化学试剂是。
b.根据所选取的化学试剂,设计方案,得到S以及与的混合液。实验方案是:。(用简要文字说明即可)
29. 用零价铁()去除含氮废水中的硝酸盐()是环境修复的重要方法。一种去除的过程如下。 (1)、Ⅱ中充分反应后,分离混合物的方法是。(2)、Ⅱ中反应的离子方程式是。(3)、实验发现,在Ⅱ中补充一定量的可以明显提高的去除率。向两份含氮废水[]中均加入足量粉,做对比研究。
(1)、Ⅱ中充分反应后,分离混合物的方法是。(2)、Ⅱ中反应的离子方程式是。(3)、实验发现,在Ⅱ中补充一定量的可以明显提高的去除率。向两份含氮废水[]中均加入足量粉,做对比研究。实验序号
ⅰ
ⅱ
所加试剂
粉
粉、()
的去除率
≈50%
≈100%
分析ⅱ中的去除率提高的原因:
a.直接还原了。
通过计算说明电子得、失数量关系: , 证明该原因不合理。
b.研究发现:(导电)覆盖在铁粉表面;随着反应的进行,产生(不导电),它覆盖在表面,形成钝化层,阻碍电子传输。
c.能与反应生成。
用做同位素示踪实验,证明该原因合理。
d.破坏钝化层。
将ⅱ中的替换为 , 的去除率约为50%,证明该原因不合理。
(4)、ⅰ、ⅱ中均能发生。该反应明显有助于ⅰ中的去除,结合方程式解释原因:。(5)、测定含量步骤1.取v含氮()水样,加入催化剂、标准溶液(过量),再加入稀。
步骤2.用标准溶液滴定剩余的(被还原为),终点时消耗。
已知:
①水样中的含量为。
②溶液中影响测定。向步骤1中加入适量 , 产生驱赶 , 否则会使测定结果(填“偏大”或“偏小”)。
30.(1)、Ⅰ.是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
“反应”步骤中生成的反应中氧化剂与还原剂的物质的量之比为。
(2)、Ⅱ.某实验小组模仿工业生产的方法,设计了一套实验室制备装置,生产产品。
已知装置B中的产物有气体和 , 则B中产生气体的化学方程式为。
(3)、装置D中生成和一种助燃气体,其反应的化学方程式为。(4)、装置C的作用是。(5)、反应结束后,打开 , 装置A起的作用是;如果撤去D中的冷水浴,可能导致产品中混有的杂质是。(6)、测定样品中的纯度:准确称mg的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应: , 将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用标准液滴定至终点,测得消耗标准溶液体积的平均值为VmL(已知:),则所称取的样品中的质量分数为。(用含V、c、m的表达式列出)31. 某小组探究氧化性、还原性的变化规律。资料:、
(1)、制备:将溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 , 得溶液B。溶用冰水,目的是。(2)、检验:向溶液A、B中分别滴加适量酸性溶液。Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
发生还原反应:
发生氧化反应:。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 , 对其产生的原因提出猜想:
猜想1.有氧化性,能被还原为
猜想2.有性,能与反应产生
猜想3.……
(3)、探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:序号
实验
试剂
现象
ⅰ
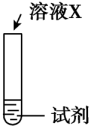
a
生成棕褐色固体,产生大量气泡
ⅱ
b
有少量气泡
ⅲ
溶液
有少量气泡
ⅲ是ⅱ和ⅰ的对照实验。
①X是。
②a是、b是。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)、向一定浓度的溶液中加入少量 , 迅速产生大量气泡;随后加入 , 固体溶解,气泡产生明显减弱。结合方程式解释原因。(5)、综上,做氧化剂还是做还原剂,与等因素有关。32. 某废催化剂主要含有Al2O3(45.4%)、MoO3 (28.8%)、Fe2O3(0.7%)以及其他杂质。为节约和充分利用资源,通过如下工艺流程回收钼和铝等。
回答下列问题:
(1)、“焙烧”前要进行粉碎处理,目的是。(2)、“焙烧”中有Na2MoO4生成,发生反应的化学方程式为。(3)、钼的浸出率随碳酸钠与废催化剂的质量比、焙烧时间、浸出温度、浸出液固比变化的曲线如图所示,则最适宜的碳酸钠与废催化剂的质量比、焙烧时间、浸出温度、浸出液固比分别为、、、。 (4)、“沉铝”中,生成沉淀M的离子反应方程式为。(5)、操作A最好采用。(6)、已知金属Mo的浸出率a=()×100%,(w-浸出渣中Mo的含量;m-浸出渣的质量;z-参与浸出反应的Mo总质量),通过X-射线衍射法测定“浸出渣”中Mo的含量为0.8%,若1t废催化剂经焙烧、水浸后得到“浸出渣”0.48t,则Mo的浸出率a=。33. 氧化钪(Se2O3)广泛应用于航天、激光和导弹等尖端科学领域。利用钛白酸性废水(含H+、Sc3+、Ti4+、Fe2+、SO)制备氧化钪的工艺具有较高的经济价值,其工艺流程如图所示:
(4)、“沉铝”中,生成沉淀M的离子反应方程式为。(5)、操作A最好采用。(6)、已知金属Mo的浸出率a=()×100%,(w-浸出渣中Mo的含量;m-浸出渣的质量;z-参与浸出反应的Mo总质量),通过X-射线衍射法测定“浸出渣”中Mo的含量为0.8%,若1t废催化剂经焙烧、水浸后得到“浸出渣”0.48t,则Mo的浸出率a=。33. 氧化钪(Se2O3)广泛应用于航天、激光和导弹等尖端科学领域。利用钛白酸性废水(含H+、Sc3+、Ti4+、Fe2+、SO)制备氧化钪的工艺具有较高的经济价值,其工艺流程如图所示:
已知:
i.Sc3+、Ti4+、Fe2+均能与P504(用HR表示)发生络合反应,且机理均为:Mn++nHRMRn+nH+;
ii.金属离子开始沉淀及完全沉淀的pH如表所示:
金属离子
T14+
Fe2+
Sc3+
开始沉淀pH
1.3
6.8
4.0
沉淀完全pH
2.3
9.0
5.0
回答下列问题:
(1)、萃取相比()指的是萃取时有机相与被萃取的酸性废水的体积比。“萃取”工序中,萃取相比()与Sc3+的萃取率关系如表所示:萃取相比()
1:10
1:15
1:20
1:25
1:30
1:35
1:40
Sc3+的萃取率/%
90
90
90
85
80
70
60
该工序中最适宜的值为1:20,理由为。
(2)、Sc3+的络合机理为(用离子方程式表示);“水相II”的主要成分除H2SO4外,还含有FeSO4和少量Ti(SO4)2 , 则Ti4+、Fe2+中与P504络合能力较强的是。(3)、“反萃取”时,加入NaOH溶液的目的为;“滤液I”的主要成分为(填化学式)。(4)、“优溶”时,加入盐酸调节溶液的pH范围为。(5)、“沉钪”时,能得到Sc2(C2O4)3·6H2O。其在“焙烧”分解时,热分解温度区间和分解得到的固体产物如表所示:草酸钪晶体
热分解温度区间(K)
固体失重百分率(%)
生成的含钪化合物
Sc2(C2O4)3·6H2O(摩尔质量为462 g/mol)
383~423
19.48
A
463~508
23.38
B
583~873
70.13
Sc2O3
化合物A的化学式为;由含钪化合物B转化为Sc2O3时,发生反应的化学方程式为。
34. 一种矿物的孪生矿含有Pr2S3、FeS、SiO2等,利用该矿制取PrCl3晶体的工艺流程如下:
已知:PrCl3(aq)+2Cl-(aq)(aq) ΔH>0.
(1)、实验室用氯化铁固体配制氯化铁溶液的具体操作为。(2)、“溶浸”时Pr2S3可被FeCl3氧化,生成淡黄色的沉淀。写出Pr2S3被FeCl3氧化的离子方程式:;由于溶液酸性较强,该操作中易产生有毒气体,其化学式为 , 工业上可用(填化学式)来吸收处理。(3)、"滤渣1”的主要成分有(填化学式)。(4)、“调pH”时,可选用的试剂为____ (填标号)。A、Fe2O3 B、稀盐酸 C、Fe(OH)3 D、稀硫酸(5)、用化学平衡移动的原理解释使用冰水浴的原因:。35. 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料制备NixOy和碳酸钴(CoCO3)的工艺流程如图。
已知: Ksp[Co(OH)2]=2 ×10-15 , 请回答以下问题:
(1)、“滤渣I”主要成分是。 “ 酸浸”过程中镍的浸出率与温度和时间的关系如图所示,酸浸的最佳温度和时间是。 (2)、“氧化” 时反应的离子方程式是 , 为证明添加NaClO3已足量,可用 (写化学式)溶液进行检验。(3)、“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为。(4)、“萃取”和“反萃取”可简单表示为: 2HX + Ni2+NiX2+ 2H+。在萃取过程中加入适量氨水,其作用是 。“反萃取”需要往有机层中加(填试剂名称)(5)、若起始时c(Co2+) = 0.02 mol·L-1 , “沉钴”过程中应控制pH <7.5的原因是。
(2)、“氧化” 时反应的离子方程式是 , 为证明添加NaClO3已足量,可用 (写化学式)溶液进行检验。(3)、“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为。(4)、“萃取”和“反萃取”可简单表示为: 2HX + Ni2+NiX2+ 2H+。在萃取过程中加入适量氨水,其作用是 。“反萃取”需要往有机层中加(填试剂名称)(5)、若起始时c(Co2+) = 0.02 mol·L-1 , “沉钴”过程中应控制pH <7.5的原因是。