高考二轮复习知识点:氧化还原反应2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
 A、放电时,a电极反应为 B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重 ,溶液中有 被氧化 D、充电时,a电极接外电源负极2. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )A、蚕丝的主要成分是蛋白质 B、蚕丝属于天然高分子材料 C、“蜡炬成灰”过程中发生了氧化反应 D、古代的蜡是高级脂肪酸酯,属于高分子聚合物3. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、是氧化剂 D、氧化产物与还原产物的物质的量之比为4. 一种新型人工固氮的原理如图所示,下列叙述错误的是( )
A、放电时,a电极反应为 B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重 ,溶液中有 被氧化 D、充电时,a电极接外电源负极2. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )A、蚕丝的主要成分是蛋白质 B、蚕丝属于天然高分子材料 C、“蜡炬成灰”过程中发生了氧化反应 D、古代的蜡是高级脂肪酸酯,属于高分子聚合物3. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、是氧化剂 D、氧化产物与还原产物的物质的量之比为4. 一种新型人工固氮的原理如图所示,下列叙述错误的是( ) A、反应①中每生成1molLi3N转移电子数为3NA B、反应①②③均为氧化还原反应 C、反应③中O2为氧化产物 D、整个过程的总反应可表示2N2 + 6H2O = 4NH3 + 3O25. 绿水青山是构建美丽中国的伟大构想。一种以沸石笼为载体对NO进行催化还原的原理如图所示,下列说法正确的是( )
A、反应①中每生成1molLi3N转移电子数为3NA B、反应①②③均为氧化还原反应 C、反应③中O2为氧化产物 D、整个过程的总反应可表示2N2 + 6H2O = 4NH3 + 3O25. 绿水青山是构建美丽中国的伟大构想。一种以沸石笼为载体对NO进行催化还原的原理如图所示,下列说法正确的是( ) A、反应过程中O原子的成键数目保持不变 B、+作催化剂,虚线框内物质是中间体 C、反应⑤中只起氧化剂的作用 D、该原理的总反应为4NO+4NH3+O2=4N2+6H2O6. 关于反应4CO2+SiH44CO+SiO2+2H2O,下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、还原性:SiH4>CO7. 下列实验操作、现象和结论一致的是( )
A、反应过程中O原子的成键数目保持不变 B、+作催化剂,虚线框内物质是中间体 C、反应⑤中只起氧化剂的作用 D、该原理的总反应为4NO+4NH3+O2=4N2+6H2O6. 关于反应4CO2+SiH44CO+SiO2+2H2O,下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、还原性:SiH4>CO7. 下列实验操作、现象和结论一致的是( )选项
操作
现象
解释(或结论)
A
向补铁口服液中滴加几滴酸性KMnO4溶液
紫色褪去
补铁口服液中有Fe2+
B
向I2水中先加浓NaOH溶液,再加CCl4 , 振荡后静置
液体分层, 上层无色,下层紫红色
CCl4能萃取碘水中的碘,而NaOH溶液不能
C
向盛有1 mL乙酸乙酯的a、b两支试管中分别加入2 mL H2O、2 mLNaOH溶液,70 ~ 80℃热水浴
试管 a液体分层,酯层无明显 变化; 试管b酯层消失
乙酸乙酯在碱性条件下可以水解;
D
向Fe(NO3)3溶液中先加稀HNO3 ,再加NaCl
溶液黄色先褪去,再变为黄色
HNO3的强氧化性将Fe3+氧化为无色, Cl-的还原性再将其还原为Fe3+
A、A B、B C、C D、D8. 电子可以( )A、在氧化还原反应中发生转移 B、在电解质溶液中自由移动 C、与阳离子形成离子键 D、在原子核周围聚集成电子云9. 下列变化中,未涉及到电子转移的是( )A、使粉末变白 B、使酸性溶液褪色 C、KSCN溶液使含的溶液变红 D、使酸化的KI溶液变黄10. 用大苏打除去自来水中的余氯,反应的离子方程式为:。下列说法正确的是( )A、S元素化合价既升又降 B、氧化性: C、可用pH计指示反应终点 D、可用溶液检验还原产物11. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与投入量(用x表示)的关系如下图所示。下列说法正确的是( )
 A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,12. 依据下列实验现象推测,其反应原理不涉及氧化还原反应的是A、K2CO3溶液和NH4Cl溶液混合,产生刺激性气味 B、把钠放入CuSO4溶液中,有蓝色沉淀生成 C、向酸性KMnO4溶液中加入H2O2 , 溶液紫色褪去 D、氯水在光照条件下放置一段时间后,溶液的pH降低13. 以镉铁矿(主要成分为)为原料制备的部分工艺流程如下:
A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,12. 依据下列实验现象推测,其反应原理不涉及氧化还原反应的是A、K2CO3溶液和NH4Cl溶液混合,产生刺激性气味 B、把钠放入CuSO4溶液中,有蓝色沉淀生成 C、向酸性KMnO4溶液中加入H2O2 , 溶液紫色褪去 D、氯水在光照条件下放置一段时间后,溶液的pH降低13. 以镉铁矿(主要成分为)为原料制备的部分工艺流程如下:
已知溶于水,难溶于水。下列说法错误的是
A、已知在周期表中位于第五周期第ⅡB族,则的价层电子排布式是 B、还原镉时可产生 , 该反应中氧化剂与还原剂的物质的量之比为3∶1 C、“沉镉”所得滤液中的 , 其空间构型是正四面体 D、“转化”中发生的反应为:14. 臭氧层可阻止紫外线辐射,氟利昂(如CFCl3)破坏臭氧层的反应过程如图所示。下列说法正确的是 A、过程Ⅰ中断裂极性键C-F键 B、过程Ⅱ和Ⅲ中不涉及电子转移 C、臭氧被破坏的过程中Cl作催化剂 D、CFCl3的空间构型是正四面体形15. 下列除杂试剂选用正确且除杂过程涉及氧化还原反应的是
A、过程Ⅰ中断裂极性键C-F键 B、过程Ⅱ和Ⅲ中不涉及电子转移 C、臭氧被破坏的过程中Cl作催化剂 D、CFCl3的空间构型是正四面体形15. 下列除杂试剂选用正确且除杂过程涉及氧化还原反应的是选项
物质(括号内为杂质)
除杂试剂
A
蒸馏水、碱石灰
B
盐酸、溶液、二氧化碳
C
溶液、溶液、盐酸
D

酸性溶液
A、A B、B C、C D、D16. 下列药品易变质,其原因与氧化还原反应无关的是A、漂粉精 B、溶液 C、 D、烧碱17. 光催化固氮合成氨的机理如图所示,下列说法错误的是 A、NH3分子是极性分子 B、此反应中氮气做氧化剂 C、无论使用哪种催化剂,同一个反应的活化能是不变的 D、此反应的化学反应方程式是:2N2+6H2O4NH3+3O2
A、NH3分子是极性分子 B、此反应中氮气做氧化剂 C、无论使用哪种催化剂,同一个反应的活化能是不变的 D、此反应的化学反应方程式是:2N2+6H2O4NH3+3O2二、多选题
-
18. 界面上甲烷化的过程如图所示:

下列说法正确的是( )
A、转化过程中 做催化剂的载体,不参与转化历程 B、反应每生成 ,转移 电子 C、反应历程中存在极性键和非极性键的断裂与形成 D、转化过程中涉及氧化还原反应19. 是一种温和的氧化剂,试剂中的不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。氧化醇的反应机理如下图,下列说法正确的是( ) A、在上述6步反应中发生氧化还原反应的有2步 B、步骤④⑤中NMO将还原,生成试剂 C、步骤⑥的离子方程式为 D、若R1为 , R2为-H,则氧化该醇的主产物为2-丁烯醛20. 对废催化剂进行回收可有效利用金属资源,某含银废催化剂主要含Ag、α—Al2O3(α—Al2O3为载体,不溶于硝酸)及少量MgO、SiO2、K2O、Fe2O3等,一种回收制备高纯银粉工艺的部分流程如图:下列说法正确的是( )
A、在上述6步反应中发生氧化还原反应的有2步 B、步骤④⑤中NMO将还原,生成试剂 C、步骤⑥的离子方程式为 D、若R1为 , R2为-H,则氧化该醇的主产物为2-丁烯醛20. 对废催化剂进行回收可有效利用金属资源,某含银废催化剂主要含Ag、α—Al2O3(α—Al2O3为载体,不溶于硝酸)及少量MgO、SiO2、K2O、Fe2O3等,一种回收制备高纯银粉工艺的部分流程如图:下列说法正确的是( ) A、滤渣A中含SiO2、α—Al2O3 B、气体B可以通入NaOH溶液除去 C、溶解过程主要发生了复分解反应 D、“还原”过程中生成无毒气体,B与C的物质的量的理论比值为4:321. 在实验室进行铁粉和硫粉混合加热的实验,产物又进行了系列实验,流程如下。下列说法正确的是 ( )
A、滤渣A中含SiO2、α—Al2O3 B、气体B可以通入NaOH溶液除去 C、溶解过程主要发生了复分解反应 D、“还原”过程中生成无毒气体,B与C的物质的量的理论比值为4:321. 在实验室进行铁粉和硫粉混合加热的实验,产物又进行了系列实验,流程如下。下列说法正确的是 ( ) A、气体A和D含有同一物质,且均为氧化产物 B、硫元素至少参加了3个氧化还原反应 C、沉淀F可以和NaOH溶液在加热的条件下反应 D、若固体B中加浓硫酸,发生反应时被氧化的和被还原的均为同一种元素22. 为白色粉末,微溶于水,溶于浓盐酸或浓溶液,不溶于乙醇。往硫酸铜溶液中加入、 , 进行“还原,氯化”时,和的用量对产率的影响如图1、图2所示。下列说法中正确的是( )
A、气体A和D含有同一物质,且均为氧化产物 B、硫元素至少参加了3个氧化还原反应 C、沉淀F可以和NaOH溶液在加热的条件下反应 D、若固体B中加浓硫酸,发生反应时被氧化的和被还原的均为同一种元素22. 为白色粉末,微溶于水,溶于浓盐酸或浓溶液,不溶于乙醇。往硫酸铜溶液中加入、 , 进行“还原,氯化”时,和的用量对产率的影响如图1、图2所示。下列说法中正确的是( ) A、反应的离子方程式为 B、为减少的溶解损耗,可用乙醇洗涤沉淀 C、的用量越多,越大,的产率越大 D、易被空气氧化为 , 该反应中氧化剂和还原剂的物质的量之比为1:4
A、反应的离子方程式为 B、为减少的溶解损耗,可用乙醇洗涤沉淀 C、的用量越多,越大,的产率越大 D、易被空气氧化为 , 该反应中氧化剂和还原剂的物质的量之比为1:4三、非选择题
-
23. 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:(1)、氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许离子通过,氯气的逸出口是(填标号)。
 (2)、次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。(3)、Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为。(4)、ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为mol;产生“气泡”的化学方程式为。(5)、“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为kg(保留整数)。24. 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
(2)、次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。(3)、Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为。(4)、ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为mol;产生“气泡”的化学方程式为。(5)、“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为kg(保留整数)。24. 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下: +KMnO4→
+KMnO4→ 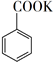 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl名称
相对分
子质量
熔点/℃
沸点/℃
密度/(g·mL−1)
溶解性
甲苯
92
−95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100℃左右开始升华)
248
——
微溶于冷水,易溶于乙醇、热水
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
(1)、根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A、100 mL B、250 mL C、500 mL D、1000 mL(2)、在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。(3)、加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。(4)、“用少量热水洗涤滤渣”一步中滤渣的主要成分是。(5)、干燥苯甲酸晶体时,若温度过高,可能出现的结果是。(6)、本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。A.70% B.60% C.50% D.40%
(7)、若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。25. 聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。(1)、将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为;水解聚合反应会导致溶液的pH。(2)、测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2 mol·L−1 K2Cr2O7溶液滴定至终点(滴定过程中 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。①上述实验中若不除去过量的Sn2+ , 样品中铁的质量分数的测定结果将(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程) 。
26. 水体中过量的抗生素会对环境造成极大危害,零价铁(Fe)及耦合技术在处理抗生素废水中应用广泛。(1)、I.还原法零价铁作为一种还原剂可以提供电子,水中的得电子生成(氢自由基),通过双键加成、单电子还原与抗生素发生反应。
氧化反应:。
还原反应:(电中性)。
(2)、与阿莫西林(抗生素的一种)发生多步反应,第一步如下图所示,请在图中标出阿莫西林断裂的化学键(参考示例“ ”),用“O”在中间产物圈出一个手性碳原子。
”),用“O”在中间产物圈出一个手性碳原子。 (3)、纳米零价铁5分钟去除甲硝唑接近100%,相同条件下非纳米零价铁去除率约为0%,试解释原因。(4)、II.氧化法
(3)、纳米零价铁5分钟去除甲硝唑接近100%,相同条件下非纳米零价铁去除率约为0%,试解释原因。(4)、II.氧化法酸性条件Fe可与溶解氧生成 , 和作用生成羟基自由基和 , 氧化抗生素。和生成的离子方程式是。
(5)、下图为酸性条件零价铁−电芬顿耦合法(电化学氧化法)原理示意图的一部分,左侧连接电源 , 结合阴极电极反应说明该法生成的原理。 27. 碘是人体所必需的微量元素。磷酸工业的副产品氟硅酸(H2SiF6)中碘元素的可能存在形式有I2、I-、I , 其回收方案如下。
27. 碘是人体所必需的微量元素。磷酸工业的副产品氟硅酸(H2SiF6)中碘元素的可能存在形式有I2、I-、I , 其回收方案如下。
回答下列问题:
(1)、某实验小组想证明氟硅酸溶液中存I , 请补充完整的实验步骤:(已知:I2+I- I;可选用的试剂:5%淀粉溶液、0.1 mol·L-1NaNO2溶液、0.1mol·L-1Na2SO3溶液、6mol·L-1H2SO4溶液)
①取样品,加入CCl4振荡、静置,可观察到下层呈紫红色;
②分液后取上层黄色液体,滴入适量(填选用的试剂,下同),可观察到;
③重复上述操作2~3次,直至步骤②中没有明显现象;
④再滴加适量 , 若观察到溶液变蓝,证明氟硅酸溶液中存在I。
(2)、实验室利用分液漏斗可以完成CCl4从碘水萃取I2 , 请描述获得上层液体的操作:。(3)、“还原”步骤中将碘元素全部变为HI,写出I2被还原时的离子方程式。(4)、工业生产中,氧化剂的实际使用量和理论计算量之间的比值称为配氧率。如图是配氧率对碘单质回收率的影响曲线图,试解释配氧率选择112~113之间的原因。 (5)、结合信息,请确定I2与NaOH发生“歧化”反应的氧化产物(有必要的计算过程)。
(5)、结合信息,请确定I2与NaOH发生“歧化”反应的氧化产物(有必要的计算过程)。已知:①氧化还原反应可以拆分为两个半反应,标准电极电势分别表示为φθ(+)、φθ(-),标准电动势Eθ=φθ(+)-φθ(-),如
Zn+Cu2+=Zn2++Cu的 Eθ=φθ(Cu2+/Cu)—φθ(Zn2+/Zn)。
②Eθ>0,该反应能自发进行,Eθ>0.3V,反应趋于完全进行。
③φθ(I2/I-)=0.54V φθ(IO-/I2)=0.45V φθ(IO/I2)=0.21V
28. 镍及其化合物在化工生产中有广泛应用。某实验室用工业废弃的NiO催化剂(含有Fe2O3、CaO、CuO、BaO等杂质)为原料制备Ni2O3的实验流程如下:
已知:常温时Ksp(CaF2)=2.7×10-11 , Ksp(CuS)=1.0×10-36;Fe3+不能氧化Ni2+。有关氢氧化物开始沉淀的pH和完全沉淀的pH如下表所示:
氢氧化物
Fe(OH)3
Fe(OH)2
Ni(OH)2
开始沉淀的pH
1.5
6.5
7.7
完全沉淀的pH
3.7
9.7
9.2
(1)、Fe的原子结构示意图为。(2)、滤渣的主要成分为。(3)、实验室中操作A除去不溶性杂质用到的玻璃仪器有。(4)、加入H2O2的目的是;调pH的范围是。(5)、加入NaF的目的是进一步除去Ca2+ , 当c(F-)=0.001mol·L-1 , c(Ca2+)=mol·L-1.(6)、“氧化”过程中加入的试剂X可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成NiOOH的离子方程式。29. Na2FeO4具有强氧化性,是一种新型的绿色非氯净水消毒剂,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3。可用Fe(OH)3与NaClO在强碱性条件下制取,某实验小组利用如图所示实验装置,制取Na2FeO4 , 并验证其处理含CN-废水的能力。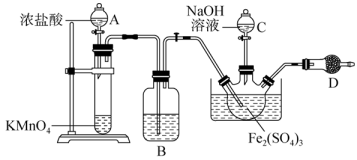 (1)、Ⅰ.制取Na2FeO4
(1)、Ⅰ.制取Na2FeO4仪器D的名称为。洗气瓶B中盛有的试剂为。实验开始,先打开分液漏斗(填“A”或“C”)的活塞。
(2)、写出大试管中发生反应的离子方程式:。(3)、三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、。(4)、Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有(填序号,下同)。

②计算NaCN溶液中CN-的去除率为(保留两位有效数字)。
30. 铬镀在金属上可以防锈,坚固美观。一种以铬铁矿[主要成分为Fe(CrO2)2 , 还含有Al2O3等]为原料生成金属铬的工艺流程如下图:
已知:①NaFeO2极易水解;
②Cr(VI)在中性或碱性溶液中以形式存在,在酸性条件下以形式存在;
③常温时,Al(OH)3+OH-[的平衡常数:K=100.63 , Al(OH)3的溶度积常数:Ksp[Al(OH)3]=10-33;
回答下列问题:。
(1)、Fe(CrO2)2中铬元素的化合价为。(2)、“焙烧”时,气体和矿料逆流加入的原因是 , Fe(CrO2)2反应生成NaFeO2和Na2CrO4 , 该反应中氧化剂和还原剂的物质量之比为。(3)、“水浸”时,生成Fe(OH)3的离子方程式为。(4)、常温下,“酸化I”时,铝元素完全转化为沉淀的pH范围为(通常认为溶液中离子浓度小于10-5mol·L-1沉淀完全)。(5)、“酸化II”的目的是。(6)、“还原”时,反应的离子方程式为。(7)、“电解”时,金属铬在(填“阳”或“阴”)极上产生。31. 硼氢化钠在化工等领域具有重要的应用价值,工业上可用硼镁矿(生要成分为 , 含少量杂质)制取 , 其工艺流程如下:
已知:硼氢化钠常温下能与水反应,易溶于异丙胺(沸点为)。
(1)、和都是硼酸盐,请写出一元弱酸硼酸在水中的电离方程式。(2)、粉碎的目的是;滤渣的成分是(写化学式、下同)。(3)、操作1的步骤是、冷却结晶;操作2、操作3的名称分别为、。(4)、高温合成过程中,加料之前需先在反应器中通入氩气,该操作的目的是。(5)、流程中可循环利用的物质是。写出副产物硅酸钠的一种用途。(6)、被称为万能还原剂,“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克的还原能力。的有效氢含量为(保留两位小数)。32. (三)H2O2(H-O-O-H)既有氧化性又有还原性,其中氧处于中间价态。完成下列填空:
 (1)、H2O2是二元弱酸,则H2O2的第一步电离方程式为。(2)、已知:4H2O2+Cr2O72-+2H+
(1)、H2O2是二元弱酸,则H2O2的第一步电离方程式为。(2)、已知:4H2O2+Cr2O72-+2H+ 2CrO5+5H2O,CrO5结构如图所示,该反应(选填“是”或“不是”)氧化还原反应,理由是。 (3)、少量Mn2+催化分解H2O2的反应分两步进行,第一步:H2O2+Mn2+=MnO2+2H+;写出第二步反应的离子方程式。
2CrO5+5H2O,CrO5结构如图所示,该反应(选填“是”或“不是”)氧化还原反应,理由是。 (3)、少量Mn2+催化分解H2O2的反应分两步进行,第一步:H2O2+Mn2+=MnO2+2H+;写出第二步反应的离子方程式。称取1.023 g NaBO3·4H2O(M=153.86 g·mol-1)加入20.0 mL 1 mol·L-1 H2SO4(aq)酸化后定容至100 mL,取出10.00 mL用0.01046 mol·L-1 的KMnO4(aq)滴定至终点,消耗KMnO4(aq) 24.34 mL。
已知:① BO3-+2H2O=H2O2+H2BO3-
② MnO4-+H2O2+H+→Mn2++O2↑+H2O(未配平)
(4)、配平离子方程式。2MnO4-+5H2O2+_H+=_Mn2++_O2↑+_H2O
(5)、实验所需的定量仪器有电子天平、量筒、。(6)、滴定终点的现象为溶液变为色,且30 s不变色。理论上消耗KMnO4(aq)mL,实验过程操作正确,产生误差的原因可能是。33. 在制备NiOOH的某种工艺流程,所得NiOOH常会混有 , 其组成可表示为。现称取10.14g样品溶于稀硫酸,加入100mL 1.0000 标准溶液,搅拌至溶液清亮,定容至200mL。取出20.00mL,用0.0100 标准溶液滴定,用去标准溶液20.00mL,请通过计算确定x:y的值并写出计算过程。涉及反应如下:34. 根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:(1)、还原产物是。还原剂与还原产物的物质的量之比为。(2)、当有2 mol HNO3参加反应时,被氧化的物质质量为g。35. 现有一瓶常见一元酸形成的铵盐固体,为测定其中的含氮量可以采用“甲醛法”,即:(未配平)。现称取4g该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100mL溶液。取出5mL,滴入酚酞后再逐滴滴入的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色。计算:(1)、过程中消耗的甲醛物质的量为mol。(2)、该铵盐中氮的质量分数是%。(写出计算过程)