高考二轮复习知识点:微粒半径大小的比较2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是A、电负性:X>Y>Z>W B、原子半径:X<Y<Z<W C、Y和W的单质都能与水反应生成气体 D、Z元素最高价氧化物对应的水化物具有强氧化性2. 一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子与具有相同的电子结构。下列叙述正确的是A、X的常见化合价有、 B、原子半径大小为 C、YX的水合物具有两性 D、W单质只有4种同素异形体3. W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是A、原子半径: B、简单氢化物的沸点: C、与可形成离子化合物 D、的最高价含氧酸是弱酸4. 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是( )
 A、原子半径:Al<Si B、第一电离能:Mg<Ca C、Fe位于元素周期表的p区 D、这六种元素中,电负性最大的是O5. 下列性质的比较中,错误的是A、非金属性:N<O B、沸点: C、原子半径:N<O D、酸性:6. 我国科学家合成了一种深紫外非线性光学晶体新材料 , 晶体中阴离子为。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的轨道有3个电子。下列说法中错误的是A、电负性: B、简单离子半径: C、简单气态氢化物的稳定性: D、M最高价氧化物对应水化物能与盐酸反应7. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z,化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )A、原子半径:r(Z)>r(Y)>r(X)>r(W) B、非金属性:W>X>Y>Z C、含有Z的含氧酸均为强酸 D、Y的最高价氧化物的水化物是强碱8. 下列比较正确的是( )A、原子半径: B、第一电离能: C、碱性: D、热稳定性:9. W、X、Y、Z为原子半径依次增大的短周期主族元素,在周期表中互不相邻。W、Z同主族,X、Z的质子数相差3,X和Y最外层电子数之和为8。下列叙述正确的是( )A、简单离子半径: B、X分别与W、Z元素均可形成两种或两种以上二元化合物 C、ZW为共价化合物 D、Y的最高价氧化物对应水化物的碱性比Z强10. X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰,生成ZW型化合物;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是
A、原子半径:Al<Si B、第一电离能:Mg<Ca C、Fe位于元素周期表的p区 D、这六种元素中,电负性最大的是O5. 下列性质的比较中,错误的是A、非金属性:N<O B、沸点: C、原子半径:N<O D、酸性:6. 我国科学家合成了一种深紫外非线性光学晶体新材料 , 晶体中阴离子为。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的轨道有3个电子。下列说法中错误的是A、电负性: B、简单离子半径: C、简单气态氢化物的稳定性: D、M最高价氧化物对应水化物能与盐酸反应7. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z,化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )A、原子半径:r(Z)>r(Y)>r(X)>r(W) B、非金属性:W>X>Y>Z C、含有Z的含氧酸均为强酸 D、Y的最高价氧化物的水化物是强碱8. 下列比较正确的是( )A、原子半径: B、第一电离能: C、碱性: D、热稳定性:9. W、X、Y、Z为原子半径依次增大的短周期主族元素,在周期表中互不相邻。W、Z同主族,X、Z的质子数相差3,X和Y最外层电子数之和为8。下列叙述正确的是( )A、简单离子半径: B、X分别与W、Z元素均可形成两种或两种以上二元化合物 C、ZW为共价化合物 D、Y的最高价氧化物对应水化物的碱性比Z强10. X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰,生成ZW型化合物;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是 A、Y与W形成的分子空间结构为三角锥 B、V单质微溶于Y与V组成的二元化合物 C、原子半径的大小关系为:Z>V>W D、热稳定性:X与V组成的二元化合物>X与W组成的二元化合物11. 化合物M(结构式如下图所示)可用于口腔清洁。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,W与Z、X与Y分别同主族,Y、Z对应的简单离子核外电子排布相同。下列说法错误的是( )
A、Y与W形成的分子空间结构为三角锥 B、V单质微溶于Y与V组成的二元化合物 C、原子半径的大小关系为:Z>V>W D、热稳定性:X与V组成的二元化合物>X与W组成的二元化合物11. 化合物M(结构式如下图所示)可用于口腔清洁。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,W与Z、X与Y分别同主族,Y、Z对应的简单离子核外电子排布相同。下列说法错误的是( ) A、原子半径大小顺序为Z>Y>X>W B、化合物Z2X2与水反应生成X2 C、简单氢化物的稳定性X>Y D、化合物M中X的化合价均为-212. 短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素,四种元素形成的一种化合物可作软水剂和缓冲剂(结构如图)。下列说法正确的是( )
A、原子半径大小顺序为Z>Y>X>W B、化合物Z2X2与水反应生成X2 C、简单氢化物的稳定性X>Y D、化合物M中X的化合价均为-212. 短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素,四种元素形成的一种化合物可作软水剂和缓冲剂(结构如图)。下列说法正确的是( ) A、简单离子半径: X< Y B、简单氢化物的稳定性: Z>X C、X与Z形成的化合物不能用作食品干燥剂 D、W分别与Y、Z形成的化合物中所含化学键类型相同13. 依据元素周期律,下列判断不正确的是( )A、第一电离能: B、原子半径: C、电负性: D、酸性:14. W、X、Y、Z为原子序数依次增大的短周期主族元素。W和Z同主族,Y、Z的原子序数分别是W、X的2倍,X的单质在空气中含量最多。下列说法一定正确的是A、原子半径大小:X>Z B、氢化物的沸点高低:X>W C、一定条件下,Y单质与反应可生成两种离子化合物 D、W单质与Z的氧化物发生置换反应,则非金属性:W>Z15. 由同周期元素原子W、X、Y、Z构成的一种阴离子(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20。下列说法正确的是( )
A、简单离子半径: X< Y B、简单氢化物的稳定性: Z>X C、X与Z形成的化合物不能用作食品干燥剂 D、W分别与Y、Z形成的化合物中所含化学键类型相同13. 依据元素周期律,下列判断不正确的是( )A、第一电离能: B、原子半径: C、电负性: D、酸性:14. W、X、Y、Z为原子序数依次增大的短周期主族元素。W和Z同主族,Y、Z的原子序数分别是W、X的2倍,X的单质在空气中含量最多。下列说法一定正确的是A、原子半径大小:X>Z B、氢化物的沸点高低:X>W C、一定条件下,Y单质与反应可生成两种离子化合物 D、W单质与Z的氧化物发生置换反应,则非金属性:W>Z15. 由同周期元素原子W、X、Y、Z构成的一种阴离子(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20。下列说法正确的是( )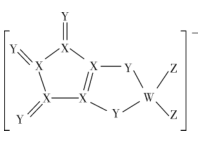 A、W、X、Y、Z第一电离能由大到小依次是:Z>Y>X>W B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、W和X的最高价氧化物对应水化物的酸性:W>X D、W、Z形成的化合物分子中各原子均满足8电子稳定结构16. 近日,科学家研究利用CaF2晶体释放出的Ca2+和F-脱除硅烷,拓展了金属氟化物材料的生物医学功能。下列说法不正确的是( )
A、W、X、Y、Z第一电离能由大到小依次是:Z>Y>X>W B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、W和X的最高价氧化物对应水化物的酸性:W>X D、W、Z形成的化合物分子中各原子均满足8电子稳定结构16. 近日,科学家研究利用CaF2晶体释放出的Ca2+和F-脱除硅烷,拓展了金属氟化物材料的生物医学功能。下列说法不正确的是( ) A、F、Si和Ca 电负性依次减小,原子半径依次增大 B、OF2与 SiO2中含有化学键类型和氧原子杂化方式均相同 C、图中A处原子分数坐标为(0,0,0),则B 处原子分数坐标为 D、脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力17. 短周期元素W、R、X、Y、Z原子序数依次增大,可形成甲、乙(结构如图)两种具有强还原性的物质,且X、Z同主族。下列说法错误的是( )
A、F、Si和Ca 电负性依次减小,原子半径依次增大 B、OF2与 SiO2中含有化学键类型和氧原子杂化方式均相同 C、图中A处原子分数坐标为(0,0,0),则B 处原子分数坐标为 D、脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力17. 短周期元素W、R、X、Y、Z原子序数依次增大,可形成甲、乙(结构如图)两种具有强还原性的物质,且X、Z同主族。下列说法错误的是( )
 A、W、X分别是氢元素和硼元素 B、五种元素中,Y原子半径最大 C、Z元素最高价氧化物对应的水化物具有两性 D、单质Y和R在空气中均可燃烧,燃烧产物所含化学键类型完全相同18. X、Y、Z、W为原子序数依次增大的短周期主族元素,X和Y形成的简单化合物常用作制冷剂,Z的一种氧化物与其氢化物在水溶液中反应产生沉淀,下列叙述正确的是( )A、简单离子半径:W>Z>Y>X B、W的含氧酸的酸性比Z的含氧酸的酸性强 C、Y与X形成的化合物中一定只含有极性共价键 D、W的单质可以从Y的简单氢化物中置换出Y的单质19. 下列关于Li、O、Al、S元素及其化合物的叙述错误的是( )A、Al3+离子的电子排布式:1s22s22p63s23p1 B、碱性:LiOH>Al(OH)3 C、原子半径 D、简单气态氢化物的热稳定性:H2O>H2S20. 已知W、X、Y、Z均为短周期主族元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH值和原子半径、原子序数的关系如图所示。下列说法正确的是( )
A、W、X分别是氢元素和硼元素 B、五种元素中,Y原子半径最大 C、Z元素最高价氧化物对应的水化物具有两性 D、单质Y和R在空气中均可燃烧,燃烧产物所含化学键类型完全相同18. X、Y、Z、W为原子序数依次增大的短周期主族元素,X和Y形成的简单化合物常用作制冷剂,Z的一种氧化物与其氢化物在水溶液中反应产生沉淀,下列叙述正确的是( )A、简单离子半径:W>Z>Y>X B、W的含氧酸的酸性比Z的含氧酸的酸性强 C、Y与X形成的化合物中一定只含有极性共价键 D、W的单质可以从Y的简单氢化物中置换出Y的单质19. 下列关于Li、O、Al、S元素及其化合物的叙述错误的是( )A、Al3+离子的电子排布式:1s22s22p63s23p1 B、碱性:LiOH>Al(OH)3 C、原子半径 D、简单气态氢化物的热稳定性:H2O>H2S20. 已知W、X、Y、Z均为短周期主族元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH值和原子半径、原子序数的关系如图所示。下列说法正确的是( ) A、简单离子半径:Z>Y>W>X B、Z的单质具有强氧化性和漂白性 C、同浓度简单氢化物水溶液的酸性:Z>Y D、化合物X2Y2中含有极性共价键和非极性共价键
A、简单离子半径:Z>Y>W>X B、Z的单质具有强氧化性和漂白性 C、同浓度简单氢化物水溶液的酸性:Z>Y D、化合物X2Y2中含有极性共价键和非极性共价键二、多选题
-
21. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是
 A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键22. 短周期主族元素W、X、Y、Z的原子序数依次增大,且位于同一周期,W、X的核电荷数之和等于Z的核外电子总数,由这四种元素组成的化合物(M)的结构如图所示。下列推断错误的是( )
A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键22. 短周期主族元素W、X、Y、Z的原子序数依次增大,且位于同一周期,W、X的核电荷数之和等于Z的核外电子总数,由这四种元素组成的化合物(M)的结构如图所示。下列推断错误的是( )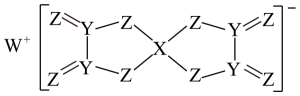 A、原子半径:W>X>Y>Z B、最简单氢化物的稳定性:Z>Y C、熔点:W2Z<YZ D、M中所有原子均达到8电子结构23. M、X、Y、Z、W均为短周期元素,且原子序数依次减小,并能形成如图所示化合物,下列说法正确的是( )
A、原子半径:W>X>Y>Z B、最简单氢化物的稳定性:Z>Y C、熔点:W2Z<YZ D、M中所有原子均达到8电子结构23. M、X、Y、Z、W均为短周期元素,且原子序数依次减小,并能形成如图所示化合物,下列说法正确的是( ) A、简单离子半径: B、简单氢化物的稳定性: C、X与W形成的某种化合物可使酸性高锰酸钾溶液褪色 D、由M、X、Z、W四种元素组成的化合物的水溶液可能显碱性24. 短周期主族元素X、Y、Z、M的原子序数依次递增,Z、M的单质均能与水发生剧烈的化学反应,Z的最外层电子数是X、Y的最外层电子数之和,且X、Y相邻。下列有关说法正确的是( )A、离子半径:M>Z B、Z、M可以形成离子化合物 C、X、Y最高价含氧酸的酸性:X<Y D、X、Y分别与Z形成的二元化合物中,各原子最外层均满足8e-结构25. Al、P、S、Cl是周期表中短周期主族元素。下列有关说法正确的是( )A、元素Al在周期表中位于第四周期ⅢA族 B、元素P的简单气态氢化物的化学式为 C、原子半径 D、最高价氧化物的水化物的酸性:26. 近年来中国地质调查局在自然界中发现了新矿物——氟栾锂云母。该矿除含F和Li外,还含原子序数依次增大的W、X、Y、Z四种元素,已知它们的原子序数均不超过20,W、Y、Z的最外层电子数之和等于11,W的最低化合价为 价,X在元素周期表中所处的族序数等于其周期序数。下列说法错误的是( )A、X的金属性比Z的强 B、原子半径:W>Y C、 中含离子键和共价键 D、X、Y的最高价氧化物对应的水化物均可与Z的最高价氧化物对应的水化物反应27. W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W与Y位于相邻主族,W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图。下列叙述正确的是( )
A、简单离子半径: B、简单氢化物的稳定性: C、X与W形成的某种化合物可使酸性高锰酸钾溶液褪色 D、由M、X、Z、W四种元素组成的化合物的水溶液可能显碱性24. 短周期主族元素X、Y、Z、M的原子序数依次递增,Z、M的单质均能与水发生剧烈的化学反应,Z的最外层电子数是X、Y的最外层电子数之和,且X、Y相邻。下列有关说法正确的是( )A、离子半径:M>Z B、Z、M可以形成离子化合物 C、X、Y最高价含氧酸的酸性:X<Y D、X、Y分别与Z形成的二元化合物中,各原子最外层均满足8e-结构25. Al、P、S、Cl是周期表中短周期主族元素。下列有关说法正确的是( )A、元素Al在周期表中位于第四周期ⅢA族 B、元素P的简单气态氢化物的化学式为 C、原子半径 D、最高价氧化物的水化物的酸性:26. 近年来中国地质调查局在自然界中发现了新矿物——氟栾锂云母。该矿除含F和Li外,还含原子序数依次增大的W、X、Y、Z四种元素,已知它们的原子序数均不超过20,W、Y、Z的最外层电子数之和等于11,W的最低化合价为 价,X在元素周期表中所处的族序数等于其周期序数。下列说法错误的是( )A、X的金属性比Z的强 B、原子半径:W>Y C、 中含离子键和共价键 D、X、Y的最高价氧化物对应的水化物均可与Z的最高价氧化物对应的水化物反应27. W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W与Y位于相邻主族,W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图。下列叙述正确的是( ) A、X与Z既可形成10电子分子也可形成18电子分子 B、简单离子半径: C、Y的最高价氧化物对应水化物为强酸 D、该化合物中各元素原子最外层均满足8电子稳定结构
A、X与Z既可形成10电子分子也可形成18电子分子 B、简单离子半径: C、Y的最高价氧化物对应水化物为强酸 D、该化合物中各元素原子最外层均满足8电子稳定结构三、非选择题
-
28. 离子型金属氢化物、、、等,具有强还原性,也可作生氢剂。(1)、核外不同能量的电子数之比为:(按能量由低至高的顺序)。(2)、将、、、按半径由小到大的排列顺序为。(3)、1个中含电子,补写一个与电子数相同且带一个单位负电荷的离子的电子式:、。(4)、两种硼化物的熔点如表所示:
硼氢化物
熔点/℃
400
两物质熔点差异的原因是。
(5)、工业上常用“有效氢”含量衡量含氢还原剂的还原能力,有效氢指单位质量(克)的含氢还原剂的还原能力相当于多少克氢气的还原能力。的有效氢含量约为(2位小数)。工业上可利用下述工艺得到氢气。
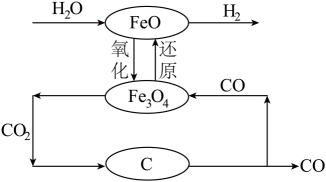 (6)、其中的平衡常数的表达式 , 上述反应达到平衡时,容器内气体的平均摩尔质量为 , 若保持恒温恒容,向该容器中加入少量 , 再次达平衡后,气体的平均摩尔质量为 , 比较、的大小,并说明理由。(7)、该工艺的总反应方程式为:。29. 碳酸锂是生产锂离子电池的重要原料。(1)、碳酸锂制取锂的反应原理为:
(6)、其中的平衡常数的表达式 , 上述反应达到平衡时,容器内气体的平均摩尔质量为 , 若保持恒温恒容,向该容器中加入少量 , 再次达平衡后,气体的平均摩尔质量为 , 比较、的大小,并说明理由。(7)、该工艺的总反应方程式为:。29. 碳酸锂是生产锂离子电池的重要原料。(1)、碳酸锂制取锂的反应原理为:① ;
② 。
锂原子的电子排布式为;CO2的结构式为;反应②中物质涉及的化学键类型有。
(2)、碳原子核外电子有种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道分别是。(3)、氢化锂(LiH)是离子化合物,写出其阴离子的电子式 , 氢负离子(H-)与锂离子具有相同电子层结构,试比较两者微粒半径的大小,并用原子结构理论加以解释:。(4)、用 、氨水和液溴制备 。除生成 外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式: ,。(5)、磷酸亚铁锂电池总反应为: ,放电时,负极为(填写化学式)。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有 气体(标准状况)产生时,该电池消耗锂的质量为。30. NaNO2 是一种白色易溶于水的固体,俗称工业盐,在漂白、电镀等方面应用广泛,完成下列填空:(1)、钠元素核外有种能量不同的电子;氮元素原子最外层电子的轨道排布式为。(2)、NaNO2晶体类型是;组成NaNO2的三种元素,其对应的简单离子半径由小到大的顺序为。31. 二氧化氯(ClO2)可以除去工业污水中的氰化物,反应的离子方程式为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-完成下列填空:
(1)、上述反应所涉及元素的原子半径由大到小的顺序是;其中原子核外有两个未成对电子的元素有。请比较碳和氮元素非金属性强弱(用一个化学反应方程式表示)。(2)、二氧化氯还可以除去污水中的锰离子,请配平如下反应:。ClO2+MnSO4+H2O→MnO2↓+HCl+H2SO4
若反应中生成0.2molMnO2 , 则电子转移个。
(3)、氯的另一种氧化物Cl2O每个原子都达到8电子稳定结构,它的电子式为。(4)、另一种处理含氰化物污水的方法是电解法,分析判断CN-是在极上(选填编号:①阴;②阳)被反应成CO2和N2 , 判断的依据是。32. 聚合氯化铝晶体([Al2(OH)nCl(6-n)•XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。回答下列问题:
(1)、铝原子核外能量最高的电子有个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。(2)、比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。(3)、铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3 , 如果先除去铝灰中的金属氧化物杂质可选用(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式。(4)、制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因33. 汽车安全气囊中填充叠氮酸钠 和硝酸钾 。汽车发生猛烈撞击时, 会迅速分解产生 和Na,Na单质可与 继续反应。完成下列填空:(1)、原子最外层电子的电子排布式为 , 氮气的电子式为。(2)、请将 、 、 按照离子半径由大到小的顺序排列 填离子符号 。(3)、 的金属性强于Na,用一个事实说明。(4)、配平Na与 反应的化学方程式,并标出电子转移的方向与数目:,若标准状况下生成 氮气,转移的电子数目为 。
(5)、请解释 晶体比 晶体熔点低的原因。34. 以硼砂、萤石和浓硫酸为原料可制取有机合成的原料三氟化硼。反应原理为B2O3(S)+3CaF2(S)+3H2SO4(浓)⇌2BF3(g)+3CaSO4(S)+3H2O(l)。
请完成下列填空:
(1)、写出萤石的电子式 , 已知BF3为非极性分子,则其分子构型可能为(选填编号)。A.三角锥形
B.平面正三角形
C.直线形
D.正四面体形
(2)、试写出硼原子的最外层电子排布式,硼原子核外有种不同形状的电子云。(3)、除硼元素外的其他短周期元素的简单离子的半径由小到大排列的是(用离子符号表示)。有些元素在元素周期表中相邻,能比较它们的金属性和非金属性强弱的有(选填编号)。A.相互之间的置换反应
B.最高价氧化物对应的水化物的酸性
C.氢化物水溶液的酸性
D.相互形成的化合物中元素的化合价
实验室中在8L的密闭容器中进行该反应。
(4)、已知该反应的化学平衡常数表达式K=[BF3]2 , 下列措施能缩短反应达到平衡的时间的有_________(选填编号)。A、增大硫酸的浓度 B、缩小反应容器体积 C、投入更多的萤石 D、升高反应炉内温度(5)、此反应达到平衡后,压缩容器体积,在平衡移动的过程中逆反应速率的变化情况是。一定条件下,经5min达到平衡,容器中液态物质减少24g,用气体生成物来表示该反应的速率为。35. X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)、L的名称为;五种元素的原子半径从大到小的顺序为(用元素符号表示)。(2)、Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,工业合成A的化学方程式为 , B的结构式为。在标准状况下,将A充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,(假设溶质不扩散)最后烧瓶内溶液中溶质的物质的量浓度为(精确到0.001)。(3)、硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应水化物的化学式为。